镁和稀盐酸反应异常现象的探究
2016-03-16黄图伦
黄图伦
摘要:对足量镁和稀盐酸反应出现灰白色浑浊的异常现象进行探究,提出沉淀成分可能为氯化镁、细颗粒镁粉或氢氧化镁等多种假说;最终实证分析认定,固体产物是不同化学组成的碱式氯化镁的混合物。经此探究得出的启示是:(1)教材中镁与酸的实验选用稀硫酸的做法是合理的,实际教学中不宜随意更换;(2)实验教学应充分利用好异常现象这一资源,设计开展学生参与的交流和探究活动,促进学生思维的深层次发展。
关键词:镁;稀盐酸;稀硫酸;异常现象;实验教学
文章编号:1005–6629(2016)3–0064–04 中图分类号:G633.8 文献标识码:B
现行初、高中化学教材都设置有较活泼金属与稀盐酸或稀硫酸反应置换氢气的实验,如苏教版高中《化学1》必修教材[1]在探讨镁的化学性质时就设置了镁与稀硫酸的反应:在一支试管中放入一小段擦去氧化膜的镁条,再向试管中加入一定量的稀硫酸,观察现象。
在开展学生分组实验时,因实验室稀硫酸备存量不足,实验员临时选择了稀盐酸替代。教学中有学生报告,试管中出现了灰白色沉淀!笔者课后让该同学重演了整个实验过程:用一小试管,取 4mL 0.1 mol·L-1稀盐酸,加入一段长约4cm的去除氧化膜的镁带,静置片刻,沉淀果然如期而至!
一个看似很简单的中学实验,为什么会出现如此异常现象?对此,课下师生们又一起对该实验进行了更深入的研究。

实验1 4支小试管各取4mL 0.1 mol·L-1稀盐酸,再分别加入一定长度的已去除氧化膜的镁带,静置并观察现象,比较沉淀的生成量。结果见表1。
结论:实验1说明一定量稀盐酸与少量金属镁反应并不出现异常现象,但增加镁带用量,在其溶解产生气泡的同时,会伴有灰白色(或白色)的沉淀生成。可见,镁用量的多少是决定体系是否出现异常的原因。
那么,灰白色物质到底是什么?为弄清成因,学生进行了激烈讨论,最后形成了3种代表性意见,然后据此设计相关实验进行验证。
2.1 观点1:氯化镁晶体析出
有学生认为,由于金属镁用量较多,反应后氯化镁的生成量偏多,在溶液中可能因过饱和而析出。由《化学辞典》[2]查得,氯化镁为无色三方晶系晶体,100g水中溶解的量为54.8g(20℃)、73.0g(100℃)。说明常温下氯化镁极易溶于水,即使是20℃下的饱和溶液浓度也可超过5 mol·L-1。
实验2 将实验1中D试管久置,倾析法倒去上层溶液得灰白色沉淀,然后加入5mL蒸馏水,充分振荡静置,沉淀量未减少。若用小试管取等质量氯化镁固体(分析纯),加等量蒸馏水,稍振荡即全部溶解得澄清溶液。
可见,氯化镁易溶于水,而灰白色生成物溶解性则相对要差得多,观点1不足为信。
2.2 观点2:反应后镁粉剩余
若做过铝箔与盐酸反应的实验,如下现象可能并不陌生:剧烈反应,气泡上窜,溶液变浑浊,有大量浅灰白色沉淀生成。很多学者[3,4]证实,该浅灰白色物质能与酸或强碱反应,并有微量气泡放出。由此认识到,灰白色悬浊物应含有细颗粒状的铝,产生原因是反应太剧烈而从铝箔表面脱落所致。那么,足量镁与稀盐酸反应后的灰白色沉淀是否也是镁粉细颗粒呢?
实验3 小试管取适量上述实验后的灰白色沉淀,加入3mL 0.1 mol·L-1的稀盐酸,沉淀立即溶解消失,但没有气泡生成。
若样品为(或存在)镁粉,加入稀盐酸会产生H2。实验3现象说明足量镁与稀盐酸反应后得到的灰白色沉淀并非细颗粒状的镁粉。
2.3 观点3:生成了氢氧化镁
持这种观点的学生是这么理解的:由于镁的还原性略逊于钠,常温下就能与水反应。足量镁与稀盐酸反应的后期,可认为是剩余金属镁在氯化镁溶液中继续与水反应。由于溶液中存在氯离子,对金属表面的难溶性生成物氢氧化镁有钻穿效应而使之脱落,破坏了对内部金属的保护作用,使镁在常温下能与氯化镁溶液持续反应,不断生成大量气泡和氢氧化镁沉淀。
实验4 小试管取5mL蒸馏水,加入一小段去除氧化膜的镁带,镁带表面先有少量气泡生成后消失,蒸馏水仍澄清。继续加入几滴氯化镁饱和溶液,镁带表面立即持续产生细小气泡并不断溶解,约3min后试管中出现白色浑浊,20min后镁带全部溶解,小试管中剩余大量灰白色沉淀。
实验5 将实验4中的灰白色沉淀充分蒸馏水洗,直至最后一次洗涤液中加硝酸银溶液后浑浊现象不明显为止。然后加入适量0.1 mol·L-1稀硝酸,沉淀立即溶解,继续滴加几滴0.1 mol·L-1硝酸银溶液,出现大量白色浑浊。若改以实验1所得沉淀作样品重复实验,现象相同。
实验6 将少量灰白色沉淀蒸馏水洗并室温晾干。然后取样,按图1加热固体,用湿润的紫色石蕊试纸检验气体产物,试纸变红;若另取一头用硝酸银溶液浸润的玻璃棒悬于试管口,出现白色浑浊。

实验4说明镁在氯化镁溶液中能反应生成灰白色沉淀。结合实验5和6,镁与稀盐酸或氯化镁溶液得到的沉淀样品均可溶于强酸,且無论是用硝酸溶解后的溶液还是固体样品直接加热,都检测到了氯元素的存在。因此,认为沉淀是(或者只是)氢氧化镁的观点也是站不住脚的。
基于实证与分析,原有设想一一遭到了否定。正在大家困惑不已时,有位学生提出了一种新设想:电解法制镁所用原料无水氯化镁,需要将MgCl2·6H2O在干燥的HCl气流中加热才能得到,若在空气中加热生成的则是Mg(OH)Cl或MgO;那么,足量镁与稀盐酸反应生成的灰白色沉淀是否也可能是碱式盐一类的物质呢?
2.4 观点4:生成碱式氯化镁
实验7 在小烧杯中放入约50mL 0.01 mol·L-1稀盐酸,然后加入两段各5cm的去除氧化膜的镁带,观察实验现象,用pH计监测反应过程中溶液pH变化并读数。实验结果见表2。

由实验7可知,足量镁与稀盐酸反应过程中,溶液的pH逐渐增大,但酸性介质范围内并不会有浑浊产生,只有当镁与稀盐酸(实际为镁与氯化镁溶液)的反应体系呈弱碱性并碱性逐步增强时,灰白色沉淀才逐渐出现、增多。联系实验5、实验6的定性检验结果,我们有理由相信灰白色沉淀的成分为碱式氯化镁。
有文献[5]介绍,碱式氯化镁存在多种组成结构,化学通式可表示为Mgx(OH)yClz·mH2O(其中2x-y-z=0,0≤m≤6),最早是在研究MgO和MgCl2水溶液之间的化学反应时发现的,主要存在Mg2(OH)3Cl·4H2O、Mg3(OH)5Cl·4H2O和Mg10(OH)18Cl2·5H2O等3种相。现代科学仪器分析表明,一定pH环境下得到的白色沉淀均为多种碱式氯化镁固体的混合物,不同pH下得到的碱式氯化镁固体产物测得的化学组成也并不相同(可参见表3)[6]。
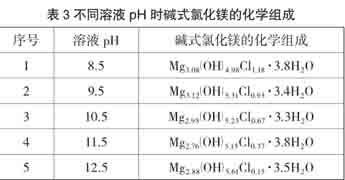
综上所述,由于足量镁与稀盐酸反应过程中,溶液会经历从酸性到碱性并碱性逐步增强的过程,从而能促进灰白色沉淀的生成。由于不同pH下生成的碱式氯化镁的化学组成也会随之改变,因此我们认为实验中得到的浑浊应为不同化学组成的碱式氯化镁的混合物。
3.1 关于教材实验的认识
用稀盐酸代替稀硫酸演示镁与酸的反应,由于Cl-对金属表面的氯离子效应[7],会使镁与酸(或水)反应速率大大加快。一旦镁的用量偏多,在课堂教学时间段内即会出现大量的灰白色沉淀。基于上述理论和实验等方面的探究,我们认为异常现象出现的深层次原因是在不同pH下生成了不同化学组成的碱式氯化镁的混合物。建议进行该实验教学时,教材选用稀硫酸是合理的,不宜随意更换;即使要选用稀盐酸,也要注意镁带的用量宜少不宜多。
3.2 关于异常现象的处理
以实验为基础是化学学科的重要特征之一。化学实验是为学生提供感性知识的手段,是培养学生科学态度和探究精神的有效途径。教学改革背景下的实验教学是一种平等、开放、动态的对话和交流。由于影响化学实验的因素是多元的,因此在具体操作过程中经常会出现一些意料之外、不能理解的异常现象,教学过程也将意味着有更多的不确定性[8]。在众多的异常现象中,有些可以运用学生已经掌握的知识给予合理解释,有些则在学生当前的知识背景下尚无法说明。但不管暂时能不能解释,都不妨碍这些异常现象成为我们的教学资源。教师要敢于打破预设的框架,调整教学策略,循着学生思维发展的脚步,积极进行课堂创新,及时开展实验探究活动,引导学生的思维向更深层次发展。
参考文献:
[1]王祖浩主编.普通高中课程标准实验教科书·化学1(必修)[M].南京:江苏教育出版社,2007:56.
[2]周公度.化学辞典(第二版)[M].北京:化学工业出版社,2011:438.
[3]范艳花,陈利娟.铝箔与不同浓度盐酸反应的“异常现象”探究[J].化学教学,2011,(3):42~43.
[4][7]向太平.对铝与盐酸反应中灰色物质的探究[J].化学教学,2004,(3):11~12.
[5]陈雪刚,吕双双,夏枚生等.碱式氯化镁晶须的制备与应用进展[J].材料導报(综述篇),2009,(4):52~55.
[6]李春忠,古庆山,程起林等.针状碱式氯化镁的合成及形态分析[J].华东理工大学学报(自然科学版),2005,(6):314~318.
[8]任雪明,吴文中.高中化学教学疑难问题研析[M].杭州:浙江教育出版社,2015:133.
