对水葫芦有杀草活性的菌株S63的分离筛选
2016-02-13陈宏贾纬聂毅磊罗立津陈星伟
陈宏,贾纬,聂毅磊,罗立津,陈星伟
(福建省微生物研究所福建省新药(微生物)筛选重点实验室,福建福州350007)
对水葫芦有杀草活性的菌株S63的分离筛选
陈宏,贾纬,聂毅磊,罗立津,陈星伟
(福建省微生物研究所福建省新药(微生物)筛选重点实验室,福建福州350007)
采用水葫芦琼脂平板和氨氮平板初筛及点种于水葫芦茎处的方法,得到使水葫芦茎部病变黑斑的菌株,考察其对光照培养箱中培养水葫芦的生长抑制效果,获得对水葫芦生长有强抑制作用的菌株S63,鉴定为假单胞菌属。露天培养的试验结果表明,加入该菌液0.5%~2%(体积分数)的试验组发病率为41.2%~100%,高于对照组19.4%~33.3%的发病率;试验组叶片的丙二醛(MDA)含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的酶活均显著高于对照组。表明该菌对水葫芦有一定的除草活性。
水葫芦;生长抑制;假单胞菌属;生物防治
泛滥的水葫芦(Eichhornia crassipes)往往引起河道堵塞,对水产养殖、航道运输、水利发电以及农林灌溉等造成严重影响,破坏生态环境。水葫芦的防治方法主要有物理防除、化学除草剂及生物防治等。目前我国消除水葫芦最有效的办法还是靠机械或人工打捞,但需要花费大量人力物力,每年人工打捞费用可高达1亿元[1],且打捞速度远远跟不上水葫芦爆发繁殖的速度。尽管化学控制效果明显,但水葫芦种群往往恢复迅速,且除掉水葫芦后常滋生大量浮游生物,起不到持效作用[2],同时化学杀草剂往往专一性较弱,还可能对水生环境造成生态危害。生物防治一般具有环境友好、效果持久和成本低等优点,其中利用微生物及其代谢产物是生物防治研究中一个较活跃的领域[3-5]。水葫芦爆发的真正原因在于水体的富营养化,许多研究表明水中的营养物质,尤其氮、磷等元素对水葫芦的生长有相关关系[6-10],减少环境污染是抑制水葫芦生长较为有效的措施。本研究采用氨氮平板和水葫芦琼脂平板,从水葫芦病株及其生长环境中分离到既可降解氨氮又能抑制水葫芦生长的菌株,经过进一步的复筛,获得目的菌株S63,并进行了菌株鉴定和杀草活性初步研究。
1 材料与方法
1.1 材料
1.1.1 菌种来源从水葫芦病株及其水体中分离和纯化获得的菌株。
1.1.2 培养基水葫芦琼脂:水葫芦茎40 g,加少许水磨碎取汁,琼脂20 g,用自来水定容到1 000 mL;PDA培养基:马铃薯100 g,葡萄糖10 g,琼脂2 g,蒸馏水1 000 mL;氨氮平板培养基[11]:柠檬酸三钠3 g,NH4H2PO40.4 g,KH2PO41 g,NaCl 3 g,琼脂20 g,蒸馏水1 000 mL,pH 7.2~7.4;发酵培养基:蛋白胨0.5 g,酵母膏1.5 g,葡萄糖5 g,K2HPO40.1 g,NaCl 1.5 g自来水1 000 mL,pH 7.2;水葫芦培养液:采用Hoagland溶液配方[12];以上培养基均在121℃灭菌30 min,含有葡萄糖的培养基,应将葡萄糖单独在115℃灭菌15 min后再加入培养基中。
1.2 方法
1.2.1 菌株分离取水葫芦病株的叶片,用次氯酸溶液擦洗,无菌水冲洗3遍,研磨,取汁,涂布于水葫芦琼脂平板培养基上。从水葫芦病株所处的水体中,取1 mL水样涂布在水葫芦琼脂平板培养基上,28℃培养箱培养2~4 d。挑取单菌落,并进行菌株纯化,将纯化后的菌株,保存在PDA斜面。将纯化菌株接种于氨氮平板上,28℃培养2~4 d,挑取保存产生透明圈的菌株。取正常生长的水葫芦植株,用70%酒精反复擦洗其茎部表面,无菌水冲洗数次,剪取约5 cm长的小段,置于垫有无菌滤纸的培养皿中,加入少许无菌水,以保持一定的湿度,将初筛获得的纯化菌株接种于水葫芦茎处,置室温培养,选取能致水葫芦茎部出现黑斑的菌株。将上述筛选获得的菌株接入发酵培养基中,28℃培养2~4 d,吸取菌液按0.5%、1%、2%(体积分数)比例加入到水葫芦生长液中,取正常生长的水葫芦植株移栽于上述培养液中,以不添加菌液为对照,每组作3个重复。于25℃光照培养箱中培养15 d,选取可抑制水葫芦生长的菌株为复筛菌株。
1.2.2 菌株鉴定将培养3 d的菌株接种于40 mL LB培养液的三角瓶(100 mL),于35℃、160 r/min恒温振荡培养48 h后制成菌悬液,离心收集菌体,采用CTAB/NaCl法提取菌株基因组DNA。通过利用细菌测序的通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对前期提取的DNA进行PCR扩增。扩增后的DNA产物送上海生工生物有限公司进行纯化测序,测序结果与GenBank中的序列进行blast比对。
1.2.3 水葫芦自然生态培养模拟实验将生长正常的水葫芦植株10株移栽于8 L添加2%(体积分数)菌液的生长培养液中,同时以不添加菌液作为空白对照,均设3组重复,露天培养,观察和记录水葫芦生长情况。以叶片染病情况计算发病率。水葫芦病情分级标准[12]:0级,叶片上无任何病斑;1级,叶片上少数病斑,总面积小于三分之一;2级,叶片上病斑总面积大于三分之一,小于三分之二;3级,叶片上病斑面积大于三分之二;4级,叶片全部枯萎。水葫芦叶片的发病率和病情指数分别按以下公式计算:发病率(100%) =染病叶片数/总叶片数×100;叶片病情指数=(Σ(发病级别×该级的叶片数)/(总叶片数×4))×100%。
1.2.4 酶的分析丙二醛(MDA)含量、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性测定方法,参见邹奇编写的方法[13]。过氧化物酶(POD)活性测定:采用李合生的愈创木酚比色法[14]。
1.2.5 菌株对富营养化水体的净化试验取富营养化水样1 000 mL,按110 000的体积比例接入S63的菌液,以不添加菌液为空白对照组,均设立3个平行组,室温间歇曝气(即曝气12 h,静止不曝气12 h),不同时间段取样测定水体中氨氮和化学需氧量(COD)的浓度。
2 结果与分析
2.1 菌株的分离筛选
从水葫芦病株和其生长水体中分离到139株可以在水葫芦琼脂平板上生长的菌株,将这些菌株分别在氨氮平板上点种,于28℃培养,挑取平板上呈现透明圈的菌株作为初筛菌株。再将这些菌株在水葫芦茎上点种,室温培养3~4 d后,在水葫芦茎上出现黑斑的菌株有36株。
将上述获得的36株菌接入发酵培养基中,28℃培养2~4 d,取培养液分别按0.5%、1%、2% (体积分数)比例加入到水葫芦生长液中,将水葫芦植株置于光照培养箱中25℃光照培养15 d,观察水葫芦生长状况,其中有6株菌(S29、S39、S44、S57、S60、S63)的菌液在加入后第5天使水葫芦的生长受到抑制,至第15天植株均枯黄衰萎。选取较早出现抑制现象、抑制效果比较稳定的S63菌株作为后续扩大培养的实验菌株。
2.2 菌株鉴定
将菌株S63进行菌种鉴定,先提取菌株总DNA,再进行16S rRNA序列扩增和序列测定,通过BLAST软件与NCBI网站中的GenBank数据库的16S rRNA进行比对,结果表明,其大小为1 393 bp,与Pseudomonas protegens strain Azi15的同源性最高,相似性达99%,S63属于假单胞菌属。该菌株能利用葡萄糖、果糖、甘露醇、甘油、柠檬酸钠、乙酸钠、琥珀酸钠、肌醇,不利用蔗糖、麦芽糖、半乳糖、乳糖、鼠李糖、棉籽糖、木糖、阿拉伯糖、酒石酸甲钠、草酸钠,不水解纤维素,能液化明胶,胨化牛奶,石蕊牛奶还原褪色,不产硫化氢。
2.3 菌株S63在水葫芦露天培养中的抑制作用
在水葫芦培养液中按2%(体积分数)的比例加入菌液,经过11批次15 d的露天培养实验,试验组的发病率为41.2%~100%,病情指数为30.9%~96.4%,对照组发病率19.4%~33.3%,病情指数为7.4%~20.2%,见表1、图1所示。
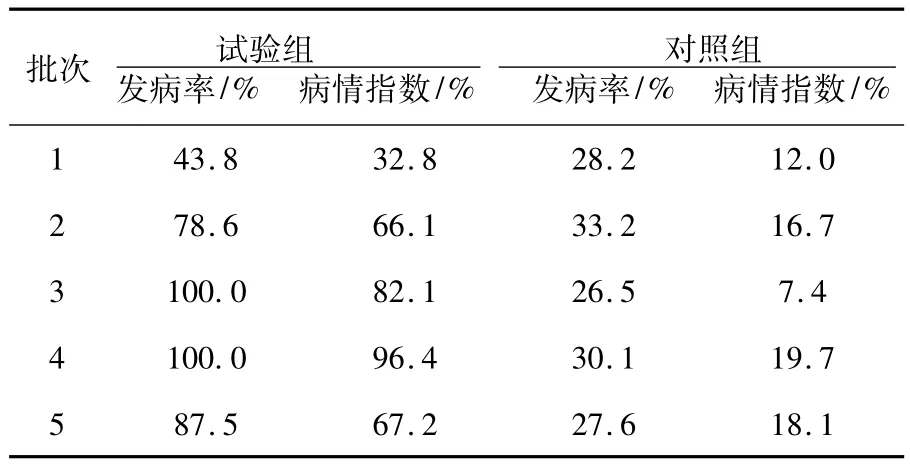
表1 水葫芦加菌液试验组和对照组在露天培养的发病状况比较Table 1Comparision of the disease condition between the test group and control group during the outdoor cultivation
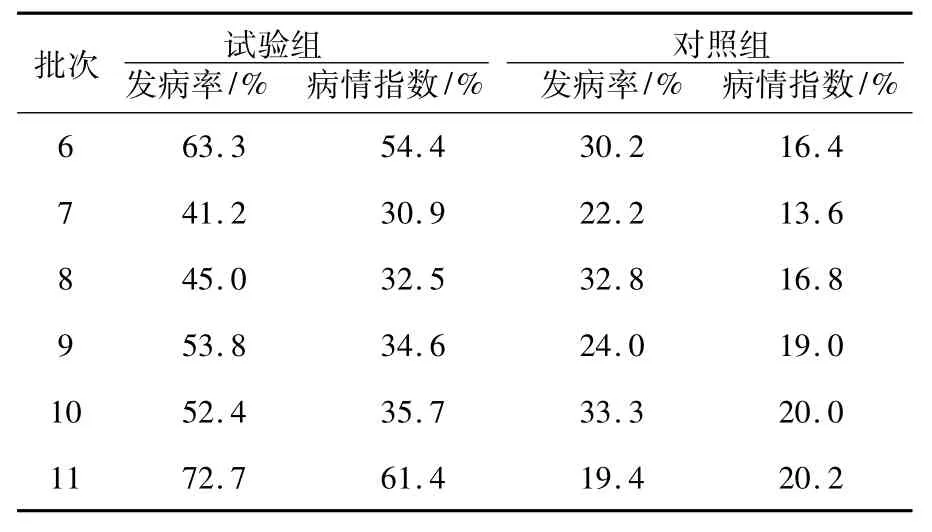
续表1

图1 露天培养水葫芦Fig.1Outdoor cultivation of water hyacinth
2.4 酶活性的测定
植物在逆境条件下会发生应激反应,从而引起一系列生理生化变化。病原菌或植物毒素入侵后,植物体内有大量活性氧迅速产生,高浓度的活性氧将危害植物自身细胞,因此植物体内存在清除活性氧的防御酶系,例如SOD、CAT和POD等。
MDA[15]是膜脂过氧化最重要的产物之一,毒性很强,对生物膜的结构与功能具有严重损伤作用,其含量高低体现了氧自由基的毒害作用的大小,成为反映膜脂过氧化强弱的重要指标,因此植物在逆境中遭到伤害的程度可以通过MDA的含量来反馈。加入菌液后水葫芦叶片中的MDA含量显著高于对照,说明菌液对叶片的细胞膜有较强的毒害作用,从而抑制了水葫芦植株的生长。SOD能将歧化为H2O2,是清除超氧阴离子自由基的关键酶之一,酶活性常与植物的抗氧化胁迫能力正相关。POD具有将H2O2转化为H2O的作用,是植物体内担负清除H2O2的主要酶类。CAT是植物中极为重要的逆境生理酶,能够清除植物体内过多的过氧化氢,减少其对细胞的过氧化伤害,图2的结果表明加入菌液后水葫芦叶片的SOD、CAT、POD酶的活性显著提高。

图2 试验组叶片与对照组叶片酶活的检测结果Fig.2Results of enzyme activity on test group and control group
2.5 菌株S63对富营养化水质的净化试验
取富营养化水样置室温间歇曝气,不同时间段取样测定对照组与试验组的氨氮和COD,结果表明加入S63菌液对氨氮和COD降解效果显著高于对照(图3)。加菌曝气3 d的水样明显较对照清澈。
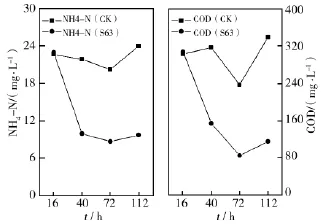
图3 菌株S63对富营养化水样的净化试验Fig.3The test of purification about eutrophic water with S63
3 讨论
本研究筛选得到的菌株S63对水葫芦的生长有抑制作用,加入菌液后水葫芦叶片中的MDA含量及SOD、POD和CAT酶活均显著高于对照,说明对叶片的细胞膜产生了较强的毒害作用,能引起植株的膜脂过氧化,造成植株过氧化损伤,致病率可达41.2%~100%,病情指数为30.9%~96.4%,明显高于对照组。表明该菌有一定的杀草活性,但关于其损伤的机理和使用的安全性还需要进一步的研究。
人工、机械防除或化学除草剂难以根治水葫芦的泛滥,生物防治方法是国际上认同的控制入侵生物的发展方向,采用对环境友好、成本低廉、选择性强的微生物及其代谢产物作为杀草剂成为研究热点[17-20]。水葫芦病原菌的研究始于20世纪60年代,但目前具有商业化应用价值的微生物除草剂还很少见,且大部分都为致病真菌[3-5,16-17],很少有关于水葫芦致病细菌的研究报道。菌株S63是假单胞菌属,扩大了水葫芦生防菌的种类来源。该菌株还具有降解水体中氨氮的特性,对遏制水体富营养化有一定作用,而水葫芦的爆发与水环境富营养化的关系密切,因此该菌株及其代谢物对水葫芦泛滥具有标本兼治的防治作用,提供了一个水葫芦生物防除的新思路,本研究的结果对这一领域的产品研发具有一定的参考价值,值得进一步深入的研究。
[1]梁宝忠.我国每年人工打捞水葫芦费用高达1亿元[EB/ OL].[2014-07-25 23:35J].http://www.agri.cn/V20/ZX/ nyyw/201407/t20140725_3980876.htm
[2]高雷,李博.入侵植物凤眼莲研究现状及存在的问题[J].植物生态学报,2004,28(6):735-752.
[3]Shabana Y M,Elwakil M A,Charudattan R.Effect of media,light and pH on growth and spore production by Alternaria eichhorniae,a mycoherbicide agent for waterhyacinth/Wirkung von Medium,Licht und pH auf das Wachstum und die Sporenproduktion von Alternaria eichhorniae,einem Mykoherbizid gegen die Wasserhyazinthe[J].Zeitschrift für Pflanzenkrankheiten und Pflanzenschutz/Journal of Plant Diseases and Protection,2000:617-626.
[4]Dagno K,Lahlali R,Jijakli M H,et al.Present status of the development of mycoherbicides against water hyacinth:successes and challenges.A review[J].Biotechnologie,Agronomie,Société et Environnement,2012,16(3):360-368.
[5]Ray P,Hill M P.Microbial agents for control of aquatic weeds and their role in integrated management[J].CAB Reviews Perspectives in Agriculture Veterinary Science Nutrition and Natural Resources,2013,(8):1-9.
[6]杨红玉.水葫芦生长的环境影响因素,机理及规律研究[D].福州:福建师范大学,2006.
[7]Yi Q,Kim Y,Tateda M.Evaluation of nitrogen reduction in water hyacinth ponds integrated with waste stabilization ponds[J].Desalination,2009,249(2):528-534.
[8]周喆,李文文,尤民生.水体中氮素对水葫芦生长发育的影响[J].华东昆虫学报,2011,18(1):55-60.
[9]陈雄伟,郑春梅,李晓丹,等.不同氮营养水平对水葫芦根系活力的影响[J].安徽农业科学,2012,40(3):1657-1659.
[10]傅明辉,陈肖丽,严国花.光照和不同氮素对水葫芦谷氨酰胺合成酶活性的影响[J].基因组学与应用生物学,2015,(3):635-639.
[11]彭云华.利用氨氮平板测定法初筛优势微生物菌株[J].城市公用事业,2005,19(4):16-18.
[12]丁义.水葫芦病原菌的分离与鉴定及炭疽菌(Colletotrichum spp.)YBH菌株的生物学特性研究[D].上海:上海交通大学,2006.
[13]邹奇.植物生理学实验指导[M].北京:中国农业出版社,2000.
[14]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,1999:118-119.
[15]张秋芳,刘波,官雪芳,等.水葫芦防除剂“杀草克乐”对水葫芦若干生理特性的影响[J].农业环境科学学报,2007,26(5):1812-1815.
[16]王小欣,卢柳吉,李其利,等.水葫芦生防菌的分离筛选及初步鉴定[J].南方农业学报,2013,44(8):1291-1294.
[17]Okunowo W O,Osuntoki A A,Adekunle A A,et al.Occurrence and effectiveness of an indigenous strain of Myrotheciumroridum Tode:Fries as a bioherbicide for water hyacinth(Eichhornia crassipes)in Nigeria[J].Biocontrol Science&Technology,2013,23(12):1387-1401.
[18]徐文平,陶黎明.以微生物代谢物进行除草剂开发的研究进展[J].现代农药,2011,10(4):1-8.
[19]强胜,陈世国.生物除草剂研发现状及其面临的机遇与挑战[J].杂草科学,2011,29(1):1-6.
[20]KarimDagno R L,Diourté M,Jijakli M H.Present status of the development of mycoherbicides against water hyacinth:successes and challenges.A review[J].Biotechnologie,Agronomie,Sociétéet Environnement,2012,16(3):360-368.
Isolation and Screening of Herbicidal Active Strain S63 against Water Hyacinth(Eichhornia crassipes)
CHEN Hong,JIA Wei,NIE Yi-lei,LUO Li-jin,CHEN Xing-wei
(Fujian Inst.of Microbiol.,Fujian Prov.Key Lab.of Screening for Novel Med.(Microb.)Products,Fuzhou 350007)
Water hyacinth(Eichhornia crassipes)(WH)agar plate and ammonia-nitrogen plate and dibbling on WH’s stem method were adopted to screen initially herbicidal active strains which could make WH infected with pathological change by black spot.The growth inhibition effects of WH was observed in illumination incubator,and obtained strain S63 that strongly inhibited the growth of WH,and identified as a species of the genus of Pseudomonas.The results of outdoors’cultivation experiments showed that the occurrence of WH tested groups with 0.5%~2%of the strain’s fermentation broth was at 41.2%~100%,higher than the occurrence of control groups at 19.4%~33.3%;and enzyme activities of malondialdehyde(MDA)and superoxide dismutase(SOD),peroxidase(POD) and catalase(CAT)in tested WH’s leaves were significantly higher than the control groups,suggested that the strain had a certain herbicidal activity against WH.
water hyacinth(Eichhornia crassipes);growth inhibition;Pseudomonas;bio-control
Q93-3
A
1005-7021(2016)04-0022-05
10.3969/j.issn.1005-7021.2016.04.004
福建省科技重点项目(2013Y0013)
陈宏女,硕士,高级工程师。研究方向为环境微生物。E-mail:peaceful88@163.com
2015-11-02;
2016-01-12
