基于16S rRNA和rpoB基因的分子系统发育分析在铜绿假单胞菌鉴定中的应用
2016-02-13何艳霞向诗非李浇何金蕾张俊荣袁冬梅秦翰霄陈达丽陈建平
何艳霞,向诗非,李浇,何金蕾,张俊荣,袁冬梅,秦翰霄,陈达丽*,陈建平*
(1.四川大学华西基础医学与法医学院寄生虫学教研室,四川成都610041; 2.湖北民族学院医学院寄生虫学教研室,湖北恩施445000; 3.湖北民族学院附属民大医院风湿免疫科,湖北恩施445000)
基于16S rRNA和rpoB基因的分子系统发育分析在铜绿假单胞菌鉴定中的应用
何艳霞1,2,向诗非3,李浇1,何金蕾1,张俊荣1,袁冬梅1,秦翰霄1,陈达丽1*,陈建平1*
(1.四川大学华西基础医学与法医学院寄生虫学教研室,四川成都610041; 2.湖北民族学院医学院寄生虫学教研室,湖北恩施445000; 3.湖北民族学院附属民大医院风湿免疫科,湖北恩施445000)
为对比16S rRNA和rpoB基因分子系统发育分析与传统表型分类法对铜绿假单胞菌的鉴定,评估16S rRNA和rpoB基因序列分析在铜绿假单胞菌鉴定中的应用,用表型分类方法对临床自动微生物鉴定系统鉴定为铜绿假单胞菌的23株分离株进行再鉴定,PCR扩增23株分离株16S rRNA和rpoB基因片段,并测序进行系统发育分析。结果表明,表型再鉴定结果与自动微生物鉴定系统鉴定结果一致。基于两个基因的系统发育分析均显示分离株p22与不动杆菌属序列聚为一枝,其余22株分离株与铜绿假单胞菌序列聚为一枝。因此p22应鉴定为不动杆菌,16S rRNA和rpoB基因序列分析均能准确鉴定铜绿假单胞菌并能较好建立假单胞菌属内种间关系。
铜绿假单胞菌;16S rRNA;rpoB
铜绿假单胞菌(Pseudomonas aeruginosa)广泛分布于自然界,是一种条件致病菌,可感染人体的任何部位和组织,出现局部化脓性炎症。铜绿假单胞菌也广泛分布于医院环境,在医院感染病例中,由铜绿假单胞菌引起的医院感染占据首位[1]。铜绿假单胞菌耐药性强,耐药谱广,随着多药耐药菌株的出现,尤其是对7种以上或所有抗生素全部耐药的泛耐药株的出现,铜绿假单胞菌常使临床医生陷入无药可用的境地。假单胞菌属自1894年建立以来,其菌种数目在不断增加,并且随分类方法的改善,其分类体系不断被修正,目前,假单胞菌属已成为革兰阴性菌中菌种数量最多的属。不同的菌种作用于不同种类的生物,具有不同的致病特性,准确而快速地鉴定出对人类有严重危害的铜绿假单胞菌,对尽早控制铜绿假单胞菌感染及预防铜绿假单胞菌耐药株的扩散具有非常重要的意义。医院常采用琼脂平板培养法对细菌进行分离培养,用全自动微生物鉴定系统进行菌种鉴定和药物敏感性试验,其鉴定系统是基于生化试验做出的鉴定,结果并不十分可靠[2-3]。近30年来,分子生物学技术被越来越多地应用于重要病原菌的鉴定。16S rDNA是细菌染色体上编码16S rRNA的基因序列,存在于所有细菌染色体基因组中,由于其在进化过程中高度保守,又具有相对的独特性,已被广泛应用于细菌的鉴定[4-5]。rpoB基因编码DNA依赖的RNA聚合酶β亚单位,是一个高度保守的管家基因,也常被用作细菌鉴定的标示基因和系统发育分析的位点,在假单胞菌的鉴定中经常被用到[6-8]。本研究对23株铜绿假单胞菌临床分离株进行16S rRNA及rpoB基因序列系统发育分析,对比临床常用的基于生化试验的分类方法,评估这两个基因对鉴定铜绿假单胞菌的意义,并为临床鉴定提供指导意见。
1 材料与方法
1.1 材料
23株铜绿假单胞菌分离自2014年3月至6月间湖北省恩施土家族苗族自治州中心医院和湖北民族学院附属民大医院病人痰液、脓液、支气管肺泡灌洗液等标本。菌株在医院检验科经分离培养,并经全自动微生物鉴定系统VITEK 32(BioMerieus,Inc.,MarayI’Etoil,France)鉴定为铜绿假单胞菌(可能概率>99.0%),所有菌株均具有必需的生化试验特征(结果见表1)。绿脓杆菌生化鉴定盒购自广东环凯公司,细菌基因组提取试剂盒和胶回收试剂盒购自北京天根公司,2×Taq Master Mix购自上海欣百诺公司。PCR引物合成和测序均由成都擎科公司完成。
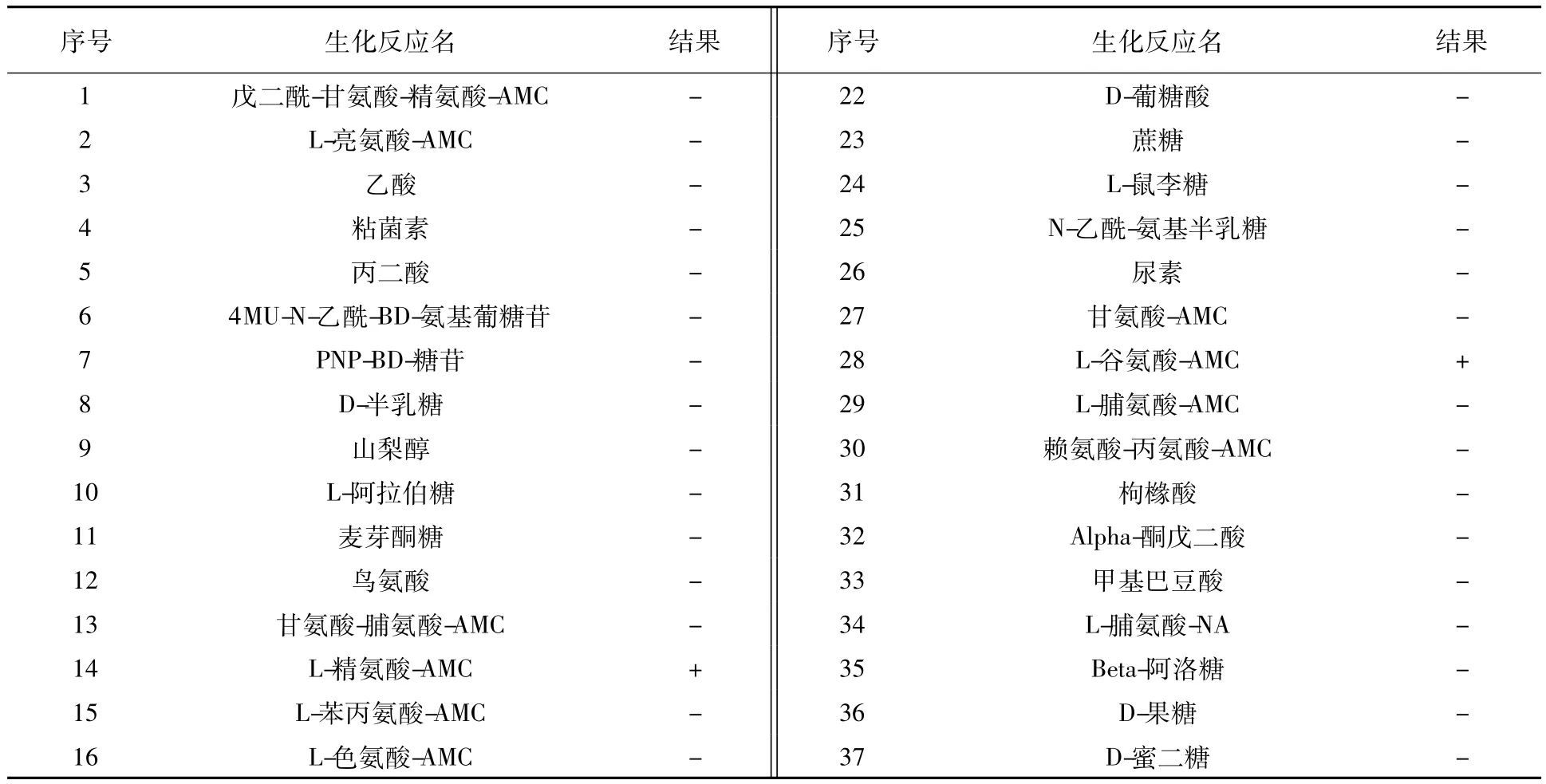
表1 所有临床分离株生化反应结果列表Table 1The list of biochemical characteristics for all clinical isolates

续表1
1.2 方法
1.2.1 细菌培养、再鉴定及DNA提取23个临床分离株均分别接种于LB平板、麦康凯平板、血平板,37℃培养18~24 h,观察并记录在不同培养基上的生长特征。挑取单个菌落进行革兰染色,并用绿脓杆菌生化鉴定盒进行补充生化鉴定。DNA提取按照试剂盒操作流程进行。
1.2.2 PCR扩增对23个分离株进行16S rRNA基因和rpoB基因PCR扩增。16S rRNA基因扩增选用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTTACGACTT-3')[9]。PCR反应体系为50 μL,包括上、下游引物各0.4 μmol/L,模板2 μL,2×Taq Master Mix 25 μL。反应条件为94℃预变性5 min;94℃变性30 s,58℃退火40 s,72℃延长2 min,共30个循环;72℃终末延长5 min。rpoB基因扩增选用上游引物5'-GGCGAAATGGCWGAGAACCA-3',下游引物5'-GAGTCTTCGAAGTTGTAACC-3'[10]。PCR反应体系同前,反应条件为94℃预变性5 min;94℃变性45 s,50℃退火30 s,72℃延长1 min,共30个循环;72℃终末延长5 min。所有PCR产物均通过1.5%琼脂糖凝胶电泳鉴定。
1.2.3 基因测序及分子系统发育分析按照产品说明书推荐操作,对23株临床分离株的16S rRNA基因和rpoB基因PCR产物进行凝胶回收,送成都擎科公司测序,测序结果经校正后上传GenBank。将新获得序列在GenBank中进行Blast比对,了解在GenBank中与其同源性较高的序列情况。从GenBank下载假单胞菌属及其他相关属16S rRNA基因和rpoB基因参考序列各43条,在表3中列出,Pragiafontium为外类群,与新获序列进行比对研究。采用软件CLUSTAL X分别对16S rRNA基因和rpoB基因序列进行多序列匹配排列,采用软件MEGA 4.0对排列矩阵进行微调,用MrBayes v3.2进行贝叶斯分析,矩阵最优数据模型通过Modeltest 3.7选择获得,贝叶斯分析结果使用软件FigTree v1.4.2查看。
2 结果与分析
2.1 细菌再鉴定
2.1.1 培养特征该23株分离株在LB培养基上均生长良好,菌落扁平、湿润,培养基呈亮绿色。在麦康凯平板上的表现有4种:形成典型的灰绿色具金属光泽的菌落;圆形凸起的灰白色半透明似大肠埃希菌菌落;光滑凸起成粘液状的粘液性菌落;中央凸起、边缘扁平、表面粗糙的粗糙性菌落。在血平板上可见透明溶血环。
2.1.2 革兰染色及形态特征经革兰染色,在光学显微镜下观察,23株铜绿假单胞菌均为革兰染色阴性,杆菌,长短不一,单独、成双或短链状排列,无芽胞,有荚膜。
2.1.3 生化反应在本实验室再鉴定中,23株临床分离株具有相同生化反应结果,见表2。该结果支持医院做出的铜绿假单胞菌的鉴定。

表2 所有临床分离株补充生化反应结果列表Table 2The list of supplementarybiochemical characteristics for all clinical isolates
2.2 分子系统发育分析
2.2.1 基于16S rRNA基因的分子系统发育分析23株分离株均扩增出约1 500 bp大小的16SrRNA基因片段,测序获得的序列存储于Gen-Bank,其编号为KU372980~KU373002(见表3)。p22的16S rRNA序列比对与不动杆菌未定种(Acinetobacter sp.)ADP1基因组序列同源性最高(99%),其次是鲍曼不动杆菌(Acinetobacter baumannii)AC29(98%),其余22株序列(p1、p2、p3、p4、p5、p6、p7、p8、p9、p10、p11、p12、p13、p15、p16、p18、p20、p23、p24、p25、p26、p27,以下简称22株)与铜绿假单胞菌(Pseudomonas aeruginosa) F22031基因组序列同源性最高(99%或100%)。Modeltest获得的最优数据模型为GTR+I+G。对16S rRNA数据矩阵进行贝叶斯分析,构建的进化树中(图1)可见所有假单胞菌属序列以及2个固氮菌属序列聚成一枝Clade I,其后验概率(posterior probability)为1.0。22株临床分离株与铜绿假单胞菌聚成Clade I中的一个亚枝A,其后验概率为0.95。另一个分离株p22则与不动杆菌属序列聚成一枝Clade II,后验概率为1.0。
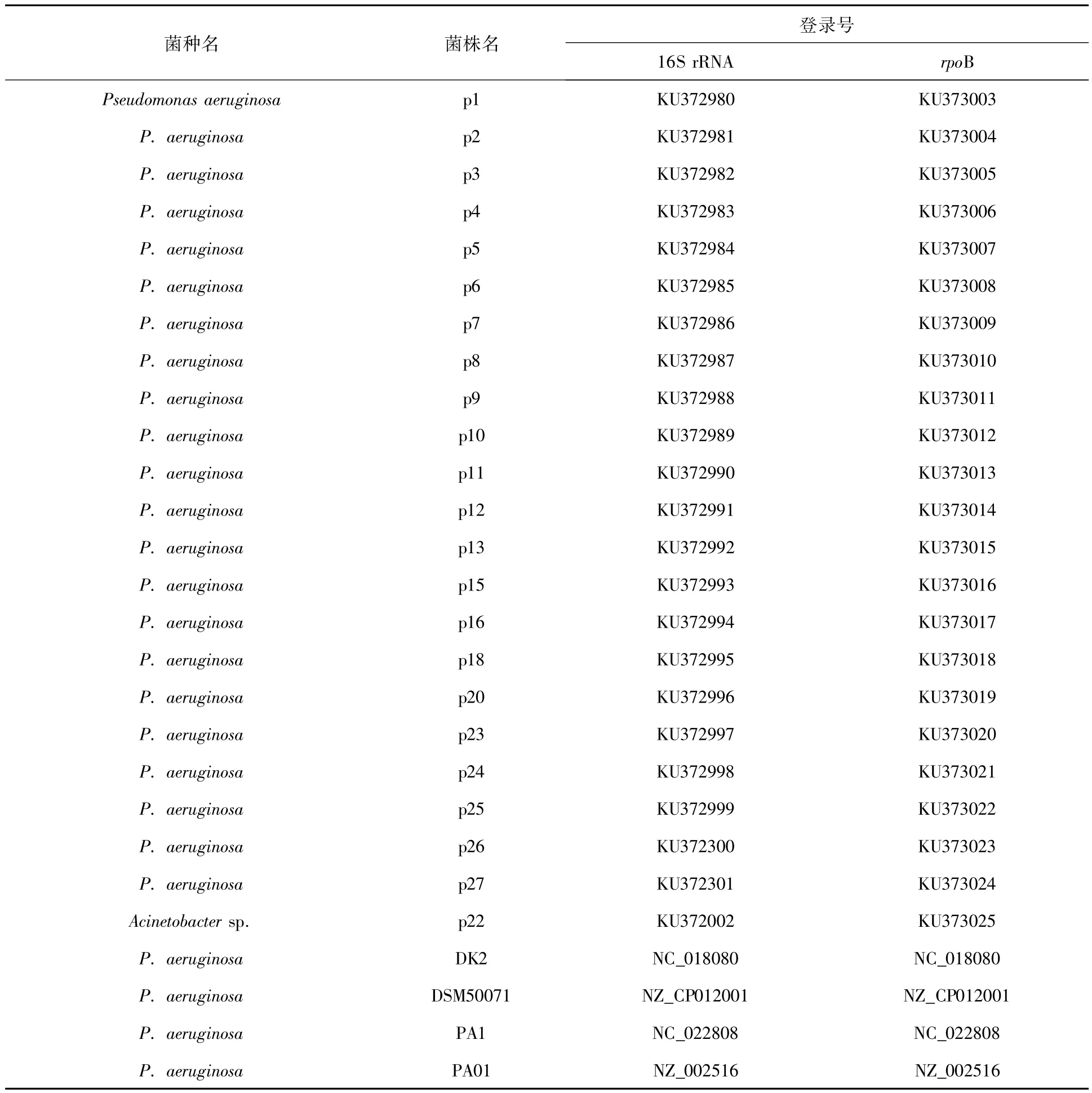
表3 用于16S rRNA和rpoB分析的种、株及GenBank登录号Table 3List of analyzed species,strains and the GenBank accession number for 16S rRNA and rpoB

续表3
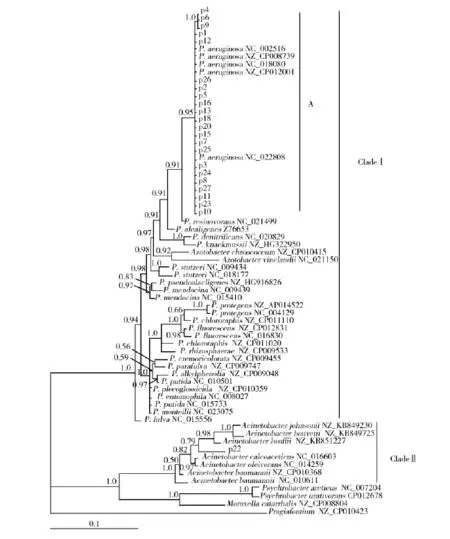
图1 分离菌株与GenBank中相关菌株的16S rRNA系统发育树Fig.116S rRNA phylogenetic tree of Pseudomonas strains from this study and GenBank进化树采用MrBayes v3.2软件进行贝叶斯分析获得,cut-off值为50%,节点处为贝叶斯后验概率,下图同The 50%majority-rule consensus tree inferred from Baysain inference using MrBayes v3.2.Bayesian posterior probabilities were show at nodes,same the follow
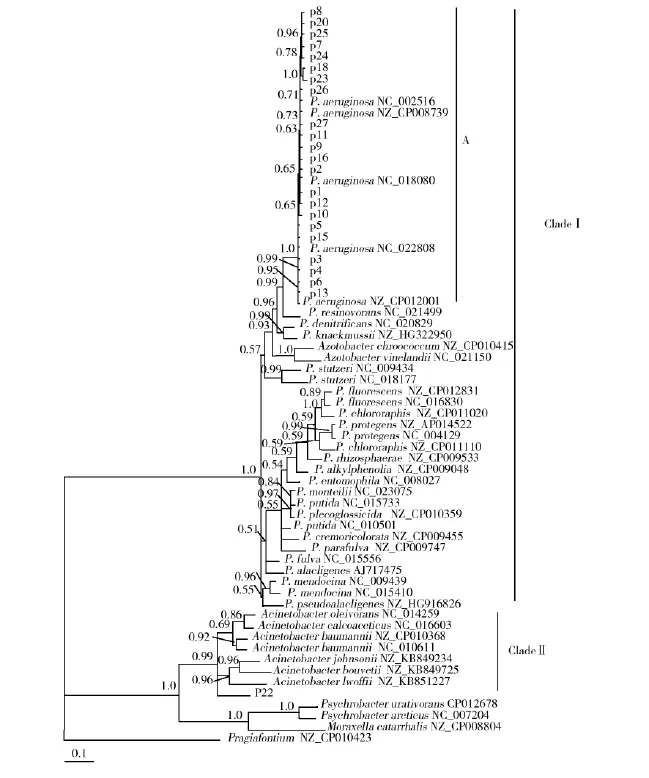
图2 分离菌株与GenBank中相关菌株的rpoB系统发育树Fig.2rpoB phylogenetic tree of Pseudomonas strains from this study and GenBank
2.2.2 基于rpoB基因的分子系统发育分析23株分离株均扩增出约980 bp大小的rpoB基因片段,测序获得的序列存储于GenBank,其编号为KU373003~KU373025(见表3)。p22的rpoB序列比对与不动杆菌未定种(Acinetobacter sp.) ADP1基因组序列同源性最高(88%),其次是鲍曼不动杆菌(Acinetobacter baumannii)6411(同源性84%),其余22株序列与铜绿假单胞菌(Pseudomonas aeruginosa)213BR基因组序列同源性最高(99%或100%)。Modeltest获得的最优数据模型为TIM+I+G。在rpoB数据矩阵构建的贝叶斯树中(图2),所有假单胞菌属序列以及2个固氮菌属序列聚成一枝Clade I,其后验概率为1.0。22株分离株与铜绿假单胞菌聚成Clade I中的一个亚枝A,后验概率(posterior probability)为1.0。另一个分离株p22则与不动杆菌属序列聚成一枝Clade II,后验概率为0.99。
3 讨论
传统的细菌鉴定主要依靠对细菌表型特征的观察,如菌落形态、染色后镜下形态、生化特征等。自动微生物鉴定系统是将传统的生化鉴定试剂微型化,制成干燥的微型鉴定试剂板条,采用数理统计原理的编码鉴定方法,结合现代电子技术而形成的一种鉴定方法[11]。其应用简便、快速,但鉴定系统的准确性受到系统数据库覆盖范围的影响,由于微生物分类在不断变化,使得一些鉴定系统在使用一段时间后与新的分类系统逐渐发生偏差,准确率下降。相近属的细菌其生化特征亦较相似,这同样影响鉴定的准确率。来自接受抗生素治疗病人的分离株,其生化特性可能有所改变,鉴定结果也可能被影响[11]。
16S rRNA和rpoB基因已被广泛应用于细菌的分子分类及鉴定研究。基于16S rRNA的分析被普遍认为能鉴定细菌至属水平,而不能解决近缘种之间的分类问题[12-13]。rpoB基因表现出比16S rRNA更大的优越性。Marianelli等[14]通过对布鲁氏菌rpoB基因的研究,认为rpoB基因能用于鉴定所有的布鲁氏菌种及大部分的生物变种。Mollet等[15]通过对肠杆菌科14个种的细菌的16S rRNA和rpoB基因的研究,认为rpoB基因部分序列能准确鉴定肠道细菌。Adékambi等[16]认为,rpoB基因测序能准确反映细菌的G+C%含量,DNA-DNA杂交水平及平均核苷酸同源性(2个菌株共享的全基因组序列的比例),能在种和亚种水平解决细菌系统发育关系,可作为一个强有力的临床微生物鉴定工具。16S rRNA和rpoB基因分析的这种差异可能是因为16S rRNA基因分子结构高度保守且在许多细菌基因组中有多个拷贝[17],因而确定其序列的准确性降低,而管家基因rpoB则只具有单一拷贝[18],且不同菌株rpoB基因变异程度明显高于16S rRNA[15]。
本研究中,23株临床分离株被自动微生物鉴定系统鉴定为铜绿假单胞菌,在本实验室进行再鉴定时,该23株菌在培养特性、形态特征、生化特征等方面均符合铜绿假单胞菌的特点,与临床鉴定结果相一致。但经进一步的基因分析,分离株p22分析结果明显不同于临床鉴定结果,其与不动杆菌属更为接近。
p22的16S rRNA和rpoB基因序列在Gen-Bank中进行Blast比对时,其同源性最高的序列为不动杆菌,且在16S rRNA和rpoB数据矩阵构建的贝叶斯树中,p22均与不动杆菌属序列聚成一枝,而其余22株分离株则均与铜绿假单胞菌序列聚成一枝。在2棵贝叶斯树中,p22均未有高的后验概率支持与某种不动杆菌聚为一枝,且Clade II枝中各单倍型相距较远(分析结果未在资料中显示),无法构建有意义的单倍型网络图以确认p22与该枝中各种的亲缘远近关系。由此,p22鉴定为不动杆菌(种未定)更为准确。
在本研究中,基于16S rRNA和rpoB的贝叶斯树拓扑结构高度相似,22株分离株序列及下载的5个铜绿假单胞菌序列被高的后验概率支持聚为一枝,且假单胞菌属内种间关系清晰,表明16S rRNA和rpoB基因在假单胞菌属系统发育研究中均能较准确反映种间关系。在此,rpoB基因并未表现出对16S rRNA的明显优势,这可能是假单胞菌属内最近为种间关系,而rpoB基因在亲缘关系更近的菌株鉴定中优势更为突出有关[16]。
zen等[19]曾用基于基因组序列的3种方法研究棕色固氮菌(Azotobacter vinelandii)与假单胞菌属的关系,结果均显示棕色固氮菌与假单胞菌属高度相似,表明固氮菌实际应属于假单胞菌。本研究基于16S rRNA和rpoB的贝叶斯树中,2个固氮菌序列均与假单胞菌属序列聚为一枝,再一次肯定了zen等的研究。
本研究对临床分离的23个菌株用传统表型分类方法和DNA测序分析进行了再鉴定,传统表型分类方法鉴定23株均为铜绿假单胞菌,16S rRNA和rpoB基因序列分析鉴定22株分离株为铜绿假单胞菌,分离株p22应为不动杆菌。16S rRNA和rpoB基因能准确鉴定铜绿假单胞菌临床分离株,并能较准确建立假单胞菌属种间关系。
[1]金美娟,李秀红,邢旺兴.236株铜绿假单胞菌感染的临床分析[J].中华医院感染学杂志,2005,15(3):348-350.
[2]Farmer JJ,Davis BR,Hickman-Brenner FW,et al.Biochemical identification of new species and biogroups of Enterobacteriaceae isolated from clinical specimens[J].J ClinMicrobiol,1985,21(1):46-76.
[3]Capurro A,Artursson K,Waller KP,et al.Comparison of a commercialized phenotyping system,antimicrobial susceptibility testing,and tuf gene sequence-based genotyping for specieslevel identification of coagulase-negative staphylococci isolated from cases of bovine mastitis[J].Vet Microbiol,2009,134 (3-4):327-333.
[4]BaghalAsghari F,Nikaeen M,Mirhendi H.Rapid monitoring of Pseudomonas aeruginosa in hospital water systems:a key priority in prevention of nosocomial infection[J].FEMS Microbiol-Lett,2013,343(1):77-81.
[5]Harris KA,Hartley JC.Development of broad-range 16S rDNA PCR for use in the routine diagnostic clinical microbiology service[J].J Med Microbiol,2003,52(Pt 8):685-691.
[6]Ait Tayeb L,Ageron E,Grimont F,et al.Molecular phylogeny of the genus Pseudomonas based on rpoB sequences and application for the identification of isolates[J].Res Microbiol,2005,156(5-6):763-773.
[7]Mollet C,Drancourt M,Raoult D.rpoB sequence analysis as a novel basis for bacterial identification[J].MolMicrobiol,1997,26(5):1005-1011.
[8]Seok Y,Shin H,Lee Y,et al.First report of bloodstream infection caused by Pseudomonas fulva[J].J ClinMicrobiol,2010,48(7):2656-2657.
[9]Lane DJ.16S and 23S rRNA sequencing.In:Stackebrandt E,Goodfellow M(eds)Nucleic acids techniques in bacterial systematics[M].Chichester:John Wiley&Sons,1991:115-175.
[10]Diancourt L,Passet V,Verhoef J,et al.Multilocus sequence typing of Klebsiellapneumoniae nosocomial isolates[J].J Clin-Microbiol,2005,43(8):4178-4182.
[11]吴会桃,蔡芷荷,吴清平,等.细菌鉴定系统的应用研究进展[J].中国卫生检验杂志,2010,20(9):2381-2384.
[12]Harris KA,Hartley JC.Development of broad-range 16S rDNA PCR for use in the routine diagnostic clinical microbiology service[J].J Med Microbiol,2003,52(Pt 8):685-691.
[13]Stackebrandt E,Goebel BM.Taxonomic note:a place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J].Int J SystBacteriol,1994,44(4):846-849.
[14]Marianelli C,Ciuchini F,Tarantino M,et al.Molecular characterization of the rpoB gene in Brucella species:new potential molecular markers for genotyping[J].Microbes Infect,2006,8(3):860-865.
[15]Mollet C,Drancourt M,Raoult D.rpoB sequence analysis as a novel basis for bacterial identification[J].MolMicrobiol,1997,26(5):1005-1011.
[16]Adékambi T,Drancourt M,Raoult D.The rpoB gene as a tool for clinical microbiologists[J].Trends Microbiol,2009,17 (1):37-45.
[17]Pei AY,Oberdorf WE,Nossa CW,et al.Diversity of 16S rRNA genes within individual prokaryotic genomes[J].Appl Environ Microbiol,2010,76(12):3886-3897.
[18]Kim BJ,Kim CJ,Chun J,et al.Phylogenetic analysis of the genera Streptomyces and Kitasatospora based on partial RNA polymerase beta-subunit gene(rpoB)sequences[J].Int J SystEvolMicrobiol,2004,54(Pt 2):593-598.
[19]zen AI,Ussery DW.Defining the Pseudomonas genus:where do we draw the line with Azotobacter[J].MicrobEcol,2012,63(2):239-248.
Molecular Phylogeny Analysis Based on 16S rRNA and rpoB Sequences for Identification of Clinical Isolates of Pseudomonas aeruginosa
HE Yan-xia1,2,XIANG Shi-fei3,LI Jiao1,HE Jin-lei1,ZHANG Jun-rong1,YUAN Dong-mei1,QIN Han-xiao1,CHEN Da-li1,CHEN Jian-ping1
(1.Teach.&Res.Div..of Parasitol.,W.China Schl.of Basic&Forensic Med.,Sichuan Uni.,Chengdu 610041;2.Teach.&Res.Div.of Parasitol.,Coll.of Med.,Hubei coll.for Minority Nationalities,3.Affil.Minda Hosp.,Hubei Uni.for National's,Enshi 445000)
16S rRNA and rpoB gene sequence analysis to identify of Pseudomonas aeruginosa was compared with conventional phenotypic methods to evaluate the application of 16S rRNA and rpoB sequence analysis to identify P.aeruginosa;23 isolated strains that were re-characterized with phenotypic classification method that was identified as P.aeruginosa by clinical automatic microbial identification system.16S rRNA and rpoB gene fragments were amplified with PCR and sequenced for molecular phylogenic analysis.The results showed that the re-characterized results were consistent with those characterized with automatic microbial identification system.Using Bayesian phylogenetic analyses based on 16S rRNA and rpoB genes,22 isolates are characterized as P.aeruginosa,whereas one isolate,p22,was classified as Acinetobacter sp.p22 should be identified as Acinetobacter sp.16S rRNA and rpoB genes can accurate identify P.aeruginosa and could fairly establish the interspecific relation within the genus of Pseudomonas.
Pseudomonas aeruginosa;16S rRNA;rpoB
Q939.11+2
A
1005-7021(2016)04-0027-09
10.3969/j.issn.1005-7021.2016.04.005
国家自然科学基金项目(31572240,81171607,J1103604);四川大学与泸州市合作项目(2013CDLZ-S16)
何艳霞女,讲师,博士研究生。研究方向为分子病原生物学。E-mail:49300492@qq.com
*通讯作者。陈达丽女,副教授,博士。研究方向为病原鉴定及分子系统发育。E-mail:cdl1978119@sina.com陈建平男,教授,博士,博士生导师。研究方向为分子病原生物学。E-mail:jpchen007@163.com
2016-01-07;
2016-06-19