苹果树内生菌筛选及其对苹果腐烂病防治效果
2016-02-13邓振山马亚茹何园李超汪飞贺晓龙赵瑞华
邓振山,马亚茹,何园,李超,汪飞,贺晓龙,赵瑞华
(1.延安大学生命科学学院,陕西延安716000;2.石河子大学生命科学学院,新疆石河子832003; 3.延安市微生物研究所,陕西延安716000)
苹果树内生菌筛选及其对苹果腐烂病防治效果
邓振山1,马亚茹2,何园2,李超2,汪飞3,贺晓龙1,赵瑞华1
(1.延安大学生命科学学院,陕西延安716000;2.石河子大学生命科学学院,新疆石河子832003; 3.延安市微生物研究所,陕西延安716000)
为了获得苹果腐烂病菌的内生拮抗菌株,并初步研究其拮抗特性以及防治效果,用平板对峙法从苹果树根部、茎部、叶片筛选到具有拮抗作用的内生菌,明确其无菌滤液的抑菌效果,并测定拮抗菌株对苹果离体果实腐烂病害的防治效果。从分离纯化的56株内生菌中筛选出12株苹果腐烂病菌的拮抗菌,其中G2、G9、J32和Y40的抑菌效果比较明显,分别为69.64%、58.93%、67.86%、67.88%,当G2和G9的无菌滤液浓度达到8%时,其抑制率最高,分别达到了78.26%、76.29%,J32和Y40的无菌滤液浓度达到8%时抑制率均达到72.33%;在苹果果实离体试验中,G2、Y40的抑制率分别达到32.56%和26.89%;所筛选的这4株菌株对小麦赤霉病菌(FusaHum graminearum)、番茄灰霉病菌(Botrytis cinerea)、烟草赤星病菌(Alternaria longipes)、棉花枯萎病菌(Fusarium oxysporun f.sp.vasinfectum)、稻瘟病菌(Pyricularia oryzae Cav)、黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerium)、西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum)均有一定的抑制作用,其中抑制率最高达79.65%;4株菌对苹果腐烂病病原菌的抑制大多数会导致病原菌菌丝畸形。试验结果表明拮抗真菌G2、G9、J32和Y40均对苹果腐烂病菌有较强拮抗作用,为进一步开展苹果主要病害的生物防治研究提供了潜在资源菌。
苹果树;内生菌;苹果腐烂病;拮抗菌株;生物防治
植物内生菌(Endophyte)是指在其生活史的一定阶段或全部阶段生活于健康植物各种组织和器官内部的真菌、细菌和放线菌,属于植物组织内的正常菌种[1]。植物内生菌是植物微生态系统的重要组成部分,在长期的协同进化过程中,与植物形成了互惠互利的关系。植物内生菌能够产生活性物质,可作为生物防治资源及新药的来源[2]。植物内生菌以其占据有利的生态地位,不易受环境条件的影响,能够很好地定殖于植物的相应部位,抵抗病原物入侵等独有的优势,成为植物病害生物防治的潜在资源菌[3],并显示出巨大的应用前景。生物农药无毒、无害、无污染,不易产生抗药性,保持生态平衡,成为国内外学者研究的焦点。苹果腐烂病(Valsa mali Miyabe et Yamada),俗称烂皮病、臭皮病,是由黑腐皮壳属(Valsa ceratosperma,无性型为壳囊孢属Cytospora)真菌引起的一种重要病害,是我国北方苹果树重要病害。主要危害6年以上的苹果树,造成树势衰弱、枝干枯死、死树,甚至毁园。中国苹果腐烂病的防治主要依靠农业防治和喷施化学杀菌剂,长期使用化学杀菌剂带来了病原菌抗药性、环境污染和果品农药残留等严重问题。随着社会对环境保护的日益关注及对绿色无公害农产品需求的日益迫切,利用拮抗微生物防治植物病害作为绿色环保、长效的防治途径已经被推到了病害防治的前沿[4]。植物内生真菌能促进寄主植物生长,增强其抗病能力,并通过与病原菌争夺营养物质和空间来抑制病原菌的生长,以及产生一些抗生素类和水解酶类等物质对病原菌的正常生长产生影响,最终导致其死亡。目前,国内关于苹果腐烂病生物防治的研究较多[5],且大多仅针对其中一种病原菌进行拮抗菌株的筛选和研究。利用植物内生菌防治苹果腐烂病已有一些报道,郜左鹏等[6]研究了内生放线菌对苹果腐烂病的防治,邓振山等[7]研究了银杏内生真菌对苹果腐烂病的抑制作用,徐涛等[8]研究了健康苹果树皮内生真菌对苹果腐烂病的防治效果。但从健康苹果树各个组织进行筛选,分离出各类型拮抗菌株的研究较少。本文从健康苹果树各个部位筛选,获得了拮抗内生菌株,利用这些菌株进行苹果腐烂病生物防治,更广泛地为苹果腐烂病筛选高效菌株,并初步探索其无菌滤液对苹果腐烂病病原菌菌丝生长的的抑制作用,为研究苹果腐烂病的生物防治提供潜在的资源菌。
1 材料与方法
1.1 材料
1.1.1 样品采集供试苹果树根部、茎部和叶片于2012年5月自延安市宝塔区枣园乡庙沟村8年生的“富士”品种苹果园采集,将从健康树采集到的样品放入采集袋做好标记并立即带回实验室,储存于4℃冰箱内,及时进行内生菌分离。
1.1.2 供试植物病原菌苹果腐烂病菌(Valsa mali Miyabe et Yamada)、小麦赤霉病菌(FusaHum graminearum)、番茄灰霉病菌(Botrytis cinerea)、玉米弯孢病菌(Curvularia lunata)、玉米大斑病菌(Helminthosporium turci cum Pass)、烟草赤星病菌(Alternaria longipes)、棉花枯萎病菌(Fusarium oxysporun f.sp.vasinfectum)、稻瘟病菌(Pyricularia oryzae Cav)、苹果炭疽病菌(Glomerella cingulata)、黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerium)和西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum)均由西北农林科技大学植物保护学院提供。
1.1.3 培养基PDA培养基,牛肉膏蛋白胨培养基,高氏一号培养基。
1.2.1 苹果树内生菌的分离纯化用无菌水浸泡苹果树茎部、根部和叶部3~5 h,用95%的乙醇浸泡2 min后,无菌水冲洗3次,再用0.1%的氯化汞表面消毒30 s,无菌水漂洗5次,将最后一次冲洗液作为对照涂布于平板以检测表面消毒是否彻底[9]。取消毒的苹果树各组织,用剪刀将叶片剪成0.5 cm2大小,将茎部、根部剪成0.25 cm长,将剪下的组织块分别接到PDA培养基平板上,每个平板接4个组织块,28℃培养72 h,待周围长出菌落后,按照菌落形态、大小、颜色等不同的特征进行初步分离纯化[10],得到纯化菌株后,接至斜面置于4℃冰箱保存备用。
1.2.2 苹果树内生菌对苹果腐烂病的抑菌试验
采用平板对峙法[11],测定经过分离纯化后的内生菌对苹果腐烂病病原菌的抑菌活性。将活化后的苹果腐烂病病原菌菌落用打孔器打成直径为6 mm的菌饼,置于PDA平板中央,用同样的方法在距其2 cm处接种已经分离纯化的内生菌,每个平板接4个菌饼,在28℃下培养;以只接种苹果腐烂病病原菌的平板为对照,每处理3次重复。待对照平板上长满菌丝时,测量菌落直径,计算菌落生长抑制率。
菌株生长抑制率(%)=((对照组菌落直径-处理组菌落直径)/对照组菌落直径)×100%
1.2.3 拮抗菌无菌滤液对苹果腐烂病菌菌丝生长的影响①拮抗菌无菌滤液的制备:将4℃保存的菌株转接到PDA液体培养基中活化3次,将拮抗菌菌株按10%的接种量接种到PDA液体培养基中(装液量100 mL/300 mL三角瓶),28℃、180 r/min培养4 d,分别将其培养液装入50 mL的离心管,用低温高速冷冻离心机(4℃,10 min,6 000 r/min)离心3次,每次取其上清液,然后用一次性针孔式微孔滤器(0.22 μm,50 mm,水系,混合纤维)过滤,即得到该菌的无菌滤液[12-13],4℃保存备用。②拮抗菌无菌滤液对苹果腐烂病病原菌菌丝的抑制率测定:取已制备的无菌滤液,置于定量的PDA(45℃)培养基中,使其体积分数分别达到2%、4%、6%、8%、10%,然后将培养基置于灭菌的培养皿(9 cm)中,待培养基凝固后在平板中央接种6 mm的苹果腐烂病病原菌菌饼,以加无菌水的PDA培养基处理作为空白对照,每次处理3次重复,28℃恒温培养72 h后,用十字交叉法测量苹果腐烂病病菌的直径,计算抑制率(公式同上)。
1.2.4 离体果实试验摘取大小、成熟度一致的苹果,在果实的两侧用消毒刀片分别切除一小块,编为1号、2号,1号接20 μL清水为对照,2号接20 μL拮抗菌无菌滤液,保鲜膜封口,将果实于20℃黑暗条件下培养,1 d后将一块直径为6 mm苹果腐烂病病原菌菌饼接种于切口内,然后重新用新的保鲜膜封口,置于黑暗条件下培养5 d后测量对照组和处理组的病斑直径,每个处理3次重复,根据病斑直径计算拮抗菌株的抑制率[14]。
拮抗菌株的抑制率(%)=((对照组病斑直径-处理组病斑直径)/对照组病斑直径)×100%
1.2.5 抗菌谱试验为探究所筛选内生菌针对其他指示菌的拮抗性能,采用平板对峙法,测定经平板对峙实验筛选的具有明显拮抗作用的内生菌抗性菌谱,供试病原菌为除苹果腐烂病病原菌之外的10种指示菌,将病原菌接种于PDA平板培养基中央,28℃培养,待菌丝长满培养皿,用打孔器在菌落边缘制成菌饼,将其置于另一PDA平板中央,并距菌饼约2 cm处用同样方法接种所筛选的内生菌,28℃培养;以只接10种指示菌的平板为对照,每次处理3次重复,待对照平板长满菌丝,测量菌落直径,计算菌落生长抑制率。10株植物病原菌分别为小麦赤霉病菌(FusaHum graminearum)、番茄灰霉病菌(Botrytis cinerea)、烟草赤星病菌(Alternaria longipes)、棉花枯萎病菌(Fusarium oxysporun f.sp.vasinfectum)、稻瘟病菌(Pyricularia oryzae Cav)、黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerium)、西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum)、玉米弯孢病菌(Curvularia lunata)、玉米大斑病菌(Helminthosporium turcicum Pass)和苹果炭疽病菌(Glomerella cingulata),编号为1~10。
无节幼体阶段依靠自身体内卵黄做营养,无须投喂饵料。在这一阶段,水温控制在20~22℃,PH保持在7.8~8.6,无节幼体期水质比较清净,幼体耗氧量低,微充气即可。无节幼体期历时约4d,经过6次蜕皮变态为蚤状幼体。无节幼体培育期间每天加水15~20cm。
1.2.6 拮抗菌株对苹果腐烂病病原菌的抑制作用将筛选到的拮抗菌和病原菌分别接入平板内进行平板对峙试验,5 d后观察有无抑制圈,当拮抗菌株对苹果腐烂病病原菌有抑菌圈时,从拮抗菌株与病原菌的抑菌带中挑取菌丝,制成装片,在显微镜下观察菌丝形态有无变化[15],并拍照记录。
1.2.7 数据处理采用Microsoft Excel 2007软件进行数据处理和IBM SPSS Statistic 19进行试验分析。
2 结果与分析
2.1 苹果树内生菌的分离和筛选
从苹果树茎部、根部、叶片中分离的56株菌株中,筛选12株有一定抑菌活性的内生菌(表1),其中菌株G2、G9、J32和Y40对苹果腐烂病菌具有较强的抑菌活性,均达到了55.0%以上,菌株G2的抑菌活性最强,其抑制率为69.64%。通过形态学对这4种内生菌进行初步鉴定,其中G9、J32和Y40分属于链格孢属(Alternaria sp.)、茎点霉属(Phoma sp.)和球壳孢属(Sphaeropsis sp.),菌株G2归属于诺卡氏放线菌(Nocardia),见表2。

表1 苹果拮抗内生菌对苹果腐烂病菌菌丝生长的抑制作用Table 1Inhibitory effects of antagonistic fungus on mycelial growth of V.ceratosperma

表2 G2、G9、J32和Y40的分类结果Table 2The identification of strains G2,G9,J32 and Y40
2.2 拮抗菌无菌滤液对苹果腐烂病菌菌丝生长的影响结果
由表3可以看出,拮抗菌无菌滤液对病原菌菌丝生长有一定的抑制作用,在一定范围内,随无菌滤液浓度的增加菌落直径减小,而菌丝生长的抑制率相应提高。当G2菌株培养基的无菌滤液体积分数达到8%时抑制效果最好,病原菌菌丝生长明显受到抑制,抑制率达到78.26%;G9的无菌滤液体积分数达到8%时,其抑制率最高,达到76.29%;Y40、J32的无菌滤液体积分数达到8%时抑制效果最好,抑制率均为72.33%(表3)。
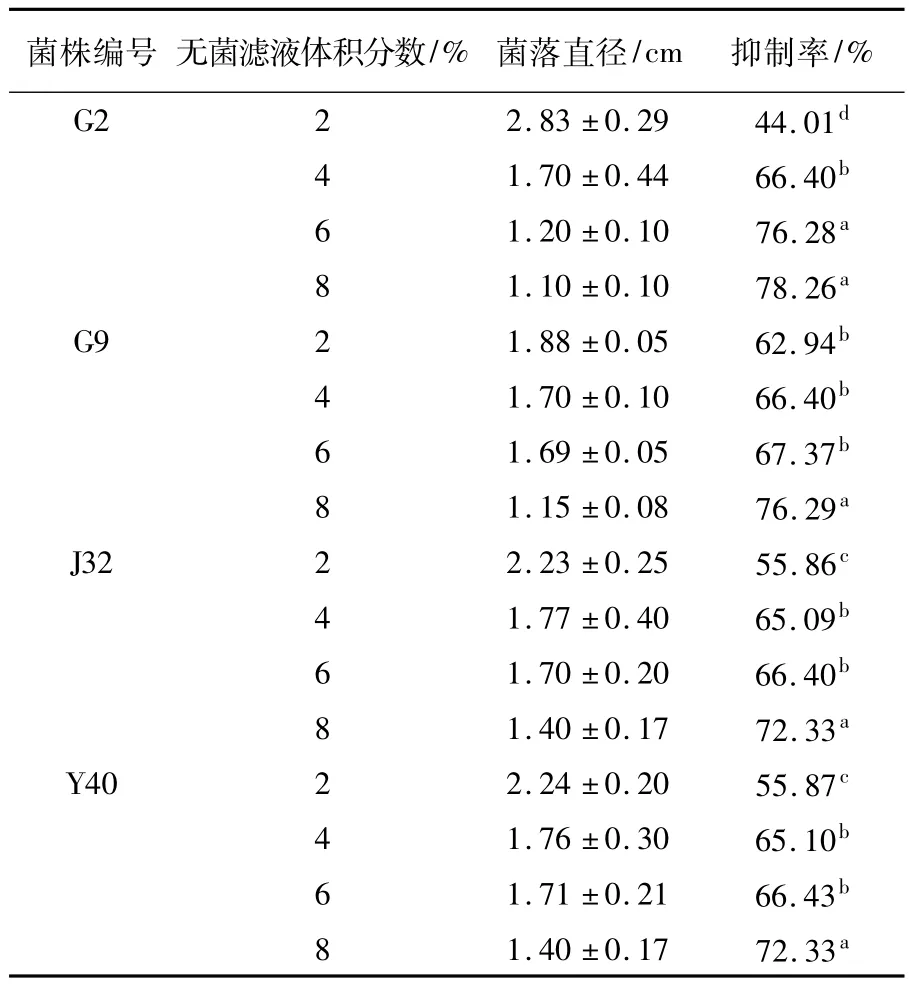
表3 无菌滤液对病原菌菌丝生长的抑制效果Table 3Effectof cell free fermented filtration on mycelial growth of pathogen
2.3 离体果实试验结果
果实离体试验结果表明,4株拮抗菌无菌滤液对苹果腐烂病病原菌具有明显的抑制作用,其中G2和Y40的抑制率较高,分别为32.56%和26.89%,G9和J32的抑制率分别达24.34%和22.64%,见表4。
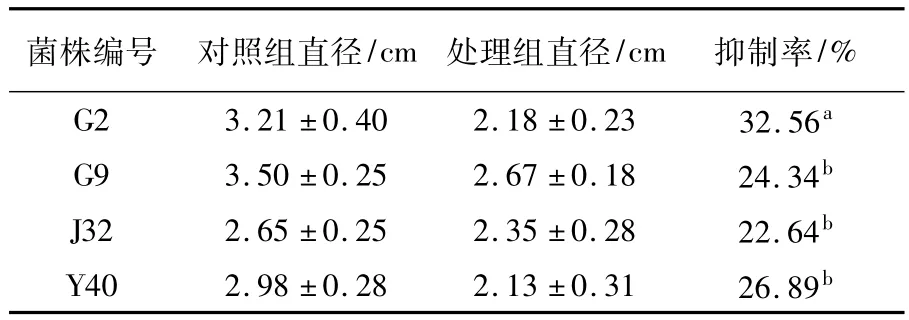
表4 拮抗菌株无菌滤液对苹果腐烂病病原菌的离体果实试验Table 4Control efficacy of the antibiotic cell free fermented filtration against V.ceratosperma on isolated fruit
2.4 抗菌谱试验
测定G2、G9、J32、Y40对除苹果腐烂病病原菌外的10株病原菌的抑制能力,绘制出抗性菌谱。对10种常见植物病原真菌的抑菌活性测定结果表明,拮抗菌株G9、J32、Y40对10株病原菌中的7株植物病原菌(1~7号)均具有明显的抑制作用,但对其中的3种病原菌(8~10号)抑制效果不明显;菌株G2对10株菌都有抑制作用,其中对小麦赤霉病菌的抑制率最高,达到79.65%;菌株G9、J32、Y40对小麦赤霉病菌的抑制率最高,分别为67.83%、55.81%和51.16%,见图1。
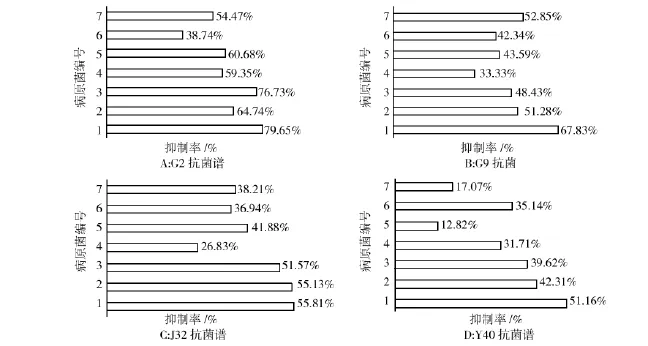
图1 拮抗菌株对7种常见病原真菌的抑菌活性Fig.1Inhibition activities of antagonistic strains against seven common pathogenic fungi
2.5 拮抗菌株对苹果腐烂病病原菌的抑制作用
试验表明,G2、G9、J32、Y40均出现抑制圈,用显微镜观察装片的菌丝,发现菌丝的形态有明显变化(表5),G2、G9、J32、Y40的抑制使病原菌菌丝发生不同变化(图2)。

表5 4株拮抗菌对苹果腐烂病病原菌的抑制作用Table 5Inhibitory effect of antagonistic bacteria on the mycelia growth of V.ceratosperma

图2 苹果腐烂病病原菌的菌丝形态Fig.2Morphology of V.ceratosperma normal myceliaA:受拮抗苹果腐烂病病原菌畸形和断裂菌丝;B:正常苹果腐烂病病原菌菌丝A:Malformation and cracked mycelium of V.ceratosperma were antagonized;B:The normal mycelia of V.ceratosperma
3 讨论
本研究自健康苹果树的根部、茎部、叶片组织中分离筛选了4株内生菌G2、G9、J32、Y40,研究了其无菌滤液对苹果腐烂病病原菌的抑制效果,以及对离体果实的防治效果。结果表明,所分离的内生菌对苹果腐烂病病原菌有较强的抑制作用及生物防治能力,抗性菌谱的试验表明,这些内生菌不仅对苹果腐烂病病原菌有抑制作用,而且对其他植物病原菌有一定的抑制作用,如小麦赤霉病菌(FusaHum graminearum)、番茄灰霉病菌(Botrytis cinerea)、烟草赤星病菌(Alternaria longipes)、棉花枯萎病菌(Fusarium oxysporun f.sp.vasinfectum)、稻瘟病菌(Pyricularia oryzae Cav.)、黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerium)、西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum),表明从健康植物体内筛选内生菌对植物病虫害的防治有效,同时也为生物农药的制备提供了依据。
本研究筛选得到的4株拮抗菌中,G2的抑制率最高,G9、J32的抑制率次之,Y40的抑制率最低。拮抗菌株的无菌滤液对苹果腐烂病病原菌的抑制效果较好,说明有某种活性物质使菌株有拮抗性能[16],结合苹果离体试验结果可知,拮抗菌对苹果腐烂病的离体果实试验效果不够明显,这可能与培养时间长短有关,也可能是由于拮抗菌对环境的适应性差。大量研究证明拮抗菌产生抑制的作用机制有很多,主要有竞争、拮抗、溶菌、诱导植物抗病和促进植物生长等几个方面[17],本研究筛选到的拮抗菌对苹果腐烂病病原菌均有很好的防效,抑制机制多为拮抗、溶菌等,使病原菌菌丝发生断裂、畸形、萎缩。在苹果果实离体条件下,由拮抗菌产生的具有拮抗活性的次生代谢产物是拮抗菌发挥抑制性能的主要作用机制[18-20]。
内生菌研究的巨大潜力体现在内生菌对植物病害防治上,但就近年来使用情况看,在农作物生产中应用植物内生菌防治病害时还存在一些问题,如大多数拮抗细菌的筛选及其防治性能测定仅在实验室进行,与室外运用在各方面都有较大差别,因为植物内生菌本身是一个生物活体,田间环境和植物体微生态环境中许多因子都会影响内生菌防病作用的发挥,因此,有关拮抗菌的有效作用成分、抑菌机理、在田间的适应能力、稳定性以及田间防治效果等,尚有待进一步深入研究[21-22]。
[1]Kleopper J W,Schippers B,Bakker P A H M.Proposed elimination of the term endorhizosphere[J].Phytopathology,1992,82(7):726-727.
[2]胡桂萍,郑雪芳,尤民生,等.植物内生菌的研究进展[J].福建农林学报,2010,25(2):226-234.
[3]罗明,芦云,张祥林.棉花内生细菌的分离及生防益菌的筛选[J].新疆农业科学,2004,41(5):277-282.
[4]刘宁,张辉,郑文,等.药用植物内生放线菌的生物活性及菌株D62的代谢产物分析[J].微生物学报,2007,47 (5):823-827.
[5]曹克强,国立耘,李保华,等.中国苹果树腐烂病发生和防治情况调查[J].植物保护,2009,35(2):114-117.
[6]郜佐鹏,柯希望,韦洁玲,等.七株植物内生放线菌对苹果树腐烂病的防治作用[J].植物保护学报,2009,36(5): 410-416.
[7]邓振山,赵龙飞,张薇薇,等.银杏内生真菌的分离及其对苹果腐烂病病原菌的拮抗作用[J].西北植物学报,2009,29(3):608-613.
[8]徐涛,胡同乐,王亚南,等.苹果树皮内生真菌的分离及其对腐烂病的生物防治潜力[J].植物保护学报,2012,39 (4):327-333.
[9]王现坤,张晓华,郝双红.侧柏内生真菌的分离鉴定及抗菌活性筛选[J].农药,2010,49(7):519-521,532.
[10]郭建新,孙广宇,张荣,等.银杏内生真菌抗真菌活性菌株分离和筛选[J].西北农业学报,2005,14(4):14-17.
[11]操海群,岳永德,花日茂,等.植物源农药研究进展[J].安徽农业大学学报,2000,27(1):40-44.
[12]Campanile G,Ruscelli A,Luisi N.Antagonistic activity of endophytic fungi towards Diplodia corticola assessed by in vitro and in plant test[J].European Journal of Plant Pathology,2007,117:237-246.
[13]邓振山,马娜娜,徐文梅,等.大蒜鳞茎中抗番茄灰霉病菌内生菌的筛选及其防治效果[J].西北农林科技大学学报(自然科学版),2012,40(5):50-56.
[14]刘霞,党峰峰,贺晓龙,等.陕北野生甘草内生菌的分离及抑菌活性筛选[J].西北植物学报,2010,30(10):2110-2115.
[15]王树桐,王亚南,胡同乐,等.板蓝根根腐病病原鉴定[J].植物保护学报,2011,38(5):473-474.
[16]Gond S K,Verma V C,Kumar A,et al.Kharwar.Study of endophytic fungal community from different parts of Aegle marmelos Correae(Rutaceae)from Varanasi(India)[J].World J Microbiol biotechnol,2007,23:11371-1375.
[17]陈红兵,马林,韩巨才,等.放线菌Lj20抗真菌物质的分离及其在病害防治中的作用[J].植物保护学报,2011,38 (1):42-46.
[18]姜述君,杨云强,石园园,等.生防菌Alternaria amaranthi-3对反枝苋的防治效果[J].植物保护学报,2010,37(1):78-82.
[19]贾栗,陈疏影,翟永功,等.近年国内外植物内生菌产生物活性物质的研究进展[J].中草药,2007,38(11): 1750-1754.
[20]郑维发.真菌代谢产物的药物发现——资源、问题和策略[J].菌物学报,2011,30(2):151-157.
[21]陈传文,孙前光,朱军,等.三种药用植物内生菌的分离及其抗肿瘤活性菌株的筛选[J].微生物学通报,2010,37 (10):1462-1466.
[22]杨松,李春杰,黄玺,等.被内生真菌侵染的禾草提取液对真菌的抑制作用[J].菌物学报,2010,29(2):234-240.
Screening Endophytic Bacteria Strains of Anti-Apple Tree Decay (Valsa ceratosperma)from Apple Trees and Their Control Effect
DENG Zhen-shan1,MA Ya-ru2,HE Yuan2,LI Chao2,WANG Fei3,HE Xiao-long1,ZHAO Rui-hua1
(1.Coll.of Life Sci.,Yan’an Uni.,Yan’an,716000;2.Coll.of Life Sci.,Shihezi Uni.,Shihezi 832003; 3.Yan’an Inst.of Microbiol.,Yan’an 716000)
Endophytic antagonistic bacterial strains against apple tree decay(Valsa ceratosperma,Vc)were screened to explore their inhibitory and bio-control effects initially.Endophytic bacteria were isolated from the apple trees with the antagonism experiment by confrontation culturing on PDA media.Under condition in vitro of apple fruits,their prevention and control effect to Vc were measured.Moreover,the endophytic antagonistic bacteria were measured to antagonistic effect by using confrontation culturing.The results indicated that four strains of them(G2,G9,J32,Y40) have a striking inhibitory effect,the antagonistic effect of G2,G9,J32 and Y40 to Vc were 69.64%,58.93%,67.86%,and 67.88%.respectively.The antagonistic effect of G2,G9,J32 and Y40 to Vc were obvious,the highest inhibitory rate up to 78.26%,76.29%,72.33%,and 72.33%at the filtrate concentration 8%respectively.The highest inhibitory rate of the fruit in vitro reached 32.56%and 26.89%respectively.The antimicrobial spectrum test showed that four strains expressed antibiotic activity on Fusarium oxysporum f.sp.niveum,Curvularia lunata,Al-ternaria longipes,F.graminearum,Glomerella cingulata,Pyricularia oryzae Cav.,F.oxysporun f.sp.vasinfectum,the highest inhibition rate up to 79.65%.At the same time,they exhibited inhibition activities against V.ceratosperma,their hyphae were deformative under microscope.Therefore,endophytic bacteria G2,G9,J32,and Y40 have a striking inhibitory effect against V.ceratosperma.They were considered as potential fungal resource for further study on V.ceratosperma.
apple tree;endophytes bacteria;antagonistic bacteria;Valsa ceratosperma;bio-control
Q939.95
A
1005-7021(2016)04-0016-06
10.3969/j.issn.1005-7021.2016.04.003
延安市科技局重大专项(2014CGZH-06);陕西省科技惠民计划项目(2014HM-14);陕西省科技统筹创新工程项目(2012KTZB03-02-03,2012CGX7,2016TTC-N-3-1)
邓振山男,副教授,博士。主要从事植物病害综合防治和环境微生物研究。E-mail:zhenshandeng214@163.com
2015-06-19;
2015-09-09