新型疟疾传播阻断疫苗候选抗原PbPSOP7基因截短片段的克隆及表达特点的研究
2016-02-13李敏郑文琪何一雯王琳寇叙曹雅明罗恩杰
李敏,郑文琪,何一雯,王琳,寇叙,曹雅明,罗恩杰*
(1.中国医科大学基础医学院病原生物学教研室,辽宁沈阳110021;2.中国医科大学附属第一医院内分泌科,辽宁沈阳110001;3.中国医科大学基础医学院免疫学教研室,辽宁沈阳110021; 4.内蒙古医科大学附属医院外科实验室,内蒙古呼和浩特010050)
新型疟疾传播阻断疫苗候选抗原PbPSOP7基因截短片段的克隆及表达特点的研究
李敏1,2,郑文琪1,4,何一雯3,王琳1,寇叙1,曹雅明3,罗恩杰1*
(1.中国医科大学基础医学院病原生物学教研室,辽宁沈阳110021;2.中国医科大学附属第一医院内分泌科,辽宁沈阳110001;3.中国医科大学基础医学院免疫学教研室,辽宁沈阳110021; 4.内蒙古医科大学附属医院外科实验室,内蒙古呼和浩特010050)
传播阻断疫苗(transmission-blocking vaccines,TBVs)可以有效地阻断疟原虫从蚊媒向人的传播,是控制疟疾流行的关键,但目前的TBVs候选抗原十分有限,迫切需要寻找有效的候选抗原。动合子分泌蛋白7 (putative secreted ookinete protein 7,PSOP7)在疟原虫有性生殖阶段发挥着至关重要的作用,本研究对伯氏疟原虫抗原PSOP7(PbPSOP7)进行简要的生物信息学分析,并应用原核表达系统高效表达纯化了截短的重组PbPSOP7蛋白(rPbPSOP7),免疫BALB/c小鼠后,获得小鼠高滴度多克隆抗体。经Western Blot方法证实该多克隆抗体可识别疟原虫抗原。间接免疫荧光实验显示,PbPSOP7主要表达于疟原虫的合子与动合子表面。这些特点符合TBVs的基本设计理念,为确认和证实PbPSOP7蛋白具有疟疾TBVs候选抗原的潜能奠定基础。
疟疾;伯氏疟原虫;传播阻断疫苗;重组蛋白;PbPSOP7
Keywordsmalaria;Plasmodium berghei;TBV;recombinant protein;PbPSOP7
疟疾是疟原虫经媒介按蚊传播引起的一种严重威胁人类健康的感染性寄生虫疾病,根据2015年的WHO全球疟疾报告与相关文献指出,疟疾给全球尤其是发展中国家带来了沉重的健康危害和严重的经济负担[1-2]。近50年来,全球有多个地区报道疟原虫对氯喹、氨喹等经典抗疟药均已产生抗药性,使疟疾的防治更加严峻[3]。因而,国际疟疾消除专家委员会(MalERA)认为控制疟疾传播的关键是研发新的疫苗,即传播阻断疫苗(transmission-blocking vaccines,TBVs)是控制疟疾流行极为重要的手段[4]。疟疾疫苗根据疟原虫的生活史分三大类:红前期疫苗、红内期疫苗以及传播阻断疫苗。红前期疫苗与红内期疫苗分别具有抗感染与降低疟疾临床发病率的作用,但两者的候选抗原均暴露于人体免疫系统,受到人体免疫压力等因素的影响,候选抗原存在广泛的基因多态性[5]。TBVs主要针对疟原虫的有性发育阶段发挥作用,可阻止疟原虫在蚊体内的后续发育,从而彻底切断疟原虫的传播。TBVs候选抗原主要表达于疟原虫的有性生殖阶段,其抗原并不在脊椎动物免疫系统的选择压力之下,所以这些蛋白显示出非常低的多态水平,不易出现抗原变异,更有利于疫苗的免疫效果,因此成为当前疟疾疫苗研究的热点[6]。尽管TBVs对控制疟疾的流行具有非常重要的意义,但其研发进展依然很缓慢。迄今为止,有限的研究发现了一些TBVs候选蛋白,包括P48/45与P230(表达于配子体与配子)以及P25/P28(表达于合子与动合子)与HAP2 (表达于蚊阶段)4种[7-8],一些实验证实上述候选抗原诱导的抗体有一定的传播阻断活性,但若想实现完全阻断传播还需要改进。因此,寻求筛选新的疟原虫TBVs候选抗原尤为重要和迫切。PSOP(putative secreted ookinete protein)为假设的动合子分泌蛋白,包括PSOP1、2、4、6、7、9、12、15、17、21、23、24等,因这些蛋白均在动合子阶段表达且为分泌蛋白等特点由Ecker等[9]在2008年命名。其中,PSOP7对动合子侵入蚊胃壁上皮细胞、卵囊的形成与成熟乃至子孢子感染小鼠的能力方面均发挥着至关重要的作用,提示PSOP7可能是另一个非常有效的TBVs候选抗原。PSOP7在疟原虫种间具有高度的保守性,通过可进行人工操作、且具有明显易用性的鼠疟模型进行相关研究即可推测出其在其他疟原虫种间的作用。所以,本项目对伯氏疟原虫特异性动合子分泌蛋白PbPSOP7进行了简要的生物信息学分析,截取Pb-PSOP7的优势抗原表位区,应用原核表达系统表达和纯化重组蛋白,将rPbPSOP7蛋白免疫动物后收集抗血清,进而系统性的验证抗血清的滴度、抗血清与抗原结合的能力等,并应用间接免疫荧光法对PbPSOP7的表达阶段进行确定,以期为进一步验证PbPSOP7蛋白具有疟疾TBVs候选抗原的潜能奠定基础,为疟疾疫苗的研制提供新的理论和实验依据。
1 材料与方法
1.1 材料
伯氏疟原虫(ANKA株),大肠埃希菌Rosettagami B(DE3)均为本室保存;6~8周龄BALB/c雌性小鼠购自中国医科大学实验动物部;原核表达载体pET32a(+),小鼠抗His单克隆抗体均为Novagen公司产品;Anti-Pb21 mAb为日本自治大学Hiroyuki Matsuoka教授馈赠;限制性内切酶、连接酶、质粒提取和胶回收试剂盒等均购自大连Takara公司;镍氨三乙酸琼脂糖柱Ni-NTA His· BindSuperflow购自Novagen;FITC,HRP标记的羊抗鼠IgG购自Invitrogen公司;其余常用化学试剂均为国产分析纯。
1.2 方法
1.2.1 PET32a(+)-PbPSOP7载体的构建为表达PbPSOP7蛋白,在排除蛋白的信号肽后,截取蛋白的优势抗原表位区(31~210 aa),设计引物: primer F:CTGGATCCGAAAATTTAAATGATGTAG AGAATAAATTT;primer R:CAGCGGCCGCGTCTTCAAACAAATTATCAATGGTTTC。以P.berghei基因组DNA为模板,扩增目的基因片段。经琼脂糖凝胶电泳,切下目的基因片段,用DNA纯化试剂盒对PCR产物进行回收。将所得目的片段克隆入PMD18-T载体后,转化宿主菌DH-5α,经菌体PCR方法鉴定阳性克隆,挑取阳性克隆,提取质粒后,送检测序,测序结果经NCBI数据库中的BLAST工具进行比对。将测序结果正确的质粒用限制性核酸内切酶BamHⅠ、NotⅠ进行双酶切反应,将酶切后的DNA片段回收并纯化。用T4 DNA连接酶连接同样进行过双酶切(BamHⅠ与NotⅠ)消化过的原核表达载体pET32a(+),连接后的产物转化宿主菌Rosetta-gami B(DE3)中,采用双酶切(BamHⅠ与NotⅠ)方法鉴定阳性克隆,并挑取阳性克隆保存菌种。
1.2.2 rPbPSOP7重组蛋白的表达与纯化挑取鉴定正确的阳性菌落,37℃摇菌过夜,次日按1100的比例转接到新鲜的LB培养基,37℃摇菌2 h后测定菌液的OD值。当OD值达到0.6~0.8后,加入IPTG至终浓度1.0 mmol/L,20℃诱导12 h,离心收菌。菌体加入1×Ni-NTA结合缓冲液重悬并进行超声裂解菌体(超声2 s,间隔3 s,全程时间30 min,冰上进行),4℃条件下离心5 min,取上清液样品,经镍氨三乙酸琼脂糖柱Ni-NTA His·BindSuperflow(Novagen)进行蛋白纯化。用50 mmol/L咪唑(含300 mmol/L NaCl与50 mmol/ L磷酸盐缓冲液,pH 8.0)洗涤2次后,用250 mmol/L咪唑(300 mmol/L NaCl与50 mmol/L磷酸盐缓冲液,pH 8.0)对重组蛋白进行洗脱。纯化后的rPbPSOP7在0.1 mol/L PBS(pH 7.4),4℃条件下透析过夜,并应用10%SDS-PAGE进行结果检测。
1.2.3 实验动物免疫及血清采集6~8周龄BALB/c雌性小鼠10只,分2组,每组5只。第1组注射rPbPSOP7重组蛋白,第2组为His标签蛋白对照组(经pET32a(+)空载体诱导并纯化)。用纯化的重组蛋白(50 μg/小鼠)与弗氏完全佐剂混合100 μL,皮下注射免疫小鼠。于第3周和第5周再分别给予2次加强免疫,25 μg重组蛋白与弗氏不完全佐剂混合,100 μL/小鼠。于每次免疫前一天与最后一次免疫后第10天,尾静脉收集每只小鼠血液,室温凝集后收集血清。
1.2.4 ELISA检测抗体滴度用溶解在碳酸盐缓冲液的rPbPSOP7(6 μg/mL)包被96孔酶标板,pH 9.6,4℃过夜。经300 μL PBST洗2次后,用含1%BSA的PBS封闭液封闭1 h。经PBS洗3次后,以封闭液稀释rPbPSOP7/His标签蛋白免疫后的鼠血清(13 200稀释)37℃孵育2 h,PBST (0.1 mol/L PBS,pH 7.4,0.02%Tween-20)清洗3次。加入15 000倍稀释的HRP标记的羊抗鼠IgG,37℃孵育2 h,PBST清洗5次后,加入底物邻苯二胺和过氧化氢进行显色,100 μL H2SO4终止反应。酶标仪检测490 nm处OD值。
1.2.5 动合子培养与抗原提取1×106P.berghei RBC感染小鼠,感染第3天,乙醚麻醉小鼠,心脏采血,1 mL血液置于9 mL动合子培养液中(RPMI 1640含50 mg/L青霉素,50 mg/L链霉素,100 mg/L新霉素,20%(体积分数)胎牛血清,1 mg/L肝素钠,pH 8.3),19~20℃培养24 h,收集培养悬液,取1 μL混合液经甲醇固定后经Giemsa染色检测培养效果。收集疟原虫,用0.15%的皂角苷裂解去除红细胞。疟原虫抗原经裂解液(1%Triton X-100,2%SDS,PBS溶解,含蛋白酶抑制剂)进行裂解30 min。
1.2.6 Western blot纯化后的蛋白或疟原虫抗原(10 μg/孔)用10%的SDS-PAGE电泳分离。电泳完毕后,4℃40 V恒压转膜3 h。以5%(质量分数)脱脂奶粉(TBS溶解)4℃封闭过夜。TBST (0.1 mol/L TBS,pH 7.4,0.02%Tween-20)漂洗3次。TBST稀释的抗His单克隆抗体(11 000稀释)或抗rPbPSOP7/抗His标签鼠血清(1500)与PVDF膜室温结合3 h。充分洗涤后加入HRP标记的羊抗鼠IgG抗体(15 000稀释)37℃孵育1 h;PBST和PBS充分洗涤后添加显色剂,用ECL发光方法在荧光图像分析系统中检测。
1.2.7 间接免疫荧光试验(Indirect immunofluorescence assay)疟原虫经PBS洗1次后经4%多聚甲醛室温固定20 min,用0.1%Triton X-100进行透膜10 min。50 mmol/L甘氨酸/PBS进行漂洗后,用含5%脱脂奶粉的PBS 37℃封闭30 min。加入1500稀释抗rPbPSOP7血清//抗Pbs21 mAb(Pbs21为表达于动合子表面的特异性蛋白,阳性对照)/抗His标签鼠血清(阴性对照),37℃孵育2 h。PBS漂洗后加入FITC标记的羊抗鼠IgG(1500稀释)20 μL,37℃孵育60 min。DAPI染色5 min后经抗淬灭封片剂ProLong Gold antifade reagent封片,荧光显微镜观察结果,Adobe Photoshop分析结果。
2 结果与分析
2.1 PbPSOP7生物信息学分析
根据疟原虫数据库的描述及生物信息学分析显示,PbPSOP7为保守的疟原虫蛋白,DNA长为2 439 bp,蛋白质分子量为93 583 Da。PbPSOP7蛋白存在一个信号肽与一个CBM_5_12结构域,同时存在一些低度复杂区(图1)。

图1 PbPSOP7蛋白的模式图Fig.1Identification and domain organization of PbPSOP7 protein红色代表信号肽,粉色为低度复杂区,CBM_5_12为结构域,31~210 aa为原核核表达区域,标尺为100 aaThe signal peptide,low complexity,and predicted protein domain are highlighted in red,pink,gray respectively.E.coliexpression regions(31~210 aa)were shown in short line.Scale bar,100 aa
2.2 PET32a(+)-PbPSOP7的构建
PET32a(+)-PbPSOP7质粒的BamHⅠ和NotⅠ双酶切鉴定结果如图2A所示,目的片段大小为630 bp,与预期相符,证明表达载体构建正确。

图2 重组质粒与纯化后的蛋白鉴定Fig.2The identification of recombinant plasmid and purified proteinA:PET32a(+)-PbPSOP7重组质粒双酶切鉴定结果; M;DL2000 marker,1:经BamHⅠ和NotⅠ酶切的PET32a(+)-PbPSOP7质粒;B:rPbPSOP7蛋白纯化后的SDS-PAGA电泳检测结果,M:蛋白marker,1:rPbPSOP7蛋白(~40 kDa),2:His标签蛋白(~18 kDa);C:Western blot检测rPbPSOP7的分子量,M:蛋白marker,1:rPbPSOP7蛋白(~40 kDa),2:His标签蛋白(~18 kDa)A:PET32a(+)-PbPSOP7 recombinant plasmid double digestion results,M:DL2000 Marker,1:by BamHⅠand NotⅠdigested PET32a(+)-PbPSOP7 plasmid;B:SDS-PAGA electrophoresis test result of purified rPbPSOP7 protein,M: protein marker,1:rPbPSOP7 protein(~40 kDa),2:Histagged protein(~18 kDa);C:Western blot detection molecular weight of rPbPSOP7,M:protein marker,1:rPbPSOP7 protein(~40 kDa),2:His-tagged protein(~18 kDa)
2.3 rPbPSOP7蛋白表达与纯化
PET32a(+)-PbPSOP7重组表达载体经IPTG诱导、超声破碎后,取上清进行检测,约在40 kDa处可见明显的目的蛋白带,证明rPbPSOP7重组蛋白主要以可溶形式表达。经His-tag镍氨三乙酸琼脂糖柱纯化、洗脱及透析后的样品进行Western blot检测,可清晰看到目标蛋白条带,检测其蛋白纯度>80%,浓度可达到0.5 mg/mL(图2B)。抗His单克隆抗体可在蛋白分子量约40 kDa处出现清晰的特异性免疫印迹条带,进一步证明rPbPSOP7得到了正确表达与纯化(图2C)。
2.4 rPbPSOP7免疫血清内特异性抗体检测

图3 ELISA检测小鼠经rPbPSOP7免疫后的抗体效价Fig.3ELISA analysis of antibody titer of rPbPSOP7 immunized mice**P<0.01
ELISA结果显示,于初次免疫后2周,rPbPSOP7蛋白免疫组小鼠的血清特异性抗体水平有显著升高。两次加强免疫后抗体一直维持在较高水平,与His标签免疫组相比差异显著(P<0.01,图3)。如图4所示,rPbPSOP7免疫血清与转有疟原虫全虫抗原的PVDF膜进行Western blot反应,在约94 kDa的区域出现条带,与预期大小相符,说明rPbPSOP7免疫血清可与原始的疟原虫抗原反应,rPbPSOP7具有良好的抗原性。
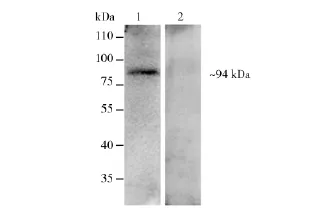
图4 Western blot检测rPbPSOP7免疫血清的抗原性Fig.4Western blot analysis of antigenicity of rPbPSOP7 serumM:蛋白marker;1:抗rPbPSOP7蛋白鼠血清(~94 kDa);2:抗His标签蛋白鼠血清(阴性对照)M:protein molecular weight marker;1:anti-rPbPSOP7 mice sera(~94 kDa);2:anti-His-tagged mice sera(negative control)
2.5 IFA检测PbPSOP7的表达阶段

图5 IFA确定PbPSOP7的表达阶段Fig.5Localization of PbPSOP7protein in parasitesBF:普通光镜明视野照片;FITC显示为绿色荧光;DAPI:疟原虫核DAPI染色;Merge:第二列与第三列合成图。抗Pbs21为阳性对照,抗His标签为阴性对照Using an immunofluorescent assay(IFA),parasites were stained with antisera(FITC shown in green),BF,(bright field).Nuclei were stained with DAPI(blue),Anti-Pbs21 mAb(positive control),anti-His-tagged mice sera(negative control)
取血液阶段的疟原虫与体外培养的合子、动合子进行IFA试验,进一步确定蛋白的表达阶段。如图5所示,PbPSOP7主要表达于合子与成熟的动合子阶段,且主要表达于细胞表面。
3 讨论
TBVs主要是应用疟原虫有性生殖阶段和蚊阶段的表面抗原免疫个体,诱导产生的抗体可有效地阻止疟原虫在蚊体内的后续发育,从而切断疟原虫的传播,是防控疟疾大范围流行的有效工具之一。近30年的研究发现了一些具有一定的传播阻断潜能的候选抗原,包括恶性疟原虫相关蛋白Pfs25、Pfs28、Pfs48/45、HAP2、Pfs230及间日疟原虫相关蛋白Pvs25、Pvs28、Pvs48/45和Pvs230等,但已知候选抗原的数目非常有限,且不能达到最理想的传播阻断效果,所以筛选增加新的、高效的TBVs候选抗原已成为未来疟疾研究的重要方向之一[1-8]。
随着近年来多种疟原虫基因组测序工作的相继完成,蛋白质组学与基因表达谱的相继发展等都为筛选新的TBVs抗原及最终攻克疟疾顽疾打开了一扇新的大门。Ecker等应用反向遗传学筛选和基因靶向敲除揭示靶向敲除pbpsop7后并未导致疟原虫在血液阶段的变化,但却明显的降低了按蚊的感染能力,说明PbPSOP7在疟原虫的有性生殖阶段发挥至关重要的作用[9]。鉴于特定碳水化合物是蚊中肠上皮细胞识别并结合动合子的重要配体,而PbPSOP7具有一个C末端碳水化合物结合结构域(GBM_5_12),可推断PbPSOP7可能做为伯氏疟原虫动合子侵入蚊胃的靶受体来发挥重要的作用[10]。
为证实PbPSOP7在疟原虫生活史中的作用,并为后续评估其成为TBVs候选抗原的可能性奠定基础,本研究构建了PET32a(+)-截短的PbPSOP7原核表达载体,选用了易于异源蛋白质表达的Rosetta-gami B(DE3)大肠埃希菌菌株做表达宿主[11],并采取低温诱导蛋白的方法[12]解决了因疟原虫基因组中腺嘌呤与胸腺嘧啶含量过高而不利于在大肠埃希菌中表达[13]的难题,成功表达并纯化了截短的PbPSOP7重组蛋白,蛋白纯度可达到80%及以上,且浓度可达到0.5 mg/mL,并获得了高滴度的鼠特异性多克隆抗体。同时,Western blot实验与间接免疫荧光试验显示截短的rPbPSOP7诱导的血清特异性抗体能够特异性识别天然疟原虫的表面抗原,提示在E.coli内所表达的rPbPSOP7蛋白构象可能类似于其天然蛋白构象,表明重组蛋白rPbPSOP7具有较强的抗原性与免疫原性,在小鼠体内可诱发显著的体液免疫应答,产生特异性抗体,为有效发挥传播阻断作用提供了充分的可能性。同时,间接免疫荧光试验证明PbPSOP7主要表达在疟原虫的合子与成熟的动合子阶段,且表达模式为分泌至细胞膜表面表达,这也恰好符合TBVs疫苗设计的最基本准则。上述研究结果为PbPSOP7在疟原虫生活史、毒力作用与其可能成为潜在的TBVs候选疫苗奠定了一定的理论与实验基础。
[1]WHO:World Malaria Report 2015
[2]Griffin J.T.,Ferguson N.M,Ghani A.C.Estimates of the changing age-burden of Plasmodium falciparum malaria disease in sub-Saharan Africa[J].Nat Commun,2014,5:3136.
[3]Vogel G.Infectious diseases.The genetics of resistant malaria[J].Science,2014,346(6215):1276-1277.
[4]Aultman K,Burkot TR,Chandre F,et al.A research agenda for malaria eradication:vector control[J].PLoS Med,2011,8 (1):e1000401.
[5]Vaughan A.M,Kappe S.H.Malaria vaccine development: persistent challenges[J].Curr Opin Immunol,2012,24(3): 324-331.
[6]Sattabongkot J,Tsuboi T,Hisaeda H,et al.Blocking of transmission to mosquitoes by antibody to Plasmodium vivax malaria vaccine candidates Pvs25 and Pvs28 despite antigenic polymorphism in field isolates[J].Am J Trop Med Hyg,2003,69(5): 536-541.
[7]Tomas AM,Margos G,Dimopoulos G,et al.P25 and P28 proteins of the malaria ookinete surface have multiple and partially redundant functions[J].EMBO J,2001,20(15):3975-3983.
[8]Tachibana M,Sato C,Otsuki H,et al.Plasmodium vivax gametocyte protein Pvs230 is a transmission-blocking vaccine candidate[J].Vaccine,2012,30(10):1807-1812.
[9]Ecker A1,Bushell ES,Tewari R,et al.Reverse genetics screen identifies six proteins important for malaria development in the mosquito[J].Mol Microbiol,2008,70(1):209-220.
[10]Zieler H.,Nawrocki J.P,Shahabuddin M.Plasmodium gallinaceum ookinetes adhere specifically to the midgut epithelium of Aedes aegypti by interaction with a carbohydrate ligand[J].J Exp Biol,1999,202(Pt 5):485-495.
[11]de Marco,A.Strategies for successful recombinant expression of disulfide bond-dependent proteins in Escherichia coli[J].Microb Cell Fact,2009,8:26.
[12]Sorensen H.P.,Mortensen K.K.Soluble expression of recombinant proteins in the cytoplasm of Escherichia coli[J].Microb Cell Fact,2005,4(1):1.
[13]Carlton JM,Adams JH,Silva JC,et al.Comparative genomics of the neglected human malaria parasite Plasmodium vivax[J].Nature,2008,455(7214):757-763.
Cloning and Expression Characteristics of Truncated Segment from Candidate Antigen PbPSOP7 Gene of a New Type Malaria Transmission-Blocking Vaccine
LI Min1,2,ZHENG Wen-qi1,4,HE Yi-wen3,WANG Lin1,KOU Xu1,CAO Ya-ming3,LUO En-jie1
(1.Teach.&Res.Div.of Pathogen Biol.Coll.of Basic Med.Sci.;2.Dept.of Endocrinol.First Affil.Hosp.of China Medical Uni.,Shenyang 110001;3.Teach.&Res.Div.of Immunol.Coll.of Basic Med.Sci.;China Med.Uni.,Shenyang 110021; 4.Lab.of Surg.Dept.,Affil.Hopt.,Inner Mongolia Med.Uni.Huhhot,Huhhot 010050)
Transmission-blocking vaccines(TBVs)could effectively block the transmission from malarial parasite into human body,it is a crux to control the epidemic of malaria,however,at present the candidate antigen is very limited,and it is very urgent to search effective candidate antigens.PSOP7(putative secreted ookinete protein 7)plays most important role in plasmodial sexual reproduction stage.Bioinformatic analysis of Plasmodium berghei antigen PSOP7 (PbPSOP7)was carried out in this study,and expressed purified truncated recombinant PbPSOP7 protein rPbPSOP7 using prokaryotic expression system,after immuned on BALB/C mice,and obtained mouse high titter poly-clonal antibody.It was proved that the polyclonal antibody could identify plasmodial antigen through Western Blot.Indirect immuno-fluorescence experiment had showed that the PbPSOP7 mainly expressed on the surfaces of zygote and ookinete.These features accorded with the design of the basic idea of TBVs,and laid a foundation for the potential of confirmation and provement of the PbPSOP7 protein possesses TBVs candidate antigen.
Q78;R37
A
1005-7021(2016)04-0041-06
10.3969/j.issn.1005-7021.2016.04.007
国家自然科学基金资助项目(81471978)
李敏女,硕士研究生。研究方向为抗病原生物感染与免疫。E-mail:nancy_li_822@163.com
*通讯作者。男,博士,教授,博士生导师。研究方向为抗病原生物感染与免疫。E-mail:enjie359@126.com
2016-01-22;
2016-02-26