中缅边境地区恶性疟原虫株裂殖子顶端膜抗原1 (PfAMA1)Domain I的基因多态性分析
2016-02-13冯永辉于晓飞曹雅明朱晓彤
冯永辉,于晓飞,曹雅明,朱晓彤*
(1.中国医科大学附属第一医院检验科,辽宁沈阳110001;2.中国医科大学附属第四医院神经内科,辽宁沈阳110032;3.中国医科大学基础医学院免疫教研室,辽宁沈阳110122)
中缅边境地区恶性疟原虫株裂殖子顶端膜抗原1 (PfAMA1)Domain I的基因多态性分析
冯永辉1,3,于晓飞2,曹雅明3,朱晓彤3*
(1.中国医科大学附属第一医院检验科,辽宁沈阳110001;2.中国医科大学附属第四医院神经内科,辽宁沈阳110032;3.中国医科大学基础医学院免疫教研室,辽宁沈阳110122)
明确中国和缅甸边境地区恶性疟原虫疫苗候选抗原PfAMA1蛋白的基因特点。收集中缅边境地区88例恶性疟原虫感染患者血样,制备血样滤纸片;试剂盒提取恶性疟原虫基因组DNA(gDNA);PCR和测序检测分析恶性疟原虫PfAMA1基因的Domain I(DI)区域的多态性。成功扩增88例恶性疟原虫分离株PfAMA1胞外段DI区域基因,与恶性疟原虫标准株3D7比较,检测出31个分离位点,18个单倍型,单倍型多样度为0.794。其中c1特别是c1L区域的基因多样性显著高于其他检测区域。同时,分子进化分析显示,DI区域及其中的c1和c1L区域在进化过程中经历阳性选择。研究发现,中缅边境地区恶性疟原虫疫苗候选抗原PfAMA1基因DI区和其中c1、c1L区域高度多态,提示上述区域作为红内期疫苗候选抗原研制靶位的可能性。
恶性疟原虫;PfAMA1;基因多态性;中缅边境
KeywordsPlasmodium falciparum;PfAMA1;genetic polymorphism;China-Myanmar border
恶性疟原虫是可感染人类的五种疟原虫中致病性最为严重的疟原虫种属,每年世界范围内有43.8万人死于恶性疟感染,其中65%为5岁以下儿童[1]。抗药原虫株和耐药蚊虫的出现,使恶性疟的防治面临严峻的挑战。安全有效的疟疾疫苗研制是防治疟疾的重要措施之一。然而,红内期原虫抗原多态性和疟原虫的免疫逃避机制阻碍了红内期疫苗的研发进程。对红内期疫苗候选抗原的基因多态性分析,是疫苗研制开发必备的前期基础。恶性疟原虫株裂殖子顶端膜抗原1(PfAMA1)是恶性疟主要的红内期疫苗候选抗原,已进入II期临床实验[2]。PfAMA1基因编码蛋白表达于裂殖子顶端复合体结构的微线体内,分泌到裂殖子表面与RON蛋白形成紧密连接复合体,在原虫侵袭宿主红细胞过程中发挥重要作用[3]。早期研究表明,PfAMA1基因的Domain I(DI)区域高度多态,在分子进化过程中经历阳性选择,为PfAMA1疫苗研制的主要靶位[4]。且DI区域中c1、c1L、c2和c3区域表达在PfAMA1蛋白表面。其中,c1L区域中197位氨基酸的突变与AMA1疫苗的特异性相关[5]。因此深入探讨PfAMA1基因多态性将为疟疾疫苗的研制提供参考。目前,尚未见关于中缅边境地区恶性疟原虫发病阻断疫苗候选抗原PfAMA1基因DI区域和其中的c1、c1L、c2和c3区域基因特点的报道。本研究通过对中缅边境地区恶性疟分离株PfAMA1基因的多态性特点和分子进化学进行分析,为我国恶性疟红内期疫苗的研制和应用提供参考。
1 材料与方法
1.1 材料
QIAamp DNA Mini Kit试剂盒(德国);QIA-quick Gel Extraction Kit试剂盒(QIAGEN,加州,美国);ABI Prism BigDyeTM cycle sequencing kit (Applied Biosystems,加州,美国)。
1.2 方法
1.2.1 样本采集和基因组DNA提取2011年4月至2013年10月间,于缅甸西北部中缅边境地区的疟疾诊所就诊的患者中采集患者指尖血制备血样干滤纸片。通过姬姆萨染色厚血膜法确认恶性疟原虫感染血样。按照QIAamp DNA Mini Kit试剂盒说明书提取恶性疟原虫基因组DNA。
1.2.2 PfAMA1基因Domain I区域的PCR扩增和测序采用PfAMA1基因Domain I(DI)区域的特异性PCR引物:Pfama1_nF(5'-GATGCTGAAGTAGCTGGAACTC-3')和Pfama1_nR(5'-CCCATAATCCGAATTTTGCATTCTG-3')扩增PfAMA1基因DI区(碱基位点(nucleotide position,nt)445~906 bp;氨基酸位点(amino acid position,aa)148~302)。PCR反应包含2 μL的10×KOD-Plus-Neo缓冲液,2 μL的2 mmol/L dNTPs,0.8 μL的25 mmol/L MgSO4,各0.5 μL的10 μmol/L引物,0.5单位的KOD-Plus-Neo DNA聚合酶(Toyobo,Osaka,Japan),1.0 μL基因组DNA模板,终体积20 μL。反应条件:94℃2 min;45个循环的94℃15 s,56℃15 s,68℃90 s;最终68℃延伸5 min。PCR产物经QIAquick Gel Extraction Kit试剂盒提取纯化。纯化的PCR产物采用Pfama1_nF和Pfama1_nR引物,ABI Prism BigDyeTM cycle sequencing kit和ABI PRISM 310基因分析仪分析测序。
1.2.3 序列比对和基因多态性分析选用实验室标准株3D7株作为参照,采用MEGA6.0软件对比分析88个中缅边境地区恶性疟原虫序列[6]。MEGA6.0软件比对分析输出的Fasta文件采用DnaSP v5.10.1软件计算分离位点(the number of segregating sites,S)、平均核苷酸差异数(the average number of nucleotide differences,k)、核苷酸多样性(nucleotide diversity,π)、单倍型(the number of haplotypes,H)和单倍型多样度(haplotype diversity,Hd)[7]。
1.2.4 分子进化分析采用DnaSP5.10.1软件分析PfAMA1的DI区域的非同义核苷酸置换率dN和同义核苷酸置换率dS比值,Fu and Li’s D*and F*检验及Tajima’s D检验值和统计学差异。当Fu and Li’s D*and F*检验Tajima’s D检验值显著大于0时,可用于推断瓶颈效应和平衡选择;当Fu and Li’s D*and F*检验Tajima’s D检验值显著小于0时,可用于推断群体规模放大和定向选择[8]。采用Plasmodium reichenowi(GenBank nos.AJ252087)为疟原虫种间参考株[9],通过Mc-Donald-Kreitman(MK)检测,考查PfAMA1的DI区域在种内和种间的非同义与同义突变的比值。通过Fisher精准检验来验证零假设,当检验值显著大于0时,可用于推断瓶颈效应和平衡选择;当检验值显著小于0时,可用于推断群体规模放大和定向选择[10]。
2 结果与分析
2.1 PCR扩增结果
本研究成功扩增了88例恶性疟原虫分离株PfAMA1基因的Domain I(DI)区域(nt:445~906 bp;149~302 aa)461 bp长度片段,包含c1(187~207 aa)、c1L(197~207 aa)、c2(242~245 aa和282~286 aa)和c3(172~175 aa),见图1。
2.2 基因多态性分析
88例样本的PfAMA1基因DI区域和其中的c1、c1L、c2和c3区域核苷酸多样性(π)分别为0.020、0.037、0.090、0.050/0.084和0.056;平均核苷酸差异数(k)在各检测段分别为9.046、4.938、3.251、0.600/1.265和0.675。88例恶性疟原虫分离株PfAMA1基因DI分属18个单倍型(H),单倍型多样度(Hd)为0.794,见表1。Sliding window plot分析结果显示PfAMA1基因DI的c1区,特别是c1L的基因多态性明显高于c2、c3和c4区,见图2A。同时,c1特别是c1L区域氨基酸突变水平明显高于其他检测区域,见图2B。
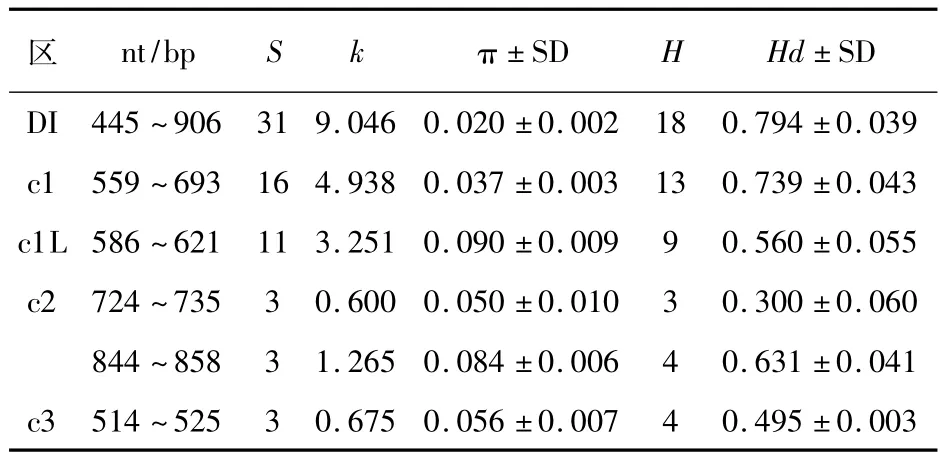
表1 中缅边境地区88个恶性疟原虫分离株PfAMA1基因多态性分析Table 1Estimation of nucleotide diversity of PfAMA1 in 88 P.falciparum isolates from the China-Myanmar border area
2.3 分子进化分析
2.3.1 dN/dS比值分析DnaSP v5.10.1软件分析结果显示PfAMA1基因DI区和其中的c1和c1L区同义核苷酸置换率dS分别为0.001、0.005和0.022,非同义核苷酸置换率dN分别为0.003、0.045和0.111,dN/dS分别为18.299、9.125和4.982。同时,对PfAMA1基因DI区和其中的c1和c1L区的分析结果显示,上述区域的非同义置换显著高于同义置换,见表2。

图1 P.falciparum和P.reichenowi AMA1蛋白序列比对Fig.1Alignment of P.falciparum and P.reichenowi AMA1 protein sequences各矩形框标记分别为c3、c1和c2区域;黄色背景所示为c1L区域;红色加粗字体间所示区域为Domain I(DI);浅蓝色字体标记为中缅边境地区PfAMA1基因氨基酸多态性位点Black Boxes indicate c3,c1 and c2,respectively;The c1L region was highlighted by yellow color;Domain I(DI)was shown by red bold letters;The polymorphic sites of PfAMA1 from China-Myanmar border area were indicating by light blue color

图2 中缅边境样本PfAMA1基因DI区基因多态性的sliding window plot和各位点氨基酸突变水平分析Fig.2Sliding window plot of nucleotide diversity and amino acid polymorphism analysis of PfAMA1 ectodomain in China-Myanmar border isolatesA:PfAMA1基因DI区基因多态性的sliding window plot图;B:PfAMA1基因DI区各位点氨基酸突变数目统计图,红色区域所示为c1区A:Sliding window plot of nucleotide diversity of PfAMA1 DI:B:The amino acid polymorphism analysis of PfAMA1,The c1 region was indicates by red color
2.3.2 Fu and Li’s D*and F*检验对中缅边境地区恶性疟原虫分离株PfAMA1的DI区和其中的c1和c1L区域的Fu and Li’s D*and F*检测结果分别为1.941和2.104、1.618和1.915、1.426和1.644,见表2。其中,PfAMA1的DI区和其c1区域的Fu and Li’s D*and F*中性检测结果拒绝零假设,因此,中缅边境地区恶性疟原虫分离株PfAMA1基因的DI和其c1区在进化过程中偏离中性进化模型,经历显著的阳性选择作用(P<0.02和P<0.001),见图3和表2。
2.3.3 McDonald-Kreitman(MK)检验基于种内多态性和种间分歧度之间数据比较的MK检验显示,PfAMA1基因DI区的Fisher检测结果拒绝零假设,在进化过程中经历显著的阳性选择作用(P<0.02),见表2。

表2 中缅边境地区88个恶性疟原虫分离株PfAMA1基因分子进化分析Table 2Estimation of summary statistics of PfAMA1 in 88 P.falciparum isolates from the China-Myanmar border area
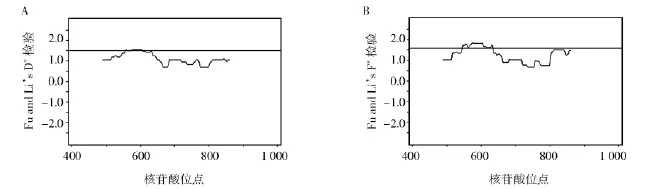
图3 中缅边境样本PfAMA1基因DI区Fu and Li’s D*and F*检验sliding window plot图Fig.3Sliding window plots of Fu and Li’s D*and F*testA:Fu and Li’s D*检验;B:Fu and Li’s F*检验,直线以上区域所示P<0.05A:Fu and Li’sD*test:B:Fu and Li’s F*test,Regions above lines shows P<0.05
3 讨论
2014年中国疟疾病例为3 078例,境外输入性疟疾占98.1%,其中恶性疟疾占61.1%[11]。由于边境地区的人口流动,输入性疟疾疫情仍不容忽视。因此,本研究旨在通过对中缅边境地区恶性疟原虫疫苗候选抗原PfAMA1基因的DI区域,和其内部蛋白表面表位区域的基因多态性和分子进化模式分析,为中缅边境地区恶性疟原虫的防控提供理论依据。
近年研究发现,PfAMA1基因的DI和其内部表达于PfAMA1蛋白表面的c1、c1L、c2和c3区域与疟原虫抗原逃逸和感染后对宿主的致病性高度相关[12]。基因多态性分析显示,PfAMA1基因的DI区域的31个分离位点中51.6%(16/31)定位于c1区域,其中68.8%(11/16)的分离位点集中于c1L区域。c1和c1L区域的平均核苷酸差异数(k)和核苷酸多样性(π)显著高于c2和c3区域。同时,DI区域中c1和c1L的单倍型数目亦明显高于c2和c3区域,提示PfAMA1基因DI区域中c1和c1L区域高度多态,提示在进化过程中受宿主免疫系统选择作用。采用PfAMA1单克隆抗体进行的发病阻断疫苗研究显示,PfAMA1蛋白的c1L和c1区域中197、200、201、204和225位点的氨基酸突变可阻断单克隆抗体与PfAMA1蛋白的结合,从而抑制发病阻断疫苗效果[13]。本研究发现,中缅边境地区PfAMA1基因的c1和c1L区域在基因和蛋白水平高度多态,同时在197、200、201和225位点存在氨基酸多态性,提示上述区域在制备发病阻断疫苗过程中可能影响疫苗免疫效果。
本研究选取DI区域中多态性水平较高的c1和c1L区域进行分子进化分析。DI区域和其中的c1和c1L区域的dN/dS比值均显著大于1(P<0.001),提示上述区域在进化过程中经历阳性选择。同时,Fu and Li’s D*and F*检验结果显示,DI区域和其中的c1和c1L区域的D*和F*检验值大于1,且DI和c1区域D*和F*值显著大于1,提示DI和其c1区域在进化过程中经历阳性选择。采用Plasmodium reicheinow原虫株作为种间对照进行的MK检验同样证明DI区域在进化过程中经历阳性选择。上述结果提示PfAMA1基因的DI,特别是DI内的c1和c1L区域为宿主保护性免疫系统作用的靶位。
本研究首次检测了中缅边境恶性疟原虫流行地区PfAMA1基因DI区域,和其中位于PfAMA1蛋白表面的c1、c1L、c2和c3区域的基因多态性特点,并对DI区和其中的c1和c1L区域进行了分子进化分析,结果显示,上述区域高度多态,且DI区和其内部c1和c1L区域在进化过程中经历阳性选择。本研究为我国边境地区开发AMA1恶性疟原虫疫苗的研究和应用提供参考。
[1]World Health Organization.World Malaria Report:2015[R].World Health Organization,2015.
[2]Murungi LM,Sonden K,Llewellyn D,et al.Targets and Mechanisms Associated with Protection from Severe Plasmodium falciparum Malaria in Kenyan Children[J].Infection and immunity,2016,84(4):950-963.
[3]Delgadillo RF,Parker ML,Lebrun M,et al.Stability of the Plasmodium falciparum AMA1-RON2 Complex Is Governed by the Domain II(DII)Loop[J].PloS one,2016,11(1): e0144764.
[4]Addai-Mensah O,Seidel M,Amidu N,et al.Acquired immune responses to three malaria vaccine candidates and their relationship to invasion inhibition in two populations naturally exposed to malaria[J].Malaria journal,2016,15(1):65.
[5]Ouattara A,Takala-Harrison S,Thera MA,et al.Molecular basis of allele-specific efficacy of a blood-stage malaria vaccine: vaccine development implications[J].The Journal of infectious diseases,2013,207(3):511-519.
[6]Tamura K,Stecher G,Peterson D,et al.MEGA6:Molecular Evolutionary Genetics Analysis version 6.0[J].Molecular biology and evolution,2013,30(12):2725-2729.
[7]Librado P,Rozas J.DnaSP v5:a software for comprehensive analysis of DNA polymorphism data[J].Bioinformatics,2009,25(11):1451-1452.
[8]Tajima F.Statistical method for testing the neutral mutation hypothesis by DNA polymorphism[J].Genetics,1989,123 (3):585-595.
[9]Kocken CH,Narum DL,Massougbodji A,et al.Molecular characterisation of Plasmodium reichenowi apical membrane antigen-1(AMA-1),comparison with P.falciparum AMA-1,and antibody-mediated inhibition of red cell invasion[J].Molecular and biochemical parasitology,2000,109(2):147-156.
[10]McDonald JH,Kreitman M.Adaptive protein evolution at the Adh locus in Drosophila[J].Nature,1991,351(6328):652-654.
[11]张丽,周水森,丰俊,等.2014年全国疟疾疫情分析[J].中国寄生虫学与寄生虫病杂志,2015,33(5):319-326.
[12]Takala SL,Coulibaly D,Thera MA,et al.Extreme polymorphism in a vaccine antigen and risk of clinical malaria:implications for vaccine development[J].Science translational medicine,2009,1(2):2ra5.
[13]Coley AM,Gupta A,Murphy VJ,et al.Structure of the malaria antigen AMA1 in complex with a growth-inhibitory antibody[J].PLoS pathogens,2007,3(9):1308-1319.
Genetic Polymorphism Analysis of Plasmodium falciparum Apical Membrane Antigen I(PfAMA1)Domain I in China-Myanmar Border Area
FENG Yong-hui1,3,YU Xiao-fei2,CAO Ya-ming3,ZHU Xiao-tong3
(1.Dept.of Lab.Med.,1st Hosp.,China Med.Uni.,Shenyang 110001;2.Dept.of Neurol.,4th Affil.Hosp.,China Med.Uni.,Shenyang 110032;3.Teach&Res.Div.Immunol.,Coll.of Basic Med.Sci.,China Med.Uni.,Shenyang 110122)
In order to confirm the genetic features of Plasmodium falciparum vaccine candidates PfAMA1 protein in China-Myanmar border area,88 blood samples from patients infected by P.falciparum in the border area were collected,and prepared filter paper sheets of blood samples,and extracted genomic DNA of P.falciparum with reagent kid; as well as PCR and sequence determination to analyse the polymorphism of Domain I(DI)of P.falciparum’s PfAMA1 gene.The DNA sequence of PfAMA1 gene of extracellular Domain I(DI)was amplified successfully by PCR and compared with standard 3D7 strain of P.falciparum and isolated 31 segregation sites,18 haploid types,with haploid diversity of 0.794.Among them the diversity in c1 especially c1L domains significantly higher than the other tested domains.At the same time,molecular evolution analyses showed that during the evolution process DI domain and of its c1 and c1L domains had experienced positive choice.The study has found that the candidate vaccine antigen PfAMA1 gene of DI domain and its c1 and c1L domains of P.falciparum in China-Myanmar border has high polymorphism,suggested that the above mentioned areas have the possibility to develop target of endoerythrocytic stage vaccine candidate antigen.
Q78;R382.3+1
A
1005-7021(2016)04-0036-05
10.3969/j.issn.1005-7021.2016.04.006
国家自然科学青年基金项目(81301455)
冯永辉男,讲师,博士。主要从事抗感染免疫研究。E-mail:Yonghuif@gmail.com
*通讯作者。女,副教授,博士,硕士生导师。主要从事抗感染免疫研究。E-mail:zhu.xt918@gmail.com
2016-02-23;
2016-04-04