肺炎支原体经ROS激活NLRP3炎性体诱导RAW264.7细胞分泌IL-1β*
2016-01-31张云凌张树明许庆瑞王伟明
张 涵, 马 晶, 张云凌, 张树明, 许庆瑞, 王伟明
(黑龙江省中医药科学院,黑龙江 哈尔滨 150036)
肺炎支原体经ROS激活NLRP3炎性体诱导RAW264.7细胞分泌IL-1β*
张涵,马晶,张云凌,张树明,许庆瑞,王伟明△
(黑龙江省中医药科学院,黑龙江 哈尔滨 150036)
[摘要]目的: 观察肺炎支原体(Mycoplasma pneunoniae,Mp)促进NLRP3炎性体的活化及下游促炎性细胞因子白细胞介素-1β(IL-1β)的表达是否与活性氧簇(ROS)有关。方法: 预先用5 mmol/L ROS清除剂N-乙酰半胱氨酸(NAC)预处理RAW264.7细胞30 min,用10 MOI Mp分别感染RAW264.7细胞4、8、16和24 h。流式细胞术检测细胞内ROS水平;real-time PCR法检测细胞NLRP3、ASC和caspase-1 mRNA的表达;Western blot 法检测NLRP3、ASC和caspase-1 p20的蛋白水平;ELISA法检测细胞上清液IL-1β的分泌水平。结果: 与正常组比较,感染后4、8、16和24 h模型组ROS生成显著增加(P< 0.01);感染后8、16和24 h模型组NLRP3、ASC和caspase-1 mRNA的表达显著增加 (P<0.01),感染后16和24 h NLRP3、ASC和caspase-1 p20的蛋白水平上调(P<0.01),感染后24 h 细胞上清液IL-1β含量显著增加(P< 0.01);与模型组比较,NAC组在上述相应时点ROS生成降低,NLRP3、ASC和caspase-1 mRNA的表达下调,蛋白水平下降,细胞上清液IL-1β的含量减少。结论: Mp可能通过刺激RAW264.7细胞生成ROS而激活NLRP3炎性体。
[关键词]肺炎支原体; 活性氧簇; NLRP3炎性体; 白细胞介素1β
肺炎支原体 (Mycoplasmapneunoniae,Mp) 是一种无细胞壁结构的原核生物,不但能引起咽炎、支气管炎、间质性肺炎等呼吸道感染,还可引起肺外多器官病变,而且与哮喘等疾病关系密切[1-2]。其发病机制可能与Mp侵入、直接吸附及其诱发的免疫异常有关,其中免疫异常越来越受到学者的关注[3-4]。NLRP3炎性小体与机体的固有免疫反应密切相关,多种病原相关分子模式及危险相关分子模式可激活炎性体,引起IL-1β等促炎细胞因子的生成,并导致下游炎性细胞因子的释放[5-7]。前期实验研究表明,Mp感染早期可激活NLRP3炎性体相关基因及上调IL-1β的表达[8]。本文旨在探讨Mp感染RAW264.7细胞不同时点NLRP3炎性体相关基因、蛋白、IL-1β的变化并探讨此过程是否与活性氧簇(reactive oxygen species,ROS)有关。
材料和方法
1实验材料含CARD结构
1.1细胞株RAW264.7细胞株,购自中山大学;肺炎支原体标准菌株(ATCC-15531) 购自ATCC。
1.2试剂与仪器PPLO培养基(Difico);特级胎牛血清(杭州四季青);DMEM培养液(Gibco); 燕山鲜酵母(英联马利北京食品销售有限公司);N-乙酰半胱氨酸(N-acetylcysteine,NAC;碧云天生物技术研究所);RNAiso Plus、PrimeScript RT reagent Kit和SYBR Premix Ex Taq均购自TaKaRa; NLRP3、含CARD结构凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)、caspase-1和HPRT引物由TaRaKa合成;NLRP3抗体、caspase-1 p20抗体和ASC抗体购自Abcam;IL-1β ELISA试剂盒(R&D)。SW-CJ-1F型洁净工作台(江苏苏净集团有限公司);1300 SERIES A2二级生物安全柜、3110 Series II水套式CO2培养箱、NANODROP 2000 核酸蛋白分析仪(Thermo);BSP-250 生化培养箱(上海博讯实业有限公司医疗设备厂);CFX96荧光定量PCR仪和凝胶成像仪(Bio-Rad);Mastercycler PRO 温度梯度 PCR 仪(Eppendorf);GENios pro酶联免疫检测仪(TACAN);Th1-200型倒置显微镜(Olympus);Accuri C6流式细胞仪(BD)。
2方法
2.1细胞培养将RAW264.7细胞用含10% 胎牛血清的DEME培养液(内含100 mg/L青霉素、100 mg/L链霉素),置于37 ℃、5% CO2培养箱中培养,待细胞处于对数生长期时,收获细胞。
2.2Mp培养将Mp标准菌株冻干粉用PPLO完全培养液(含胎牛血清、酵母提取物、酚红、青霉素等),充分混匀,放入37 ℃生化培养箱中培养,每日观察其颜色变化,待培养液由红变橙黄时传代。将处于对数生长期的Mp,CCU定量,常规冻存,待用时用含10% 胎牛血清的DMEM培养液调至所需浓度。
2.3不同感染复数(multiplicity of infection,MOI)的Mp对细胞活力的影响 取对数生长期细胞按每孔1×104个细胞接种于96孔培养板,置37 ℃、5% CO2培养箱中进行培养。24 h后弃去培养液,MP感染组分别按照MOI (Mp数∶细胞数) 100∶1、80∶1、40∶1、20∶1、10∶1加入Mp刺激;正常组加入等容量含10%胎牛血清的DMEM培养液。每组3复孔,置37 ℃、5% CO2培养箱中继续培养24 h。每孔加入50 μL MTT,37 ℃孵育4 h。吸弃上清液,每孔加入150 μL DMSO振荡10 min,用酶标仪于波长490 nm处检测各孔吸光度 (A) 值。
2.4分组及方法实验分3组,分别为正常组、Mp感染组、NAC组。取对数生长期的RAW264.7细胞接种于6孔细胞培养板,每孔1×105个。孵育24 h后,小心吸弃各培养孔中的培养液,正常组加入含10% 胎牛血清的DMEM培养液,每孔1 mL;Mp感染组:加入1×109CFU/L的Mp菌液,每孔1 mL;NAC组:加入1×109CFU/L的Mp菌液前30 min,加入5 mmol/L NAC孵育30 min。每组3复孔,分别置于37 ℃、5% CO2培养箱中培养4、8、16、24 h后,收集细胞或者上清液进行相关指标的检测。
2.5流式细胞仪检测细胞内ROS表达收集细胞,温PBS洗1遍,加入适量的含10 μmoL/L的DCFH的无血清培养基液,37 ℃避光温育20 min,每隔3~5 min颠倒混匀1次,使探针和细胞充分接触,离心收集细胞,用无血清细胞培养液洗涤细胞3次,上流式细胞仪检测。
2.6Real-time PCR法检测NLRP3炎性体相关基因表达小心吸弃每孔的培养液,加入1 mL RNAiso Plus,吹打数次,充分裂解细胞,按RNAiso说明书提取各组细胞总RNA,A260/A280均在1.8~2.0之间。按试剂说明书进行反转录及PCR 扩增。引物序列采用Primer Premier 5.0 软件设计,NLRP3上游引物序列为5’-ACTGAAGCACCTGCTCTGCAAC-3’,下游引物序列为5’-AACCAATGCGAGATCCTGACAAC-3’,扩增产物为88 bp;ASC上游引物序列为5’-GCTGAGCAGCTGCAAACGA-3’,下游引物序列为5’-ACTTCTGTGACCCTGGCAATGA-3’,扩增产物为137 bp;caspase-1上游引物序列为5’-TGCCTGGTCTTGTGACTTGGA-3’,下游引物序列为5’-CCTATCAGCAGTGGGCATCTGTA-3’,扩增产物为94 bp;内参照HPRT上游引物序列为5’-TTGTTGTTGGATATGCCCTTGACTA-3’,下游序列为5’-AGGCAGATGGCCACAGGACTA-3’,扩增产物189 bp。PCR 扩增条件:95 ℃ 15 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。采用2-ΔΔCt法行PCR 产物相对定量分析。
2.7Western blot法检测NLRP3炎性体相关蛋白的表达提取培养细胞的总蛋白,BCA法测定蛋白浓度。分别取各孔样品蛋白50 μg,经过变性、电泳、半干转或湿转,转移至PVDF膜,在含5% BSA的TBS缓冲液中封闭1 h,分别用相应稀释浓度的 I 抗孵育,4 ℃过夜,TBST漂洗膜3次,用相应的 II 抗孵育2 h,TBST漂洗膜3次,ECL法显色蛋白条带。
2.8ELISA法检测细胞培养上清液IL-1β的水平参照试剂盒说明书操作。
3统计学处理
采用SPSS 11.0统计软件处理,计量资料以均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1不同MOI的Mp对RAW264.7细胞活力的影响
不同MOI的Mp感染RAW264.7细胞24 h,对其细胞活力均有不同程度抑制作用,其中100 MOI、80 MOI、40 MOI和20 MOI的Mp均可明显抑制其细胞活力(P<0.05)。见图1。
2Mp感染RAW264.7细胞ROS表达的动态变化
Mp刺激RAW264.7细胞4、8、16、24 h,ROS生成的水平明显上升,与正常组比较,差异显著(P<0.01)。上述时点,NAC可显著下调MP感染引起的ROS表达(P<0.01),见图2。
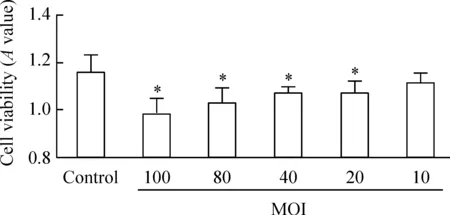
Figure 1.MTT assay for testing cell viability of RAW264.7 cells infected with different MOI of Mp. Mean±SD.n=3.*P<0.05vscontrol group.
图1不同MOI的Mp对RAW264.7细胞活力的影响
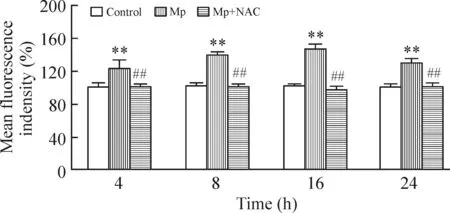
Figure 2.The expression of ROS in the RAW264.7 cells infected with Mp. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsMp group.
图2Mp感染RAW264.7细胞不同时点ROS生成的变化
3Mp感染RAW264.7细胞后NLRP3、ASC和caspase-1 mRNA表达的动态变化
与正常组比较,Mp刺激RAW264.7细胞8、16、24 h,均可显著上调NLRP3、ASC和caspase-1的 mRNA表达(P<0.05)。上述时点,NAC可下调MP感染引起的NLRP3、ASC和caspase-1 mRNA的表达(P<0.05),见图3。
Figure 3.The mRNA expression of NLRP3, ASC and caspase-1 in the RAW264.7 cells infected with Mp. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsMp group.
图3Mp感染RAW264.7细胞不同时点NLRP3、ASC和caspase-1 mRNA表达的变化
4Mp感染RAW264.7细胞后NLRP3、ASC和caspase-1 p20蛋白水平的动态变化
与正常组比较, Mp刺激RAW264.7细胞16和24 h,均可显著增加NLRP3、ASC和caspase-1 p20的蛋白水平(P<0.05)。上述时点,NAC可减低NLRP3、ASC和caspase-1 p20低蛋白水平,与模型组比较,差异显著(P<0.05),见图4。
Figure 4.The protein levels of NLRP3, ASC and caspase-1 p20 in the RAW264.7 cells infected with Mp. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsMp group.
图4Mp感染RAW264.7细胞后不同时点NLRP3、ASC和caspase-1 p20 蛋白水平的变化
5Mp感染RAW264.7细胞后IL-1β分泌的动态变化
Mp感染RAW264.7细胞后4、8和16 h细胞培养上清液IL-1β分泌稍有上升,但与正常组比较,差异无统计学意义。Mp感染RAW264.7细胞24 h,可促进IL-1β的分泌,与正常组比较,差异显著(P<0.01)。与模型组比较,NAC可下调Mp感染RAW264.7细胞24 h的IL-1β表达(P<0.05),见图5。
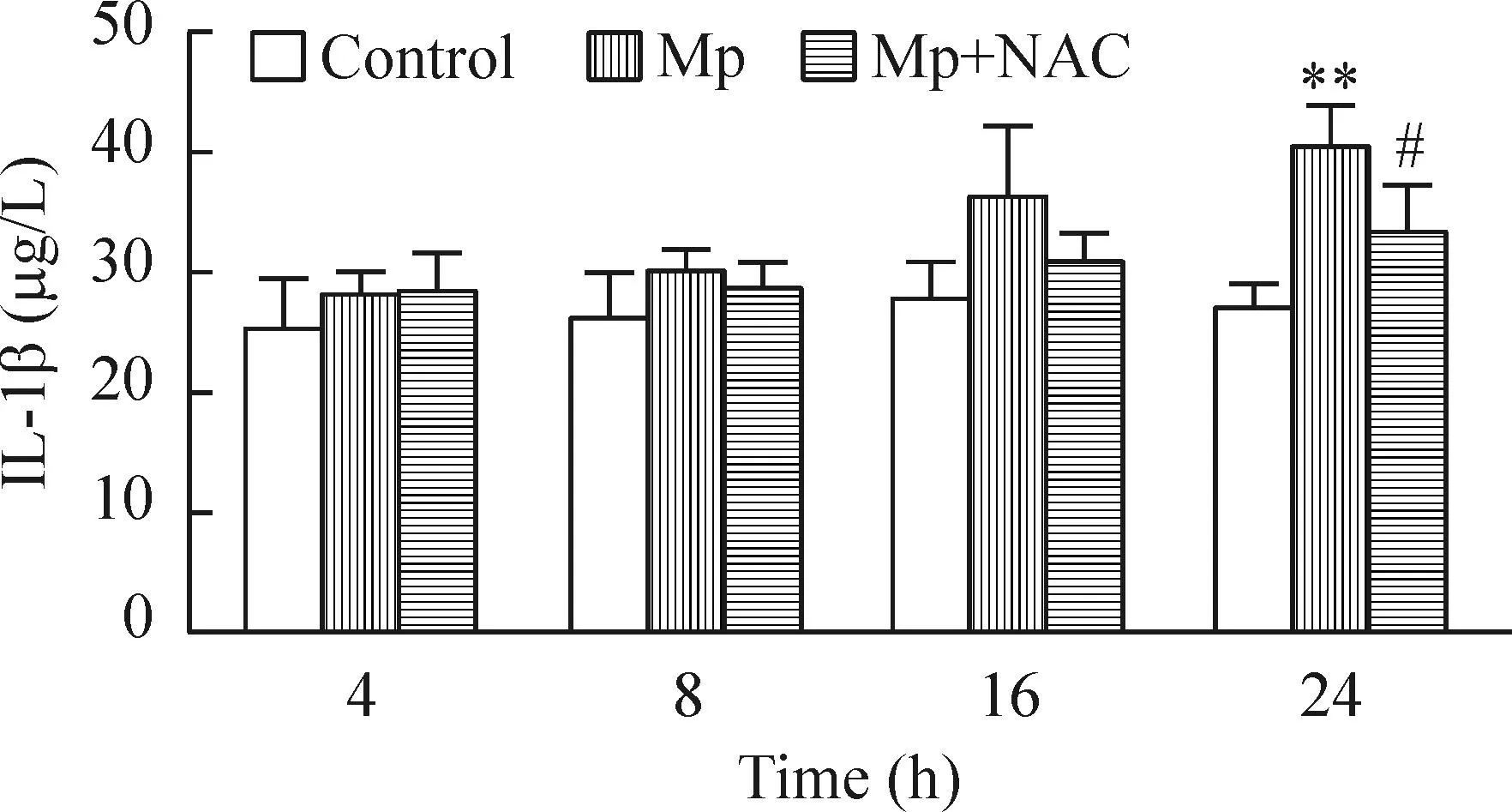
Figure 5.The concentration of IL-1β in the supernatant of cultured RAW264.7 cells infected with Mp. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05vsMp group.
图5Mp感染RAW264.7细胞后不同时点RAW264.7细胞培养上清液IL-1β含量的变化
讨论
NLRP3炎性体是由NLRP3、接头蛋白(ASC)及caspase-1前体组成的一类大分子多蛋白复合体,属于NOD样受体家族成员,是机体胞浆中重要的模式识别受体。NLRP3可识别机体自身危险信号及细菌等外源性危险信号,当其被激活后,通过接头蛋白ASC招募caspase-1前体,使其水解,产生 p20和p10大小亚基,形成p20/p10异二聚体,再形成4聚体,即有活性的caspase-1,进而对IL-1β、IL-18等前体进行剪切,促进有生物活性的IL-1β和IL-18释放至细胞外,参与炎症反应[5, 9]。金黄色葡萄球菌、幽门螺杆菌、呼吸道合胞病毒等多种病原微生物均可通过直接或者间接途径激活NLRP3炎性体[10-12]。其激活机制尚不完全明确,目前有半通道模型、溶酶体破坏模型及ROS模型等3种假说[13]。
Mp为一类无细胞壁结构,大小介于细菌和病毒之间的原核微生物,是儿童及青少年时期社区获得性肺炎的最常见病原体,可引起间质性肺炎及细支气管炎[4, 14]。研究表明,肺炎支原体肺炎与机体免疫异常有关,肺炎支原体感染机体时,能否激活NLRP3炎性体?激活途径如何,鲜有报道。
我们前期实验研究发现,Mp感染RAW264.7细胞早期,不同MOI的Mp可激活NLRP3炎性体相关基因表达,其100 MOI的Mp可促进IL-1β的分泌[8]。为了进一步探讨Mp的感染对NLRP3炎性体及IL-1β表达的影响及可能机制,本实验在前期研究的基础上,选用小鼠巨噬细胞RAW264.7为模型,首先考察了不同MOI的Mp与RAW264.7细胞共培养24 h对其细胞活力的影响,以选择合适MOI的Mp复制模型。实验结果表明:10 MOI的Mp与此细胞共同孵育24 h,对其细胞活力无明显影响。在此基础上,本研究探讨了10 MOI的 Mp感染RAW264.7细胞4、8、16和24 h 4个时点NLRP3炎性体相关基因及蛋白以及IL-1β的动态变化,并用ROS抑制剂NAC为干预因素,以观察ROS是否参与了此过程。实验结果表明,Mp感染RAW264.7细胞4 h,ROS生成增加,感染8 h时,NLRP3、ASC和caspase-1 mRNA表达上调;感染16 h NLRP3、ASC及胞浆内caspase-1的活化形式caspase-1 p20蛋白表达上调,感染24 h时,IL-1β表达上调,即NLRP3炎性体可能参与了Mp的炎症反应,且Mp感染RAW264.7细胞后NLRP3炎性体的上游和下游因子变化的时点不相同。ROS的抑制剂NAC作用Mp感染的RAW264.7细胞24 h后,细胞内ROS水平下降,NLRP3炎性体相关基因、蛋白及IL-1β表达均下调,即ROS可能参与了Mp激活NLRP3炎性体的过程,此激活过程是ROS单独参与还是与其它因素有关,有待于进一步在动物模型中加以研究和验证。本研究为肺炎支原体肺炎的发病机制研究和药物治疗提供了新的思路。
(致谢:感谢广州中医药大学脾胃研究所及中医内科学国家重点学科实验室在仪器使用中给予的帮助。)
[参考文献]
[1]Yimenicioglu S, Yakut A, Ekici A, et al.Mycoplasmapneumoniaeinfection with neurologic complications[J]. Iran J Pediatr, 2014, 24(5):647-651.
[2]Guillet E, Mas C, Bauvin I, et al. Extrarespiratory manifestations ofMycoplasmapneumoniae: a case report[J]. Arch Pediatr, 2014, 21(4):381-383.
[3]Kurai D, Nakagaki K, Wada H, et al.Mycoplasmapneumoniaeextract induces an IL-17-associated inflammatory reaction in murine lung: implication for mycoplasmal pneumonia[J]. Inflammation, 2013, 36(2):285-293.
[4]Kurata S, Osaki T, Yonezawa H, et al. Role of IL-17A and IL-10 in the antigen induced inflammation model byMycoplasmapneumoniae[J]. BMC Microbiol, 2014, 14:156.
[5]Wang X, Jiang W, Yan Y, et al. RNA viruses promote activation of the NLRP3 inflammasome through a RIP1-RIP3-DRP1 signaling pathway[J]. Nat Immunol, 2014, 15(12):1126-1133.
[6]Peng K, Liu L, Wei D, et al. P2X7R is involved in the progression of atherosclerosis by promoting NLRP3 inflammasome activation[J]. Int J Mol Med, 2015, 35(5):1179-1188.
[7]Zhuang Y, Yasinta M, Hu C, et al. Mitochondrial dysfunction confers albumin-induced NLRP3 inflammasome activation and renal tubular injury[J]. Am J Physiol Renal Physiol, 2015, 308(8):F857-F866.
[8]张涵,马晶,张云凌,等. 肺炎支原体感染RAW264.7细胞NLRP3炎性体及下游分子的表达[J]. 中国病原生物学杂志, 2014, 9(6):496-499.
[9]Rapsinski GJ, Wynosky-Dolfi MA, Oppong GO, et al. Toll-like receptor 2 and NLRP3 cooperate to recognize a functional bacterial amyloid, curli[J]. Infect Immun, 2015, 83(2):693-701.
[11]Kim DJ, Park JH, Franchi L, et al. The Cag pathogenicity island and interaction between TLR2/NOD2 and NLRP3 regulate IL-1β production in Helicobacter pylori infected dendritic cells[J]. Eur J Immunol, 2013, 43(10):2650-2658.
[12]Thomas PG, Dash P, Aldridge JR Jr, et al. The intracellular sensor NLRP3 mediates key innate and healing responses to influenza A virus via the regulation of caspase-1[J]. Immunity, 2009, 30(4):566-575.
[13]雷国伟,毛立明,李华,等. 炎症小体对抗微生物感染中的作用[J]. 中国细胞生物学学报, 2011, 33(12):1301-1315.
[14]刘晓宇,李晓梅,宋建平. 232例小儿肺炎支原体肺炎胸片结果临床分析[J]. 中国妇幼保健杂志, 2008, 23(31):4424.
(责任编辑: 陈妙玲, 余小慧)

*[基金项目]广西高校科学技术研究项目(No.KY2015LX280);桂林医学院高层次人才科研启动基金(No.KY2012087)
Mycoplasmapneumoniaeinduces IL-1β production through activating NLRP3 inflammasome by ROS in RAW264.7 cellsZHANG Han, MA Jing, ZHANG Yun-ling, ZHANG Shu-ming, XU Qing-rui, WANG Wei-ming
(HeilongjiangProvincialAcademyofSciencesofTCM,Haerbin150036,China.E-mail:wmzyyjy@163.com)
[ABSTRACT]AIM: To investigate whether Mycoplasma pneumoniae (Mp)-induced interleukin-1β (IL-1β) production in RAW264.7 cells is through the activation of NLRP3 inflammasome via reactive oxygen species (ROS). ME-THODS: RAW264.7 cells were randomly divided into 3 groups. In normal group, RAW264.7 cells were treated without Mp. In model group, RAW264.7 cells were treated with 1∶10 multiplicity of infection (MOI) of Mp. In NAC group, RAW264.7 cells were pretreated with N- acetylcysteine (NAC) at a concentration of 5 mmol/L for 30 min before infection with Mp. The RAW264.7cells were infected with Mp (1∶10 MOI) for 4, 8, 16 and 24 h in model group and NAC group, respectively. The intracellular ROS level was analyzed by flow cytometry. The mRNA expressions of NLRP3, ASC and caspase-1 were detected by real-time PCR. The protein levels of NLRP3, ASC and caspase-1 p20 were determined by Western blot. The levels of pro-inflammatory cytokine IL-1β in the supernatant were measured by ELISA. RESULTS: Compared with normal group, the production of ROS were significantly increased at 4, 8, 16 and 24 h after infection, the mRNA expression of NLRP3, ASC and caspase-1 were increased at 8, 16 and 24 h after infection, the protein levels of NLRP3, ASC and caspase-1 p20 were increased at 16 and 24 h after infection, and the releases of IL-1β were increased at 24 h after infection in model group (P<0.01). Compared with the model group, the level of ROS in NAC group decreased, so as the expression of NLRP3, ASC and caspase-1 at mRNA and protein levels and the releases of IL-1β in the supernatant at the corresponding time points. CONCLUSION: Mp may stimulate the ROS production to activate NLRP3 inflammasome in RAW264.7 cells.
[KEY WORDS]Mycoplasma pneumoniae; Reactive oxygen species; NLRP3 inflammasome; Interleukin-1β
通讯作者△Tel: 0773-5895291; E-mail: 31910753@qq.com
[收稿日期]2015- 05- 21[修回日期] 2015- 09- 14
[文章编号]1000- 4718(2015)12- 2249- 05
doi:10.3969/j.issn.1000- 4718.2015.12.022
[中图分类号]363.2
[文献标志码]A
