黄岑苷对宫颈癌细胞株HeLa的放射增敏作用*
2016-01-31惠双
惠 双
(南阳市中心医院肿瘤内科,河南 南阳 473009)
黄岑苷对宫颈癌细胞株HeLa的放射增敏作用*
惠双△
(南阳市中心医院肿瘤内科,河南 南阳 473009)
[摘要]目的: 探讨黄岑苷对宫颈癌细胞株HeLa的放射增敏作用及机制。方法: MTT法检测不同浓度黄岑苷对HeLa细胞的活力抑制能力,并计算IC50筛选实验药物浓度;克隆形成实验检测放射组与联合组在不同照射剂量下细胞的放射增敏作用;流式细胞术检测单药组、放射组与联合组的细胞周期变化;Western blot检测不同组细胞中Akt、p-Akt、Bad和p-Bad的蛋白水平。结果: 黄岑苷呈浓度依赖性抑制HeLa细胞的活力,IC50为43.65 mg/L,采用20% IC50浓度8 mg/L进行放射增敏实验。克隆形成实验结果显示8 mg/L黄岑苷联合放射治疗可使生存曲线左移,D0、Dq值显著小于放射组(P<0.05)。流式细胞仪检测结果显示黄岑苷阻滞HeLa细胞于G2/M期。联合组细胞中p-Akt和p-Bad的蛋白水平均显著高于其它各组(P<0.05)。结论: 黄岑苷对HeLa细胞具有放射增敏作用,其机制可能与其阻滞细胞于G2/M期和活化PI3K/Akt信号通路有关。
[关键词]黄岑苷; HeLa细胞; 放射增敏; PI3K/Akt信号通路
宫颈癌是由正常宫颈上皮内瘤变,进而逐渐发展为浸润性宫颈癌,其发生是一个多因素、多步骤的过程[1]。宫颈癌在全球发病率居于女性恶性肿瘤中第2位,仅次于乳腺癌,大多数患者来自发展中国家[2]。治疗早期以手术为主,处于中晚期的患者常以同步放化疗为主[3]。临床上局部肿瘤过大或术后发现具有高危因素的患者优先的方案是进行放射治疗。由于宫颈癌细胞对中低剂量的放射性治疗的敏感性较低,因此,要获得良好的治疗效果需要提高宫颈癌细胞对放射的敏感性[4]。近年来中药的放射增敏作用日益受到关注,已有学者研究发现某些中药单体,如青蒿琥酯、三氧化二砷、银杏叶多糖等,对宫颈癌细胞具有放射增敏作用[5]。本实验探究黄岑苷对宫颈癌细胞株HeLa的放射增敏作用,并对其相关机制进行初步研究。
材料和方法
1材料
黄岑苷(baicalin)纯度95.0%,购自Sigma;宫颈癌HeLa细胞株购自北京裕恒丰科技有限公司;RPMI-1640和胎牛血清购自Gibco;Akt和p-Akt抗体购于CST;Bad、p-Bad和β-actin抗体购于Santa Cruz;细胞周期试剂盒由上海碧云天生物科技有限公司提供;其它试剂均为国产分析纯。
2实验方法
2.1细胞培养与照射方法将HeLa细胞置于含10%胎牛血清的RPMI-1640培养基中培养,每天换液1次。收集对数生长期的细胞,用0.25%胰酶消化,调整细胞密度为5×109/L,加入至96孔板中。将培养板置于照射野(20 cm×20 cm)内,距射野边缘为2 cm,用直线加速器6MV-X线照射,源皮距(SSD)为100 cm,剂量率为300 cGy/min。
2.2MTT法检测不同浓度黄岑苷对HeLa细胞的生长抑制率调整细胞浓度为1×108/L,接种于96孔板中,置于37 ℃、5% CO2的培养箱中培养,细胞贴壁后,分别加入黄岑苷,用培养基调节使终浓度分别为5、10、20、40和80 mg/L,设置调零孔和细胞对照组。培养24 h后,每孔加入5 mg/L MTT溶液20 μL,继续培养4 h后终止培养,吸去培养液,每孔加入150 μL二甲基亚砜,于570 nm波长处,用酶联免疫检测各孔吸光度值,通过细胞活力的变化计算生长抑制率。实验重复3次。
2.3克隆形成实验检测黄岑苷对HeLa细胞放射敏感性的影响实验分为2组,放射组(RA组)仅给予照射处理;联合组(baicalin+RA组)给予8 mg/L黄芩苷和照射处理。照射剂量为0、2、4、6、8 Gy,收集处于对数生长期的HeLa细胞,制成单细胞悬液,并进行稀释:0 Gy组,每孔250个细胞;2 Gy组,每孔500个细胞;4 Gy组,每孔1 000个细胞;6 Gy组,每孔2 000个细胞;8 Gy组,每孔4 000个细胞;联合组在照射前先给予黄岑苷培养24 h后,再与放射组一起接受X射线照射,24 h后更换10%胎牛血清的RPMI-1640培养基,继续培养14 d。PBS液洗涤,用甲醛固定,吉姆萨液染色,自然晾干后克隆计数。依据多靶单击型模型公式SF=1-(1-e-D/D0)N拟合细胞存活曲线,其中SF为细胞存活分数,D为放射剂量(Gy),D0代表平均致死剂量,Dq代表准域剂量,N为外推数,lnN=Dq/D0。并计算黄岑苷的放射增敏比(SER),SER=D0放射/D0放射+药物。
2.4流式细胞术检测细胞周期收集对数生长期细胞,调节细胞密度为5×108/L,实验分为4组:空白对照(control,CON)组仅加入培养基;baicalin组仅给予8 mg/L黄芩苷培养24 h;RA组仅给予6 Gy X射线照射24 h;baicalin+RA组给予8 mg/L黄芩苷培养24 h后,再给予6 Gy X射线照射24 h。各组干预完成后,消化、离心、收集细胞、PBS重悬、加入70%预冷无水乙醇,4 ℃过夜;离心弃去上清液,加入碘化丙啶(propidium iodide,PI) 5 μL,混匀,避光室温反应30 min,流式细胞仪检测细胞周期各时期的细胞数百分比。
2.5Western blot检测相关蛋白实验分组同细胞周期检测。收集经相应处理的各组细胞,按试剂盒说明书提取总蛋白并测定蛋白浓度,进行SDS-PAGE分离蛋白,湿转将蛋白转至PVDF膜,在含5%脱脂牛奶的PBST缓冲液内封闭1 h,加入 I 抗[Akt(1∶400)、p-Akt (1∶200)、Bad (1∶400)、p-Bad (1∶200)]4 ℃过夜,洗膜后加入相应 II 抗(1∶5 000),室温孵育1 h,洗膜,化学发光法显色,冲洗显色,凝胶成像系统扫描分析蛋白条带。
3统计学处理
采用SPSS 15.0软件进行统计学分析。各组数据采用均数±标准差(mean±SD)表示,均数间比较采用单因素方差分析,两两组间采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结果
1黄岑苷对HeLa细胞生长抑制率的影响
为了确定黄岑苷联合X射线处理细胞时的浓度,我们先采用MTT实验检测黄岑苷对HeLa细胞生长抑制率的影响。结果发现不同浓度的黄岑苷,均能使HeLa的细胞生长抑制率增加,且其作用具有明显的浓度依赖性。与0 mg/L组相比,实验中采用的不同浓度黄岑苷均能抑制HeLa细胞生长(P<0.05)。如图1所示,计算得到IC50为43.65 mg/L,在放射生物学中常以IC50的20%浓度进行放射增敏研究,因此,在后续克隆形成实验中采用的浓度为8 mg/L。
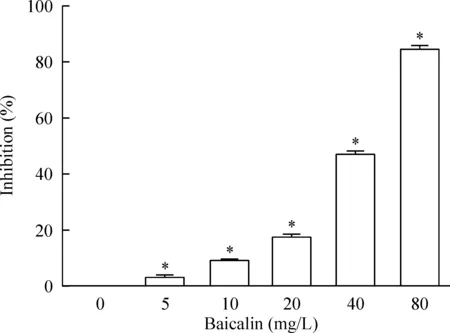
Figure 1.The effects of baicalin on the HeLa cells viability. Mean±SD.n=3.*P<0.05vs0 mg/L group.
图1黄芩苷对HeLa细胞生长抑制率的影响
2细胞克隆形成实验检测黄岑苷对HeLa细胞的放射增敏作用
依据接种细胞数和细胞克隆数计算存活分数,利用多靶单击模型拟合细胞存活曲线,如图2所示,联合组的生存曲线相对于放射组左移,且联合组在各照射剂量下的存活分数均低于放射组。放射生物学参数结果见表1。
3流式细胞术检测HeLa细胞周期
Baicalin组和RA组中G2/M期的细胞数所占百分数显著高于空白对照组(P<0.05),其中RA组高于baicalin组。而baicalin+RA组中G2/M期的细胞数所占百分数显著高于RA组(P<0.05),具体各组细胞周期比例见图3、表2。
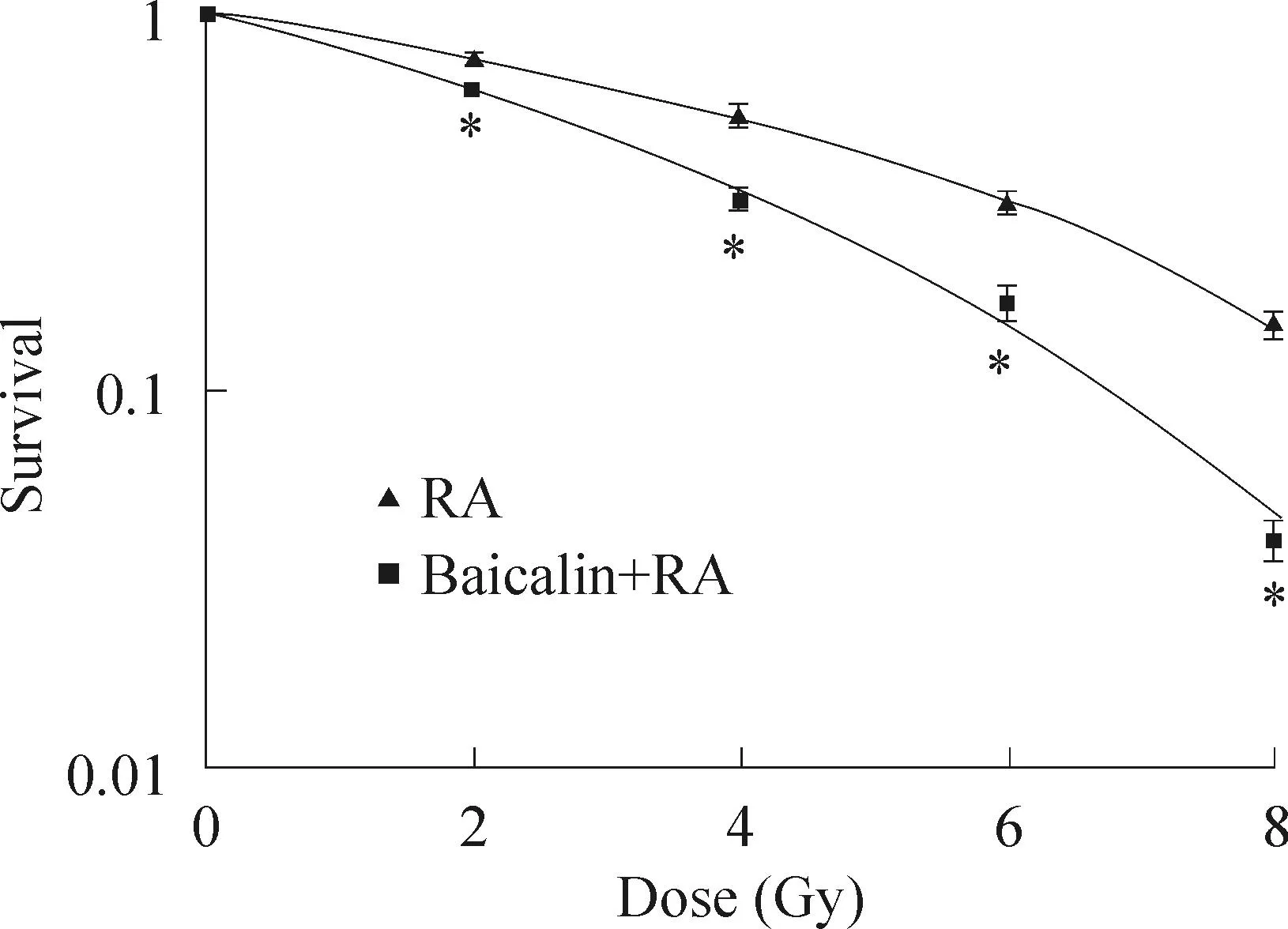
Figure 2.The effects of baicalin on the survival curve of HeLa cells. Mean±SD.n=3.*P<0.05vsRA group.
图2黄岑苷对照射后HeLa细胞存活曲线的影响

表1 黄岑苷对HeLa细胞的放射生物学参数的影响
*P<0.05vsRA group.
Figure 3.The cell cycle distribution in the HeLa cells after corresponding treatments.
图3不同处理组宫颈癌细胞株HeLa细胞在各细胞周期中的分布
表2各组HeLa细胞各周期细胞数分布
Table 2.Cell cycle distribution in HeLa cells (%. Mean±SD.n=3)
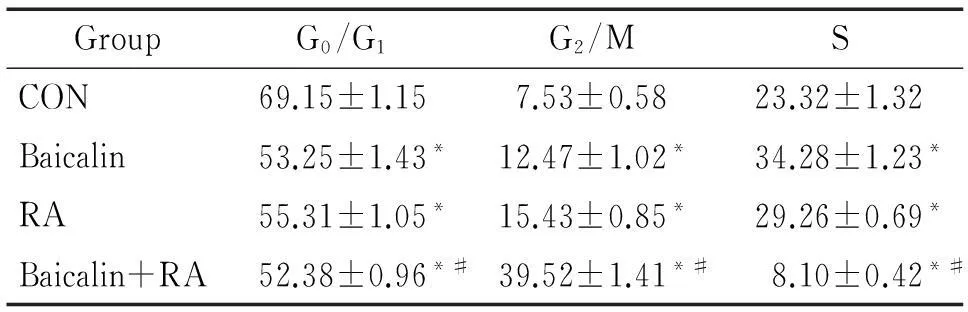
GroupG0/G1G2/MSCON69.15±1.157.53±0.5823.32±1.32Baicalin53.25±1.43*12.47±1.02*34.28±1.23*RA55.31±1.05*15.43±0.85*29.26±0.69*Baicalin+RA52.38±0.96*#39.52±1.41*#8.10±0.42*#
*P<0.05vsCON;#P<0.05vsbaicalin+RA.
4Western blot检测Akt、p-Akt、Bad和p-Bad的蛋白水平
各组细胞中Akt和Bad蛋白表达无显著变化;RA组和baicalin组中p-Akt和p-Bad蛋白水平显著高于CON组,而baicalin+RA组细胞中p-Akt和p-Bad的蛋白水平显著高于RA组(P<0.05),见图4。
讨论
黄岑苷是提取自中药黄岑的主要有效成分之一,在中医理论中被认为具有清热抗炎的作用。近年来许多研究表明黄岑苷具有抗炎、抗氧化、抗病毒、抗肿瘤等作用[6-7],但尚未有研究表明黄岑苷对肿瘤的放射具有增敏作用。因此,本实验将对黄岑苷对宫颈癌细胞的增敏作用进行了初步的研究。
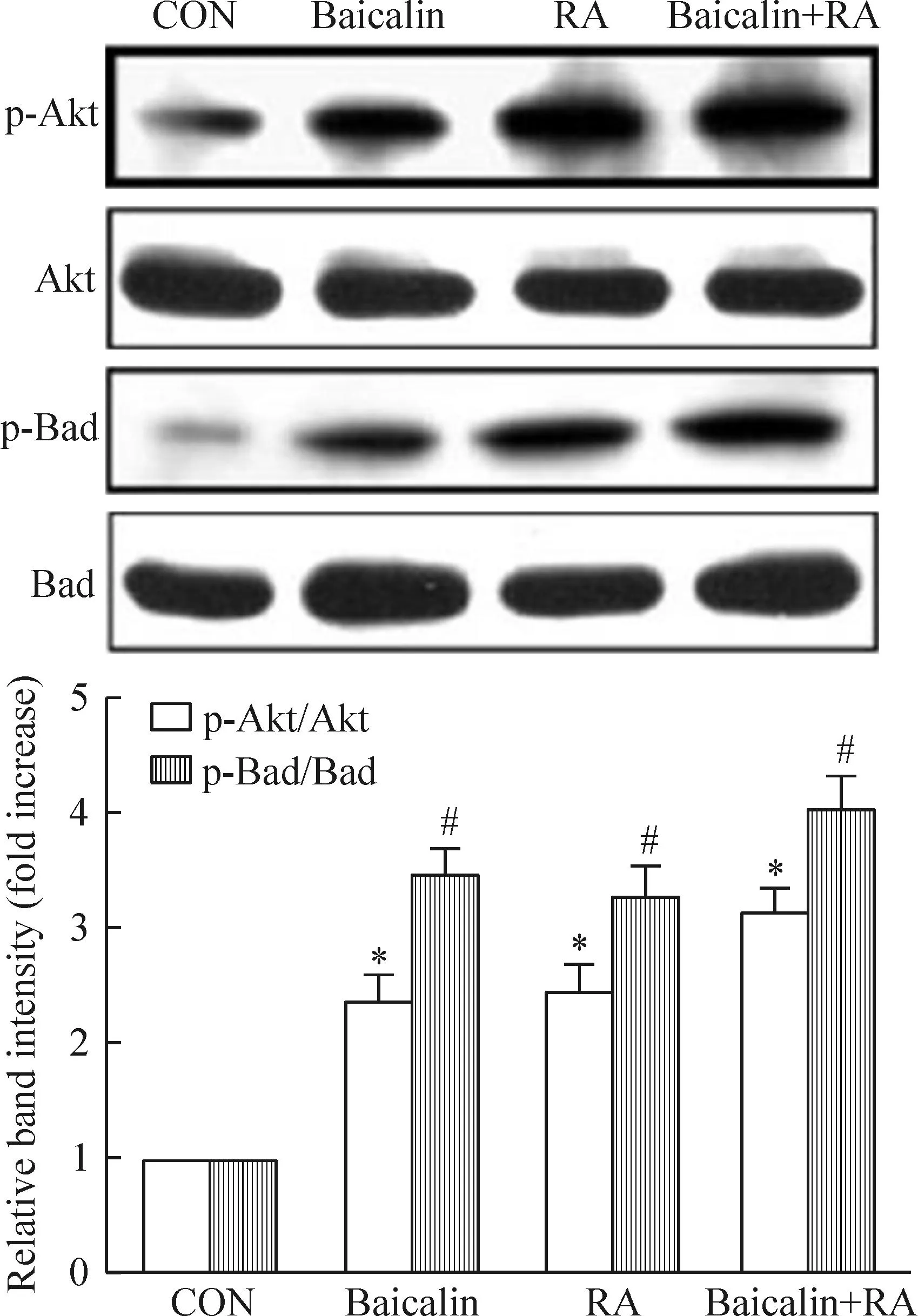
Figure 4.The protein levels of p-Akt and p-Bad in different groups. Meran±SD.n=3.*P<0.05vsCON;#P<0.05vsbaicalin+RA.
图4不同处理组宫颈癌细胞株HeLa细胞中p-Akt和p-Bad的蛋白表达水平
宫晓梅等[8]采用多靶单击模型发现青蒿素对HeLa细胞具有放射增敏的作用。陈玩珊等[9]也发现大黄酰缬氨酸体外能明显增加HeLa细胞的放射增敏性。但尚未有文献报道黄岑苷对HeLa细胞的放射增敏作用。我们研究发现黄岑苷呈浓度依赖性抑制HeLa细胞的增殖,由于理想的放射增敏剂本身对肿瘤组织作用不强且较小剂量即有放射增敏的作用,因此选用半数致死量的20%,即接近无毒浓度进行放射增敏研究,结合实验的可操作性要求,我们选用8 mg/L作为下一步实验的药物增敏浓度。通过多靶单击模型绘制放射存活曲线可见,在各个照射剂量下,联合组的生存分数均低于RA组,提示黄岑苷可增强X射线对HeLa细胞的杀伤作用;再者,相对于RA组而言,联合组的曲线左移,Dq值减小,肩区减少,提示黄岑苷可使HeLa细胞的亚致死性损伤修复能力减弱;经黄岑苷作用后,HeLa细胞对X射线的敏感性增加。通过计算得出SER为1.55,进一步表明黄岑苷对HeLa细胞具有放射增敏作用。
放射生物学研究表明,放射性治疗能够导致肿瘤细胞中DNA链的断链和改变细胞周期进程,且细胞在不同周期对放射线的敏感性不同。研究表明细胞在G2/M期对放射线敏感性最强,S后期抵抗放射损伤能力最强[10]。因此可以通过化疗药物有目的地改变细胞周期。我们研究发现,RA组中S后期细胞有所增加,可能与其抵抗放射损伤及代偿性有关,但放射治疗确实能使HeLa细胞主要阻滞于G2/M期,总体上表现出其抑制增殖的作用。Baicalin+RA组细胞中G2/M期的细胞数所占百分比显著高于baicalin组和RA组,表明黄岑苷联合X射线照射可进一步加强射线对G2/M的阻滞作用。MTT实验与克隆形成实验的结果联合说明黄岑苷可抑制HeLa细胞的增殖。为临床上采用黄岑苷联合放射疗法对宫颈癌的治疗提供了实验依据。
PI3K/Akt信号通路在细胞的增殖、衰老和凋亡等活动中起重要作用[11],射线、辐射和细胞毒性的药物均可激活PI3K/Akt信号通路,使得肿瘤细胞产生应激调节。Akt处于PI3K/Akt信号通路的核心位置,通过激活下游底物,从而抑制细胞凋亡,调控细胞周期以及促进血管形成[12]。Akt激活后可使Bad磷酸化,从而与Bcl-2或Bcl-xL解聚,与抗凋亡结合蛋白结合,发挥促进细胞凋亡的功能[13]。我们发现baicalin+RA组细胞中的p-Akt 和p-Bad与RA组相比,其磷酸化水平均有进一步的增加,提示黄岑苷增强HeLa细胞的放射增敏作用与PI3K/Akt信号通路有关,具体的机制还需进一步实验证实。
[参考文献]
[1]曾康康,莫祥兰,刘斐,等. 宫颈癌及癌前病变阻滞中microRNAs的差异表达[J]. 肿瘤防治研究,2014, 41(7):789-793.
[2]Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[3]刘红,张国楠. 耐药性妇科肿瘤的治疗[J]. 中国实用妇科与产科杂志,2015, 31(3):198-201.
[4]连丽娟. 林巧稚妇科肿瘤学[M]. 第4 版. 北京:人民卫生出版社,2006. 86-89.
[5]丛霄霞,丁库克,张新. 中药对宫颈癌HeLa细胞放射增敏作用的实验研究[J]. 中国肿瘤, 2012, 21(4):289-291.
[6]Zhou BR, Yin HB, Xu Y, et al. Baicalin protects human skin fibroblasts from ultraviolet A radiation-induced oxidative damage and apoptosis[J]. Free Radic Res, 2012, 46(12):1458-1471.
[7]Xu G, Dou J, Zhang L, et al. Inhibitory effects of baicalein on the influenza virusinvivois determined by baicalin in the serum[J]. Biol Pharm Bull, 2010, 33(2): 238-243.
[8]宫晓梅,周道安,曹建平,等.青蒿素对人宫颈癌细胞的毒性和放射增敏研究[J].苏州大学学报:医学版,2010,30(2):224-226.
[9]陈玩珊,原文鹏,胡新华,等.大黄酰缬氨酸对人宫颈癌HeLa细胞生长的抑制作用与放射增敏作用研究[J].中国药房,2015,26(10):1360-1362.
[10]贺任才,刘俊松,张正良,等. β-榄香烯对胃癌MKN28细胞株放射增敏作用的研究[J]. 中华外科杂志,2014, 52(6):442-445.
[11]Nzanoc N, Schakman O, Lovis P, et al. Trpclinon channel modulates phosphatidylinositol 3-kinase/Akt pathway during myoblast differentiation and muscle regeneration[J]. J Biol Chem, 2012, 287(18):14524-14534.
[12]Kang S, Dong SM, Kim BR, et al. Thioridazine induces apoptosis by targeting the PI3K/AKT/Mtor pathway in cervical and endometrial cancer cells[J]. Apoptosis, 2012, 17(9):989-997.
[13]夏曙,赵茵,张孟贤,等. PI3K/Akt通路在药物放射增敏中作用的机制[J]. 华中科技大学学报:医学版, 2009, 38(5):636-640.
(责任编辑: 林白霜, 余小慧)

*[基金项目]广东省科技计划(No.2012B031800063);广东省卫生厅基金资助项目(No. B2012111)
Radiosensitizing effect of baicalin on human cervical carcinoma HeLa cellsHUI Shuang
(DepartmentofOncology,NanyangCityCenterHospital,Nanyang473009,China.E-mail:huishuang1976@163.com)
[ABSTRACT]AIM: To investigate the effect of baicalin on the radiosensitization of HeLa cells. METHODS: The cell activity was determined by MTT assay. The radiosensitivity of HeLa cells was detected by colony formation assay. The cell cycle was analyzed by flow cytometry. The protein levels of Akt, p-Akt, Bad and p-Bad were examined by Western blot. RESULTS: The cell growth of the HeLa cells was inhibited by baicalin dose-dependently and IC50was 43.65 mg/L. The results of colony formation assay showed that combination of 8 mg/L baicalin and radiotherapy further improved survival curve and decreased the value of D0 and Dq, as compared with radiotherapy alone (P<0.05). Furthermore, baicalin enhanced the effect of radiotherapy on cell cycle, as evidenced by the increase in cell percentage in G2/M phase (P<0.05). Additionally, after incubation with baicalin, radiotherapy-induced phosphorylation of Akt and Bad were further augmented (P<0.05). CONCLUSION: Baicalin augments radiosensitivity of HeLa cells through the inhibition of cell cycle transition and activation of PI3K/Akt signaling pathway.
[KEY WORDS]Baicalin; HeLa cells; Radiosensitization; PI3K/Akt signaling pathway
通讯作者△Tel: 020-85252230; E-mail: songwangcai@yahoo.com
[收稿日期]2015- 03- 25[修回日期] 2015- 09- 10
[文章编号]1000- 4718(2015)12- 2130- 06
doi:10.3969/j.issn.1000- 4718.2015.12.003
[中图分类号]R737.33; R730.23
[文献标志码]A
