敲低IK1钾通道抑制ClC-3氯通道的表达和功能*
2016-01-31邹丽莉吕瑞玲孙晓雪朱林燕陈丽新王立伟
邹丽莉, 叶 东, 吕瑞玲, 汪 源, 孙晓雪, 朱林燕, 陈丽新△, 王立伟△
(暨南大学医学院 1生理学系, 2药理学系,广东 广州 510632; 3广东药学院基础学院,广东 广州 510006)
敲低IK1钾通道抑制ClC-3氯通道的表达和功能*
邹丽莉1▲,叶东3▲,吕瑞玲1,汪源2,孙晓雪2,朱林燕2,陈丽新2△,王立伟1△
(暨南大学医学院1生理学系,2药理学系,广东 广州 510632;3广东药学院基础学院,广东 广州 510006)
[摘要]目的: 探讨ClC-3氯通道是否为IK1钾通道的调节靶点,重点研究鼻咽癌细胞IK1钾通道对ClC-3氯通道功能及蛋白表达的影响。方法: 采用siRNA转染技术抑制低分化鼻咽癌上皮细胞(CNE-2Z)IK1基因的表达;real-time PCR技术检测ClC-3 mRNA的表达;Western blot检测ClC-3的蛋白表达;细胞免疫荧光结合激光共聚焦显微镜技术检测ClC-3和IK1蛋白在细胞内分布;全细胞膜片钳记录细胞氯电流。结果: IK1 siRNA可以成功转染CNE-2Z细胞,有效抑制鼻咽癌细胞IK1钾离子通道的表达;用IK1 siRNA抑制鼻咽癌细胞IK1钾离子通道的表达后, ClC-3的mRNA表达上调而ClC-3蛋白却表达减少:在低分化鼻咽癌上皮细胞,低渗刺激可激活氯通道,产生一个较大的氯电流,在成功转染IK1 siRNA的细胞,此氯电流明显减弱。结论: 敲低IK1钾离子通道可抑制ClC-3氯离子通道的表达和功能。
[关键词]ClC-3氯通道; IK1钾通道; 鼻咽癌; 膜片钳技术
细胞生长、分化和凋亡失去调控等多种因素都可能导致细胞生长发展失去既定的程序和缺乏分化而异常增生,最终导致肿瘤的发生。相对正常细胞而言,肿瘤细胞生长旺盛并且与人体正常的机能代谢不协调,并可迁移以及进一步侵犯正常组织和器官。肿瘤细胞往往处于一种增殖迅速、低分化程度的状态。细胞周期调控在细胞增殖、分化、凋亡和癌变等生理病理过程起基础作用,肿瘤的发生发展中的关键问题之一就是细胞周期失去调控。
细胞周期的调控是一个异常复杂而精密的过程。我们前期的研究表明,用氯通道阻断剂能降低细胞的增殖,使处于G0/G1期的细胞百分比增加。此外,氯通道还参与细胞分化、凋亡和迁移等[1-2], ClC-3氯离子通道蛋白被认为是容积敏感性氯通道候选蛋白之一[3-7],参与细胞的多种生理活动。有研究表明ClC-3氯离子通道作为周期蛋白cyclin D1的作用靶点参与细胞周期的调控[8],提示ClC-3氯离子通道对于细胞的增殖必不可少且是细胞周期调节中的关键因素之一。钾离子通道是分布最广泛的阳离子通道之一,存在于大多数的生物细胞中,参与诸多的细胞生物功能。IK1钾离子通道广泛表达于多种细胞[9]。IK1钾离子通道基因表达受抑制后细胞增殖能力减弱并且细胞周期停滞于G0/G1期[10-14],提示IK1钾离子通道参与细胞增殖和细胞周期的调控。
ClC-3氯离子通道是细胞通过G1-S期关卡的关键因素之一,IK1钾离子通道作为体内常见的阳离子通道也参与细胞的周期调控,在调控细胞从G0/G1期进入S期起决定性作用。这2种离子通道在细胞周期调控中都起关键性作用,但目前这2种通道间的关系尚不清楚。本研究旨在探索在细胞周期调控中ClC-3氯通道是否为IK1钾通道的调节靶点,试图从离子通道之间调控作用的角度探讨细胞周期调控,拓展对细胞周期调控机制的理解和认识。
材料和方法
1细胞
本课题的研究对象为人鼻咽癌上皮细胞株 CNE-2Z,由广东医学院病理教研室惠赠后于本室长期保存。
2主要试剂
ATP购自Gibco;脂质体LipofectamineTM2000购自Invitrogen;三羟甲基氨基甲烷购自Amresco;兔抗IK1多抗、鼠抗ClC-3单抗均购自Abcam;BCA蛋白浓度测定试剂盒和ECL化学发光试剂购自中国碧云天生物技术研究所;偶联辣根过氧化物酶羊抗小鼠IgG购自北京博奥森生物技术有限公司;偶联辣根过氧化物酶羊抗兔IgG购自武汉博士德生物工程有限公司;siRNA由上海吉玛制药技术有限公司设计合成。
3主要方法
3.1细胞培养用含有10%新生小牛血清、1×105U/L青霉素和100 mg/L链霉素的1640培养液培养CNE-2Z细胞,置于5% CO2、37 ℃培养箱中,48 h后传代。
3.2转染IK1 siRNA取处于对数生长期的人低分化鼻咽癌上皮细胞进行消化,并用不含有抗生素的1640培养液接种于6孔板中,24 h后取出孔板换液,并将siRNA和转染试剂混匀成的转染复合体加至培养板中进行转染,在正常培养条件下继续培养。siRNA终浓度为100 nmol/L。本研究使用的IK1 siRNA为对应于人体来源的IK1钾离子通道基因的siRNA双链,正义链序列为5’-GCCGUGCGUGCAGGAUUUA-3’,反义链序列为5’-UAAAUCCUGCACGCACGGC-3’;无序siRNA正义链序列为5’-UUCUCCGAACGUGUCACGUTT-3’,反义链序列为5’-ACGUGACACGUUCGGAGAATT-3’。本实验同时设立空白对照组、转染试剂组、无序对照组和IK1 si-RNA转染组。
3.3IK1 siRNA转染率检测由于本研究使用的IK1 siRNA标记有5-FAM绿色荧光基团,转染成功的细胞在荧光显微镜下能检测到绿色荧光。在转染细胞继续培养24 h后用无菌PBS洗3次,再用荧光显微镜观测荧光强度并分析转染效率。
3.4Real-time PCR检测 IK1钾通道mRNA的表达转染siRNA后继续培养36 h,常规方法提取细胞总RNA,对提取的总RNA进行定量、逆转录,加入2×qPCR Taq Mix 12.5 μL,10 μmol/L各基因上、下游引物混合物0.5 μL,cDNA模板1 μL,加DEPC水补齐至25 μL; 振荡混匀,置于Bio-Rad PCR仪中;设定条件为:95 ℃ 5 min;95 ℃ 15 s,65 ℃ 40 s,44个循环。用Bio-Rad软件分析所得数据。
3.5Western blot检测IK1钾通道蛋白的表达转染siRNA 48 h后继续培养48 h,常规方法提取细胞总蛋白,将得到的总蛋白采用BCA蛋白定量试剂盒定量分析后变性,然后行10% SDS-PAGE和半干转膜、5%脱脂牛奶封闭2 h,4 ℃孵育 I 抗过夜;TBST洗3次后室温孵育 II 抗1 h;TBST洗3次,ECL化学发光显影。扫描仪扫描得到图片并用ImageJ软件分析图像。
3.6流式细胞术常规培养细胞并消化,种入6孔板中,置入细胞培养箱中12 h;转染IK1 siRNA继续培养48 h,无菌PBS洗孔板中的细胞3次,每次1 min,胰酶消化使细胞变成单个细胞悬浮液,收集细胞移入新的干净无菌EP管中,800 r/min离心5 min,去上清液;加入无菌PBS,轻柔吹打混匀后800 r/min 离心5 min;再重复上一步2次;加入70%乙醇,轻柔吹打混匀,使细胞重新呈单个细胞悬浮状态;4℃固定1 h;BD流式细胞仪检测细胞周期分布。
3.7细胞免疫荧光实验常规培养CNE-2Z细胞并消化成单个细胞的悬浮液,将细胞悬浮液滴在干净的无菌圆形载玻片上,放入培养箱中正常培养6 h完成细胞爬片。用4%的多聚甲醛滴在爬片上,加0.5 mL 0.5% Triton X-100至玻片,室温静置20 min,滴加正常山羊血清,室温封闭30 min;滴加足够量的稀释好的 I 抗并放入湿盒,4 ℃孵育过夜;取出玻片,去除 I 抗,放入暗室并滴加稀释好的荧光 II 抗,湿盒中室温避光孵育1 h;滴加DAPI避光孵育5 min,对标本进行染核,用含抗荧光淬灭剂的封片液封片,中性树脂封边,然后在激光共聚焦显微镜下观察并采集图像。
3.8膜片钳实验用全细胞膜片钳技术记录氯电流,指令电压按照0 mV、±40 mV、±80 mV反复循环,每个钳制脉冲波宽为200 ms, 间隔时间为4 s。等渗灌流液(300 mOsm/L)配方:70 NaCl,0.5 MgCl2,2 CaCl2,10 Hepes,140 D-mannitol;47%低渗灌流液(160 mOsm/L)不含D-mannitol,其它成分与等渗液相同;电极内液含:70 N-methyl-D-glucamine chloride,1.2 MgCl2,1 EGTA,10 Hepes,140 D-mannitol,2 ATP。所有配制液体中所用试剂单位均为mmol/L。灌流液和电极內液的pH值分别调至7.4 和7.2。
4统计学处理
用SPSS 12.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),各组均数间比较采用Student-Newman-Keuls检验,以P<0.05 为差异有统计学意义。
结果
1IK1 siRNA转染CNE-2Z细胞的转染率
用带5-FAM绿色荧光基团的IK1 siRNA转染细胞并培养12 h后观测转染率。空白对照组细胞并未转染IK1 siRNA,无绿色荧光;IK1 siRNA转染组细胞在荧光照射下出现大量绿色荧光,说明IK1 siRNA成功转染进入鼻咽癌上皮细胞,见图1。
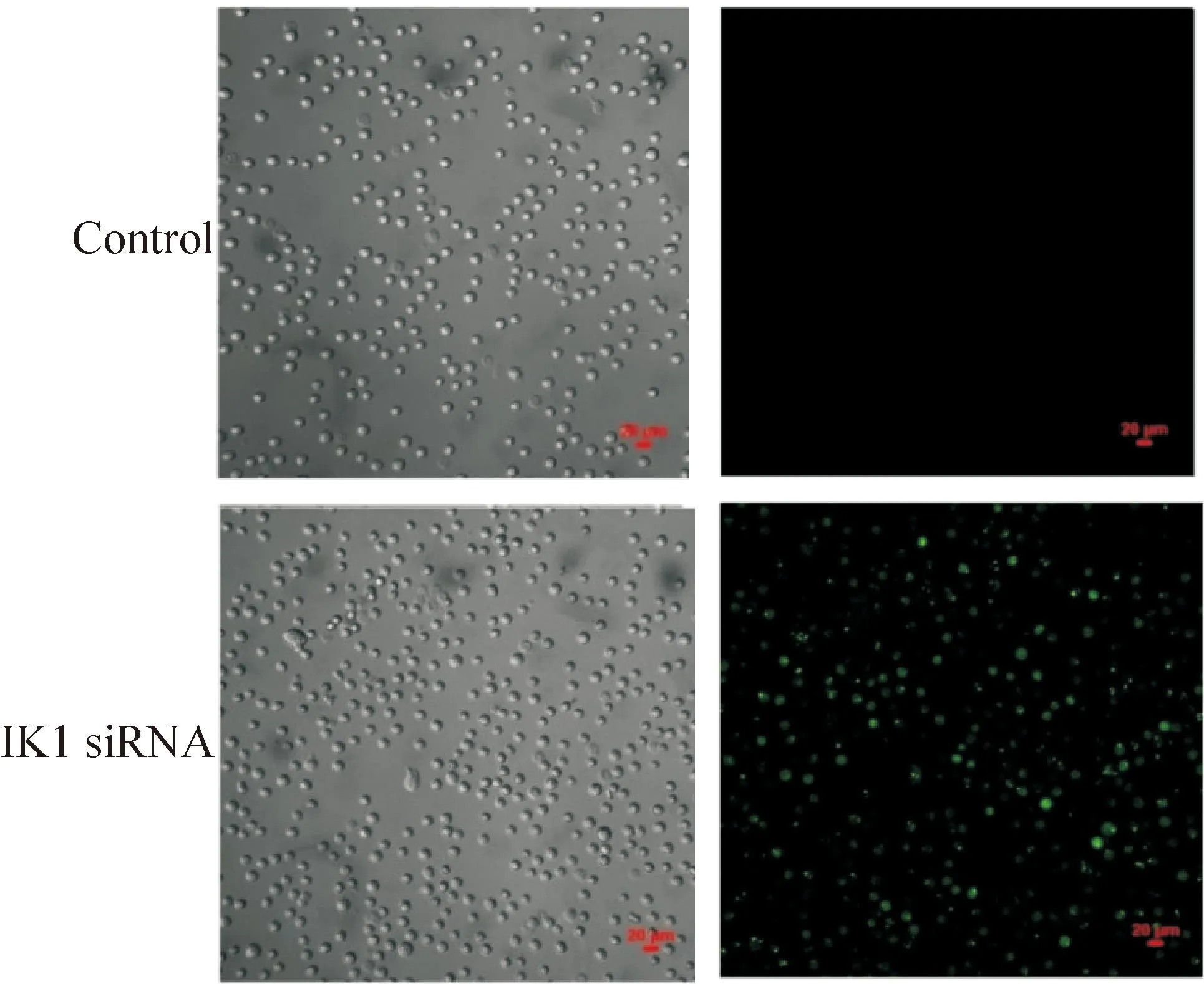
Figure 1.Transfection efficiency of IK1 siRNA observed under fluorescence microscope in poorly differentiated nasopharyngeal carcinoma CNE-2Z cells(×10).
图1荧光显微镜下观察IK1 siRNA转染低分化鼻咽癌CNE-2Z细胞的转染效率
2IK1 siRNA抑制IK1钾通道蛋白的表达
在转染IK1 siRNA并培养48 h后,冰上裂解细胞并收集总蛋白,用Western blot检测蛋白含量。结果如图2所示,转染试剂对照组(Lipo组)IK1蛋白的表达和无序列siRNA对照组(negative siRNA组)与空白对照组(control组)相比较,差异无统计学意义。IK1 siRNA组与空白对照组相比,IK1蛋白表达明显减少(P<0.05)。Real-time PCR的结果显示,IK1 siRNA组的IK1 mRNA较control组减少(79.3±2.5)%(P<0.01),结果未显示。
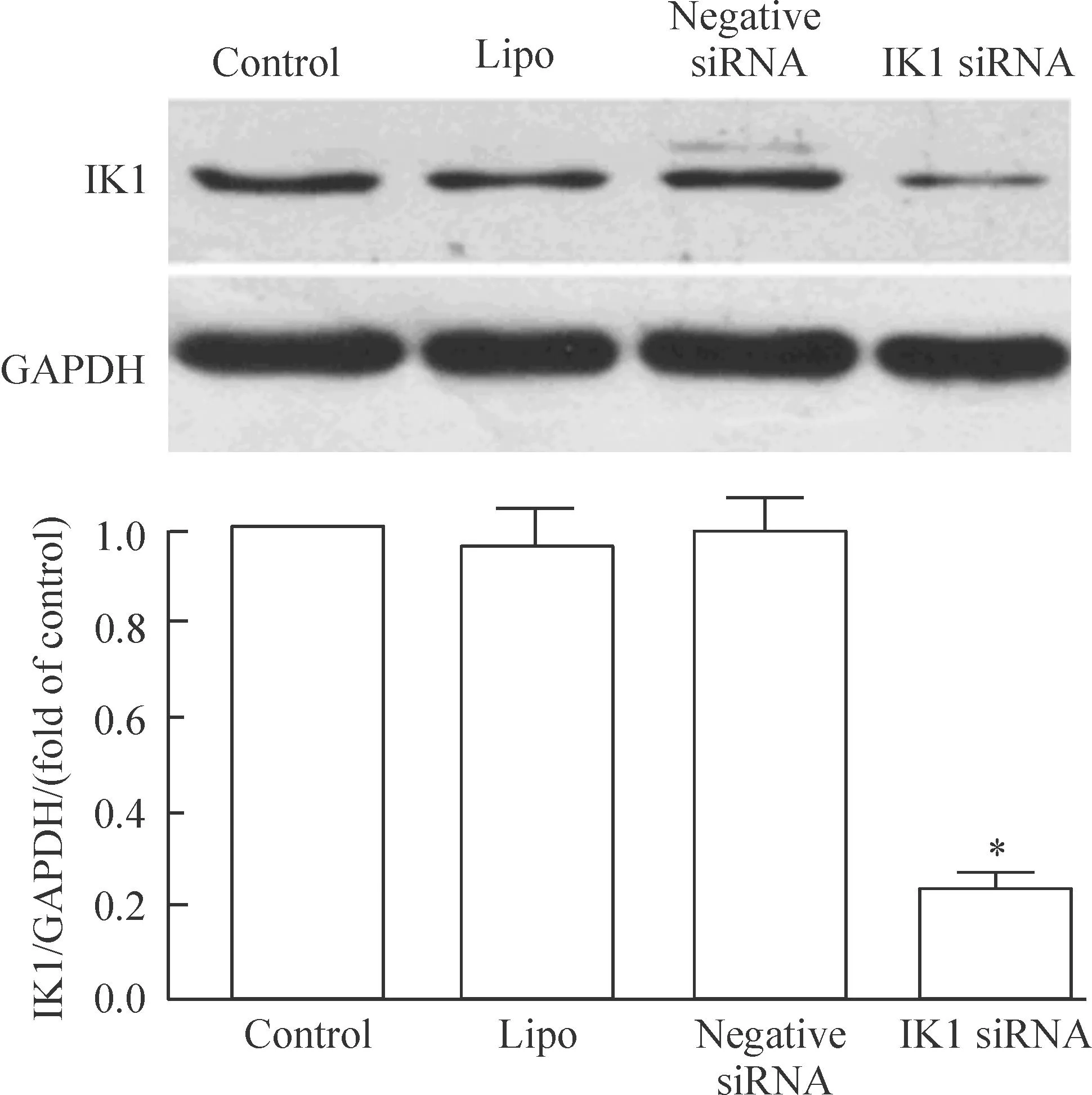
Figure 2.Inhibition of IK1 protein expression by IK1 siRNA in the CNE-2Z cells.Mean±SD.n=3.*P<0.05vscontrol.
图2IK1 siRNA抑制CNE-2Z细胞中IK1钾通道蛋白的表达
3IK1 siRNA转染促进ClC-3 mRNA的表达
转染siRNA后36 h,IK1 siRNA组ClC-3 mRNA较control组增加90% (P<0.05),见图3。

Figure 3.The increase in the mRNA expression of ClC-3 by IK1 siRNA in the CNE-2Z cells. Mean±SD.n=3.*P<0.05vscontrol.
图3IK1 siRNA促进CNE-2Z细胞ClC-3 mRNA的表达
4IK1 siRNA转染使细胞内ClC-3绿色荧光减弱
激光共聚焦显微镜下观察免疫荧光,蓝色为细胞核,绿色为ClC-3氯通道蛋白,红色为IK1钾通道蛋白。如图4所示,对照组细胞中可以检测到带绿色荧光的ClC-3氯通道蛋白,而且在细胞核和细胞膜上分布较多。与对照组细胞的红色荧光相比较,IK1 siRNA组细胞的红色荧光明显减弱,提示IK1 siRNA能有效抑制IK1蛋白在细胞内的表达。IK1 siRNA组细胞中可以检测到较弱带绿色荧光的ClC-3氯通道蛋白,其绿色荧光明显弱于对照组,表明IK1钾通道蛋白表达被抑制后,ClC-3氯通道蛋白的表达受到抑制。
5IK1 siRNA抑制CNE-2Z细胞内ClC-3蛋白的表达
Western blot结果显示,与空白对照组相比, IK1 siRNA组ClC-3蛋白表达减少(P<0.05),这提示IK1钾离子通道可调控ClC-3氯离子通道蛋白的表达,见图5。
6IK1 siRNA抑制CNE-2Z细胞氯电流
在空白对照组,细胞外灌流47%等渗液可激活氯通道。在钳制电压为-80 mV时,记录到的氯电流平均电流密度为(-55.2±7.2)pA/pF, +80 mV时的平均电流密度为(78.0± 4.3)pA/pF,此电流可被胞外灌流氯通道阻断剂DIDS (100 μmol/L) 所抑制。在IK1 siRNA转染48 h后的细胞,胞外灌流47%低渗灌流液激活的氯电流较为微弱,在钳制电压为-80 mV时,平均电流密度为(-22.5± 3.4)pA/pF, +80 mV时平均电流密度为(49.9± 5.7)pA/pF,胞外灌流氯通道阻断剂DIDS (100 μmol/L)后,该氯电流基本被抑制,与空白对照组相比差异显著(P<0.01)。结果表明IK1 siRNA转染能有效抑制细胞的容积激活性氯电流,见图6。
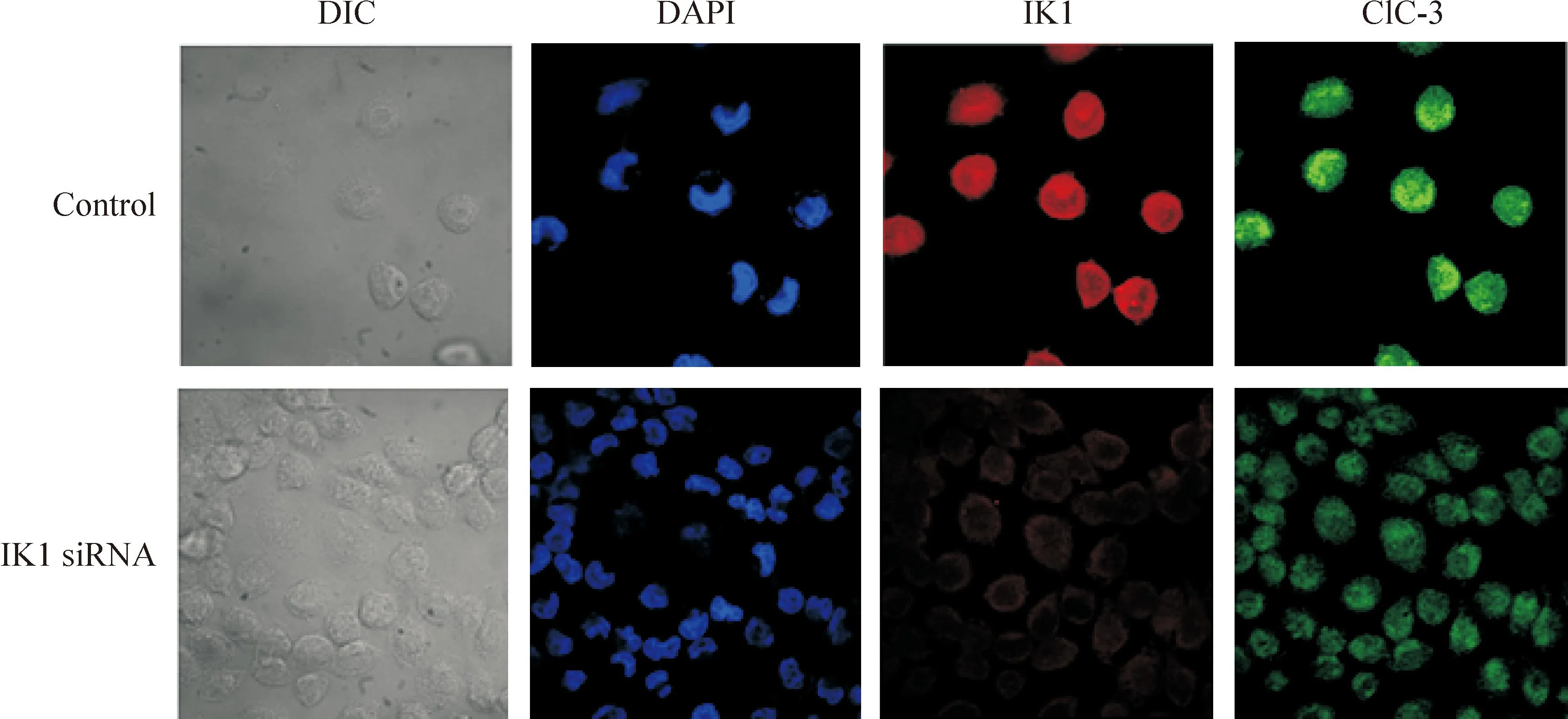
Figure 4.ClC-3 protein distribution detected by the confocal immunofluorescence microscopy in the CNE-2Z cells. DIC: differential interference contrast image.
图4激光共聚焦显微镜下检测ClC-3蛋白的细胞内分布

Figure 5.The effects of IK1 siRNA on the protein expression of ClC-3 in the CNE-2Z cells. Mean±SD.n=3.*P<0.05vscontrol.
图5IK1 siRNA对ClC-3蛋白表达的影响
讨论
氯离子通道参与细胞周期的调控、细胞分化、细胞迁移和细胞凋亡[15-21],氯离子通道阻断剂能导致细胞周期的停滞和使细胞增殖减少[1],提示氯离子通道在细胞周期和细胞增殖过程中发挥重要作用。ClC-3氯离子通道作为电压门控氯离子通道,是具有容积敏感性的氯离子通道之一[22-26],对细胞的生命活动是必不可少的,ClC-3氯离子通道蛋白的表达呈现周期依赖性,ClC-3氯离子通道参与调节细胞体积、细胞分化和细胞凋亡。我们的前期研究表明,沉默ClC-3氯离子通道能抑制细胞增殖并且使细胞停滞在G0/G1期,提示在细胞周期进程中,ClC-3氯离子通道是调节细胞通过G1-S关卡的关键因素之一,参与细胞周期的调控。
钾离子通道作为体内最多的阳离子通道在很多研究领域并不陌生,钾离子通道蛋白在增殖较活跃的细胞中表达增多,钾离子通道阻断剂能阻断细胞周期进程并且抑制细胞的增殖。IK1基因被下调后,细胞的增殖受抑制,使用siRNA沉默IK1钾离子通道基因后,能阻断细胞周期进程并且使细胞增殖受到抑制。这些都提示IK1钾离子通道在细胞周期进程中是必不可少。
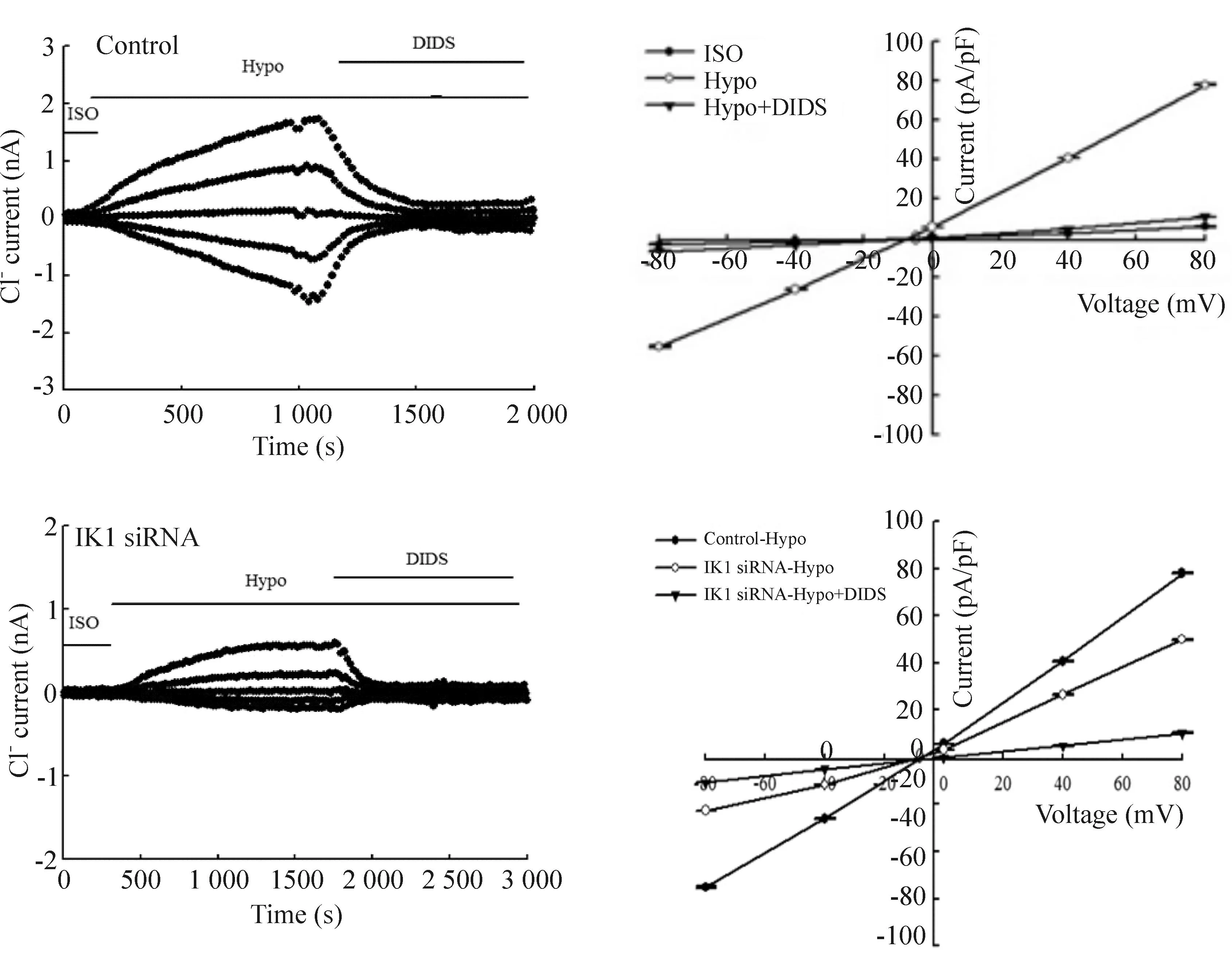
Figure 6.Inhibition of hypotonicity (Hypo)-activated chloride current by IK1 siRNA in the CNE-2Z cells.Mean±SD.n=5.*P<0.05vscontrol.
图6IK1 siRNA抑制细胞低渗激活的氯电流
目前已知ClC-3氯离子通道和IK1钾离子通道参与细胞周期的调控,但这2种通道间的关系并不清楚。本研究究旨在探索IK1钾离子通道对ClC-3氯离子通道是否具有调控作用,从离子通道之间的调控作用的全新出发点来探索肿瘤细胞的周期调控。结果显示,IK1 siRNA能被成功转染进入低分化鼻咽癌上皮细胞,并且有效抑制IK1钾离子通道蛋白的表达,表明所设计的siRNA可有效干扰鼻咽癌细胞IK1基因的表达。
Real-time PCR结果提示,在细胞的mRNA水平,低表达IK1能使细胞ClC-3在基因水平表达增高,即IK1钾离子通道在mRNA水平对ClC-3氯离子通道具有负调控作用。用免疫荧光技术在激光共聚焦显微镜下观察不同组内细胞中ClC-3 蛋白的分布情况,结果显示,与空白对照组相比, IK1 siRNA组细胞中的ClC-3绿色荧光较弱,提示了IK1 siRNA能抑制细胞中ClC-3蛋白的表达,也就是说IK1的低表达使ClC-3蛋白质表达减少,IK1钾离子通道蛋白对ClC-3氯离子通道蛋白的表达具有正调控作用,这种调控作用在Western blot分析中得到进一步的证实。Western blot结果表明,IK1 siRNA可抑制ClC-3蛋白的表达,即低表达IK1后ClC-3蛋白的表达受到抑制。在上述结果中,IK1 siRNA促进了ClC-3 mRNA的表达却抑制了ClC-3蛋白的表达。这可能与真核细胞基因的表达过程中,基因的转录和翻译是2个不同的过程,在某些特定的条件下脱节相关。在转录和翻译2个水平,同一个基因可以有不同的转录本,而且mRNA可以有不同的剪接方式,因此一个基因可以有多个蛋白质。基因转录至mRNA后再到蛋白质还有众多的调控,从ClC-3的 mRNA到ClC-3 蛋白是一个复杂的调控过程,可能ClC-3 mRNA没有翻译为蛋白就降解了,也可能翻译到一定水平后,获得另外的信号,而停止翻译从而导致ClC-3 mRNA的表达水平升高而ClC-3蛋白表达水平下降的结果。ClC-3 mRNA在成功翻译为ClC-3 蛋白之后还存在一个翻译后加工问题,如果翻译后加工不正确,ClC-3 蛋白可能被内肽酶降解,也有可能活性降低,而导致最终ClC-3蛋白表达水平下降。在ClC-3蛋白受到抑制而表达水平下降后,细胞可能在mRNA水平反馈调节,最终导致ClC-3蛋白表达水平降低而mRNA的表达水平升高。
全细胞膜片钳记录细胞容积激活性氯通道的结果表明,IK1 siRNA作用组的细胞与空白对照组的细胞相比,其容积激活性氯电流明显减小,说明IK1 siRNA可抑制细胞容积激活性氯电流,进一步提示敲低IK1 钾通道可以抑制氯通道的功能。
综上所述, 敲低IK1钾离子通道对ClC-3氯离子通道的表达和功能可能具有抑制作用。
[参考文献]
[1]Chen LX, Zhu LY, Jacob TJ, et al. Roles of volume-activated Cl-currents and regulatory volume decrease in the cell cycle and proliferation in nasopharyngeal carcinoma cells[J]. Cell Proliferation, 2007, 40(2):253-267.
[2]Zhu L, Yang H, Zuo W, et al. Differential expression and roles of volume-activated chloride channels in control of growth of normal and cancerous nasopharyngeal epithelial cells[J]. Biochem Pharmacol, 2012, 83(3):324-334.
[3]Duan D, Zhong J, Hermoso M, et al. Functional inhibition of native volume-sensitive outwardly rectifying anion channels in muscle cells and Xenopus oocytes by anti-ClC-3 antibody[J]. J Physiol, 2001, 531(Pt 2):437-444.
[4]Hermoso M, Satterwhite CM, Andrade YN, et al. ClC-3 is a fundamental molecular component of volume-sensitive outwardly rectifying Cl-channels and volume regulation in HeLa cells and Xenopus laevis oocytes[J]. J Biol Chem, 2002, 277(42):40066-40074.
[5]Wang L, Chen L, Jacob TJ. The role of ClC-3 in volume-activated chloride currents and volume regulation in bovine epithelial cells demonstrated by antisense inhibition[J]. J Physiol, 2000, 524( Pt 1):63-75.
[6]Mao J, Yuan J, Wang L, et al. Tamoxifen inhibits migration of estrogen receptor-negative hepatocellular carcinoma cells by blocking the swelling-activated chloride current[J]. J Cell Physiol, 2013, 228(5):991-1001.
[7]Yang L, Ye D, Ye W, et al. ClC-3 is a main component of background chloride channels activated under isotonic conditions by autocrine ATP in nasopharyngeal carcinoma cells[J]. J Cell Physiol, 2011, 226(10):2516-2526.
[8]Zhang H, Zhu L, Zuo W, et al. The ClC-3 chloride channel protein is a downstream target of cyclin D1 in nasopharyngeal carcinoma cells[J]. Int J Biochem Cell Biol, 2013, 45(3):672-683.
[9]Smets I, Ameloot M, Steels P, et al. Loss of cell volume regulation during metabolic inhibition in renal epithelial cells (A6): role of intracellular pH[J]. Am J Physiol Cell Physiol, 2002, 283(2):C535-C544.
[10]Semtner M, Schaefer M, Pinkenburg O, et al. Potentiation of TRPC5 by protons[J]. J Biol Chem, 2007, 282(46):33868-33878.
[11]Cha SK, Jabbar W, Xie J, et al. Regulation of TRPV5 single-channel activity by intracellular pH[J]. J Membrane Biol, 2007, 220(1-3):79-85.
[12]Tao R, Lau CP, Tse HF, et al. Regulation of cell proliferation by intermediate-conductance Ca2+-activated potassium and volume-sensitive chloride channels in mouse mesenchymal stem cells[J]. Am J Physiol Cell Physiol, 2008, 295(5):C1409-C1416.
[13]Jang SH, Choi C, Hong SG, et al. Silencing of Kv4.1 potassium channels inhibits cell proliferation of tumorigenic human mammary epithelial cells[J]. Biochem Biophys Res Commun, 2009, 384(2):180-186.
[14]Lallet-Daher H, Roudbaraki M, Bavencoffe A, et al. Intermediate-conductance Ca2+-activated K+channels (IKCa1) regulate human prostate cancer cell proliferation through a close control of calcium entry[J]. Oncogene, 2009, 28(15):1792-1806.
[15]Schwab A, Wulf A, Schulz C, et al. Subcellular distribution of calcium-sensitive potassium channels (IK1) in migrating cells[J]. J Cell Physiol, 2006, 206(1):86-94.
[16]Schmidt J, Friebel K, Schonherr R, et al. Migration-associated secretion of melanoma inhibitory activity at the cell rear is supported by KCa3.1 potassium channels[J]. Cell Res, 2010, 20(11):1224-1238.
[17]Gilliham M, Sullivan W, Tester M, et al. Simultaneous flux and current measurement from single plant protoplasts reveals a strong link between K+fluxes and current, but no link between Ca2+fluxes and current[J]. Plant J, 2006, 46(1):134-144.
[18]Bortner CD, Cidlowski JA. Cell shrinkage and monovalent cation fluxes: role in apoptosis[J]. Arch Biochem Biophys, 2007, 462(2):176-188.
[19]Messerli MA, Collis LP, Smith PJ. Ion trapping with fast-response ion-selective microelectrodes enhances detection of extracellular ion channel gradients[J]. Biophys J, 2009, 96(4):1597-1605.
[20]Strotmann R, Harteneck C, Nunnenmacher K, et al. OTRPC4, a nonselective cation channel that confers sensitivity to extracellular osmolarity[J]. Nature Cell Biol, 2000, 2(10):695-702.
[21]Okada Y, Sato K, Numata T. Pathophysiology and puzzles of the volume-sensitive outwardly rectifying anion channel[J]. J Physiol, 2009, 587(Pt 10):2141-2149.
[22]Borg JJ, Hancox JC, Spencer CI, et al. Tefluthrin modulates a novel anionic background conductance (IAB) in guinea-pig ventricular myocytes[J]. Biochem Biophys Res Commun, 2002, 292(1):208-215.
[23]Ransom CB, O’Neal JT, Sontheimer H. Volume-activated chloride currents contribute to the resting conductance and invasive migration of human glioma cells[J]. J Neurosci, 2001, 21(19):7674-7683.
[24]Rinke I, Artmann J, Stein V. ClC-2 voltage-gated channels constitute part of the background conductance and assist chloride extrusion[J]. J Neurosci, 2010, 30(13):4776-4786.
[25]Moore DJ, Chambers JK, Wahlin JP, et al. Expression pattern of human P2Y receptor subtypes: a quantitative reverse transcription-polymerase chain reaction study[J]. Biochim Biophys Acta, 2001, 1521(1-3):107-119.
[26]Duan D, Hume JR, Nattel S. Evidence that outwardly rectifying Cl-channels underlie volume-regulated Cl-currents in heart[J]. Circ Res, 1997, 80(1):103-113.
(责任编辑: 陈妙玲, 余小慧)

*[基金项目]国家自然科学基金资助项目(No. 81171741)
Knockdown of IK1 potassium channel inhibits expression and function of ClC-3 chloride channelZOU Li-li1, YE Dong3, LÜ Rui-ling1, WANG Yuan2, SUN Xiao-xue2, ZHU Lin-yan2, CHEN Li-xin2, WANG Li-wei1
(1DepartmentofPhysiology,2DepartmentofPharmacology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China;3SchoolofBasicCourses,GuangdongPharmaceuticalUniversity,Guangzhou510006,China.E-mail:twangliwei@jnu.edu.cn;tchenlixin@jnu.edu.cn)
[ABSTRACT]AIM: To investigate whether the ClC-3 chloride channel is an acting target of the IK1 potassium channel, and to study the action of IK1 potassium channel on the functional activities and expression of ClC-3 chloride channels. METHODS: IK1 gene was silenced by IK1 siRNA in poorly-differentiated nasopharyngeal carcinoma cells (CNE-2Z). Real-time PCR and Western blot were used to detect the expression of ClC-3 at mRNA and protein levels. The distribution of ClC-3 protein in the cells was observed under confocal immunofluorescence microscope. The chloride current was recorded by the patch-clamp technique. RESULTS: IK1 siRNA was successfully transfected into the CNE-2Z cells and knocked down the expression of IK1 potassium. The mRNA expression of ClC-3 was increased by the IK1 siRNA. IK1 siRNA inhibited the expression of ClC-3 protein. A chloride current was activated by hypotonic challenges, and the hypotonicity-induced current was reduced in the cells which successfully transfected with IK1 siRNA. CONCLUSION: The knockdown of IK1 potassium channels inhibits the expression and function of ClC-3 chloride channel.
[KEY WORDS]ClC-3 chloride channel; IK1 potassium channel; Nasopharyngeal carcinoma; Patch-clamp techniques
通讯作者△Tel: 0313-3042224; E-mail: drduanyonggang@126.com
[收稿日期]2015- 06- 08[修回日期] 2015- 10- 12
[文章编号]1000- 4718(2015)12- 2120- 06
doi:10.3969/j.issn.1000- 4718.2015.12.001
[中图分类号]R730.23; R33-33
[文献标志码]A
