RNAi介导的IGF1R基因沉默对肝癌细胞生长、迁移与侵袭的影响*
2016-01-31别彩群黄秋燕汤绍辉
别彩群, 黄秋燕, 颜 英, 石 珩, 汤绍辉△
(1广州医科大学附属深圳沙井医院消化内科,广东 深圳 518104; 2暨南大学附属第一医院消化内科,广东 广州 510630)
RNAi介导的IGF1R基因沉默对肝癌细胞生长、迁移与侵袭的影响*
别彩群1,黄秋燕2,颜英2,石珩2,汤绍辉2△
(1广州医科大学附属深圳沙井医院消化内科,广东 深圳 518104;2暨南大学附属第一医院消化内科,广东 广州 510630)
[摘要]目的: 研究RNA干扰(RNAi)介导的胰岛素样生长因子1受体(IGF1R)基因沉默对肝癌细胞生长、迁移与侵袭的影响。方法: 设计并筛选抑制IGF1R mRNA表达效率最高的siRNA序列,构建该序列的慢病毒表达载体,转染293T细胞进行病毒包装。将包装好的慢病毒感染Huh7和Hep3B肝癌细胞,筛选沉默IGF1R基因表达的稳定细胞株。将上述稳定细胞株扩大培养,检测细胞IGF1R mRNA表达变化,细胞生长、迁移与侵袭能力变化,以及Ki-67、p-AKT、p-ERK1、Gli1、β-catenin、cyclin D1、p21、BCL-XL的蛋白表达水平变化。结果: 与空白及阴性对照组比较,感染携带IGF1R干扰序列慢病毒的Huh7和Hep3B肝癌细胞IGF1R mRNA表达水平显著下调,细胞增殖活性明显降低,细胞凋亡显著增加,细胞迁移和侵袭能力明显受到抑制,细胞中IGF1R、Ki-67、p-AKT、p-ERK1、Gli1、β-catenin、cyclin D1、p21及BCL-XL蛋白表达水平均显著降低。结论: RNAi介导的IGF1R基因沉默可明显抑制Huh7和Hep3B肝癌细胞生长及恶性生物学特征,这可能与IGF1R表达水平显著下调而引起上述调控细胞增殖、抗凋亡基因以及相关信号通路基因的蛋白表达水平显著降低有关。
[关键词]RNA干扰; 胰岛素样生长因子1受体; 肝细胞癌
胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF1R)是一种酪氨酸激酶跨膜蛋白,由2个α亚单位和2个β亚单位构成。IGF1R广泛表达于多种类型的细胞表面,参与介导胰岛素样生长因子1(insulin-like growth factor 1,IGF1)和主要的IGF2的生物学功能,与细胞的增殖分化、胚胎的发育密切相关[1]。近年研究表明,IGF1R在多种恶性肿瘤包括肝细胞癌(hepatocellular carcinoma,HCC)中的表达水平明显上调,IGF1R的过表达可能成为恶性肿瘤基因治疗的新靶点[2-3]。
RNA干扰(RNA interference,RNAi)是指与靶基因序列同源的双链RNA(double-stranded RNA, dsRNA)所诱导的一种特异性基因沉默现象。本研究构建针对IGF1R基因的小干扰RNA(small interfering RNA,siRNA)前体——短发夹RNA(short harpin RNA,shRNA)的慢病毒载体,感染Huh7和Hep3B肝癌细胞,观察对肝癌细胞生长、迁移与侵袭能力的影响及其机制。
材料和方法
1材料
LipofectamineTMRNAiMAX转染试剂及LipofectamineTM2000转染试剂购于Invitrogen,SYBR Green PCR Master Mix购于TOYOBO,PLVX-shRNA2载体购于Clontech,Annexin V-FITC细胞凋亡检测试剂盒和细胞周期检测试剂盒购于Keygen,TRIzol试剂及细胞增殖检测试剂购于Promega,Huh7和HepG3B肝癌细胞株、HL-7702、293T细胞株购自武汉大学中国典型培养物保藏中心,抗IGF1R、抗Ki-67、抗p-ERK1、抗Gli1、抗p-AKT、抗cyclin D1、抗β-catenin、抗p21、抗BCL-XL及抗GAPDH抗体购于Abcam。
2方法
2.1针对IGF1R基因的siRNA设计与筛选根据 siRNA 设计原则,参照IGF1R mRNA序列设计并合成3对siRNA序列(IGF1R_001、IGF1R_002、IGF1R_003)及1对无任何靶基因的siRNA,即阴性对照siRNA(negative control siRNA, NC siRNA)。培养Huh7肝癌细胞至汇合度为30%~50%,采用LipofectamineTMRNAiMAX转染试剂进行细胞转染siRNA。实验分为4个组,即NC siRNA组和3个实验组(IGF1R_001、IGF1R_002和IGF1R_003),每组设置25 nmol/L、50 nmol/L和100 nmol/L 3个siRNA浓度梯度。转染24 h后,按TRIzol试剂盒说明抽提Huh7细胞总RNA,逆转录合成cDNA并进行定量PCR扩增。IGF1R mRNA上游引物为5’-TTT CCC TTT GGA GTG TAG CT-3’,下游为5’-CAT TGG CTG TGC AGT CAA G-3’,片段长度为180 bp;以18S rRNA为内参照。每个样本同时扩增3 复管,并连续进行3次实验。采用相对定量法( 2-ΔΔCt) 表示目的基因表达量。
2.2针对IGF1R基因的RNA干扰慢病毒载体构建(1)筛选得到的高效沉默IGF1R基因的干扰序列为IGF1R_002:正义链为5’-CUG ACU ACA GGG AUC UCA UdTdT-3’,反义链为5’-AUG AGA UCC CUG UAG UCA GdTdT-3’。IGF1R基因靶序列为5’-CTG ACT ACA GGG ATC TCA T-3’。(2)设计表达IGF1R_002的shRNA序列:上游序列为5’-GATCC CTG ACT ACA GGG ATC TCAT TCA AGA GAT GAG ATC CCT GTA GTC AGT TTT TTT G-3’,下游序列为5’-AATTC AAA AAA ACT GAC TAC AGG GAT CTC ATC TCT TGA ATG AGA TCC CTG TAG TCA GG-3’(上游序列含BamH Ⅰ酶切位点,下游序列含EcoR Ⅰ酶切位点)。(3)双链IGF1R_002制备:将表达IGF1R_002的上游序列与下游序列等体积混合后,沸水浴中煮沸 5 min,然后 72 ℃ 15 min,自然冷却至室温。此时即可与载体连接,或-20 ℃ 保存。(4)取pLVX-shRNA2 载体行BamH Ⅰ与EcoR Ⅰ双酶切,酶切产物与双链IGF1R_002连接,构建成pLVX-shRNA2-IGF1R_002慢病毒载体。重组载体送华大基因公司进行测序分析。
2.3pLVX-shRNA2-IGF1R_002慢病毒包装及滴度测定转染前24 h,调整293T细胞密度(5×106)重新接种于10 cm 细胞培养皿,置于37 ℃、5% CO2培养箱内培养。24 h后,细胞密度达70%~80%时即可用于转染。将各DNA溶液(pLVX-shRNA2-IGF1R_002载体20 μg,pHelper 1.0 载体15 μg,pHelper 2.0 载体10 μg)、LipofectamineTM2000试剂与Opti-MEM 混合均匀,在室温下温育20 min。将混合液转移至293T细胞培养液中,培养8 h后,以PBS液洗涤残余的转染混和物,加入含10%胎牛血清的细胞培养基继续培养48 h。收集细胞上清液,经过离心和过滤收集病毒浓缩液,-80 ℃保存。取其中一支,采用倍比稀释法检测病毒滴度,取最佳病毒滴度做后续实验。
2.4pLVX-shRNA2-IGF1R_002慢病毒感染Huh7和HepG3B肝癌细胞感染前24 h,取对数生长期的Huh7和HepG3B细胞分别按每孔2×105接种于24孔板,置于37 ℃、5% CO2培养箱内培养。24 h后,细胞密度达40%~50%时,加入各组包装好的慢病毒及合适浓度的Polybrene。实验分3组,每组设3个复孔,即pLVX-shRNA2-IGF1R_002慢病毒组(感染pLVX-shRNA2-IGF1R_002的Huh7和HepG3B细胞,简称IGF1R siRNA组)、空载体慢病毒组(感染pLVX-shRNA2空载体的Huh7和HepG3B细胞,简称negative control组)及空白对照组(未感染任何病毒的Huh7和HepG3B细胞,简称blank control组)。感染12 h后弃上清,更换为新鲜的完全培养基,72 h后在倒置荧光显微镜下观察细胞,检测GFP蛋白表达情况,挑选荧光强度大的阳性克隆孔逐级扩大培养,即可得到沉默IGF1R表达的稳定细胞株,用于后续实验。
2.5IGF1R mRNA表达检测培养上述3组细胞,48 h后收集细胞,按TRIzol试剂盒说明抽提细胞总RNA,逆转录合成cDNA并进行实时荧光定量PCR分析。IGF1R mRNA扩增引物同前,采用相对定量法( 2-ΔΔCt) 表示目的基因表达量。
2.6细胞增殖检测取上述3组细胞,调整细胞浓度为1×108/L,分到96孔板,每孔100 μL。收集各个时点的细胞(0 h、24 h、48 h、72 h),加入MTS。孵育4 h后,酶标仪测定 490 nm处吸光度(A)值。
2.7细胞周期检测培养上述3组细胞48 h后,每组离心收集1×106细胞,用PBS洗细胞2次,加入预冷70%乙醇,于4 ℃固定过夜。1 000×g离心5 min收集细胞,用PBS洗细胞1次,加入含50 mg/L溴化丙啶和100 mg/L RNase A的PBS,4 ℃避光孵育30 min,流式细胞仪检测荧光强度。
2.8细胞凋亡检测培养上述3组细胞48 h后,离心收集细胞,用培养基重悬细胞,使其浓度为1×109/L。取0.5 mL细胞悬液,加入1.25 μL Annexin V-FITC,置于室温避光反应时间为15 min。室温1 000×g离心5 min收集细胞,用0.5 mL 预冷的1×结合缓冲液轻轻重悬,加入10 μL 碘化丙啶,置于冰上避光保存,用流式细胞仪检测荧光变化。
2.9细胞迁移和侵袭检测对于细胞迁移实验,取上述3组细胞,计数,调整细胞浓度为1×109/L,取细胞悬液100 μL加入Transwell小室上室,下室加入600 μL完全培养基。在37 ℃、5% CO2孵育24 h后,取出小室,弃去培养液,用棉签擦去上室未迁移的细胞,4%多聚甲醛固定20 min,0.1%结晶紫染色10 min,PBS洗涤3次并晾干,显微镜下观察 6个视野细胞并拍照计数。对于细胞侵袭实验,首先用Matrigel胶包被Transwell小室底部膜的上室面,置37℃ 30 min使Matrigel聚合成凝胶,使用前进行基底膜水化,其余步骤同迁移实验。
2.10蛋白表达检测培养上述3组细胞48 h后,离心收集细胞,制备细胞总蛋白,BCA法测定蛋白浓度后,行SDS-PAGE,转硝酸纤维素膜,用脱脂奶粉封闭。加入稀释的I抗(抗IGF1R、抗Ki-67、抗p-ERK1、抗Gli1、抗p-AKT、抗cyclin D1、抗β-catenin、抗p21、抗BCL-XL及抗GAPDH)、辣根过氧化物酶标记的Ⅱ抗,增强化学发光显影,凝胶成像系统摄像及分析结果。
3统计学处理
分类资料的比较采用χ2检验,计量资料的比较采用ANOVA或独立样本t检验,应用SPSS 13.0统计软件进行分析,P<0.05为差异有统计学意义。
结果
1针对IGF1R基因的siRNA设计与筛选结果
本研究设计并合成了3对siRNA,即IGF1R_001、IGF1R_002及IGF1R_003,分别转染Huh7肝癌细胞。转染24 h后,荧光定量PCR检测结果显示,转染IGF1R_001、IGF1R_002及IGF1R_003的Huh7细胞中IGF1R mRNA表达量均有不同程度的降低,抑制效率约为31.7%~78.6%,其中IGF1R_002在100 nmol/L浓度时抑制效率最高,达78.6%,将此siRNA用于后续研究。
2慢病毒载体构建、慢病毒包装和滴度测定、稳定细胞株构建结果
根据筛选出的IGF1R_002,设计表达IGF1R_002的shRNA序列,克隆入pLVX-shRNA2 载体,构建成pLVX-shRNA2-IGF1R_002慢病毒载体,测序结果显示插入片段序列正确。将构建好的慢病毒载体及2种病毒包装辅助质粒共转染293T细胞,转染后48 h,在荧光显微镜下观察细胞的转染效率,几乎所有293T细胞均发出较亮的绿色荧光,提示转染效率高,病毒包装成功,见图1。采用倍比稀释法检测病毒滴度为2.78×1011TU/L。将包装好的慢病毒感染Huh7和Hep3B肝癌细胞,挑选荧光强度大的阳性克隆孔逐级扩大培养,得到了沉默IGF1R基因表达的稳定细胞株,见图2。
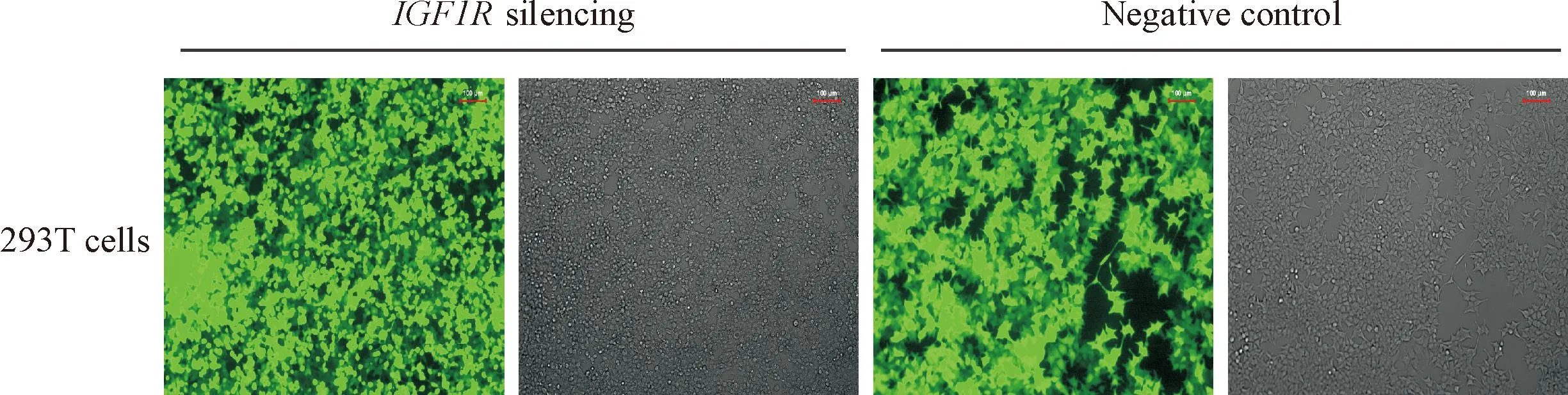
Figure 1.Green fluorescence photographs at 48 h after transfection with pLVX-shRNA2-IGF1R_002 lentiviral vector or negative control vector in 293T cells.
图1pLVX-shRNA2-IGF1R_002慢病毒载体或阴性对照载体转染293T细胞后48 h绿色荧光图
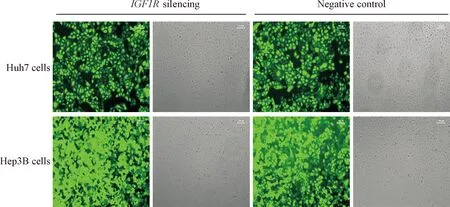
Figure 2.Green fluorescence photographs in Huh7 and Hep3B cell lines with or withoutIGF1Rgene silencing.
图2沉默及未沉默IGF1R基因表达的Huh7和Hep3B稳定细胞株荧光图片
3IGF1R mRNA表达变化结果
图3显示,与正常肝细胞HL-7702相比,Huh7和Hep3B肝癌细胞IGF1R mRNA的表达水平显著上调;感染携带IGF1R干扰序列(IGF1RsiRNA)的慢病毒后,与blank control及negative control组相比较,IGF1RsiRNA 组Huh7和Hep3B肝癌细胞的IGF1R mRNA表达水平明显下调(P<0.01)。
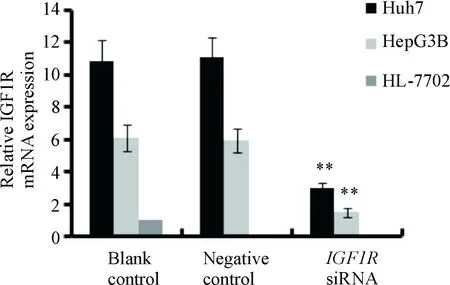
Figure 3.Effect ofIGF1RsiRNA on IGF1R mRNA expression in Huh7 and Hep3B cells. Mean±SD.n=3.**P<0.01vsnegative control.
图3IGF1RsiRNA对Huh7和Hep3B细胞IGF1R mRNA表达的影响
4细胞增殖、细胞周期和细胞凋亡结果
与blank control及negative control组相比较,IGF1RsiRNA 组Huh7和Hep3B肝癌细胞的增殖明显受到抑制,从转染后第1至第3天差异均有统计学意义(P<0.01);G1期细胞比例显著增加,S期细胞比例显著减少(P<0.01);早期、晚期及总凋亡均显著增加(P<0.01),见图4~6。
5细胞迁移和侵袭实验结果
与blank control及negative control组相比较,IGF1RsiRNA 组Huh7和Hep3B肝癌细胞迁移能力和侵袭能力明显受到抑制,差异均有统计学意义(P<0.01),见图7、8。
6Western blot分析结果
与blank control及negative control组相比较,IGF1RsiRNA 组Huh7和Hep3B肝癌细胞IGF1R、Ki-67、p-ERK1、p-AKT、 Gli1、β-catenin、cyclin D1、p21和BCL-XL蛋白的表达水平均显著降低(P<0.01),见图9。
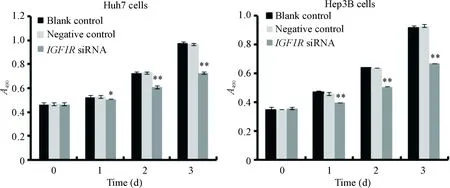
Figure 4.Effect ofIGF1RsiRNA on the proliferation of Huh7 and Hep3B cells. Mean±SD.n=3.*P<0.05,**P<0.01vsnegative control.
图4IGF1RsiRNA对Huh7和Hep3B细胞增殖的影响
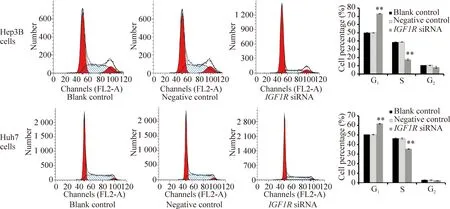
Figure 5.Effect ofIGF1RsiRNA on the cell cycle of Huh7 and Hep3B cells. Mean±SD.n=3.**P<0.01vsnegative control.
图5IGF1RsiRNA对Huh7和Hep3B细胞周期的影响
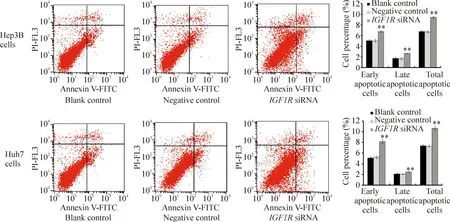
Figure 6.Effect ofIGF1RsiRNA on apoptosis of Huh7 and Hep3B cells. Mean±SD.n=3.**P<0.01vsnegative control.
图6IGF1RsiRNA对Huh7和Hep3B细胞凋亡的影响
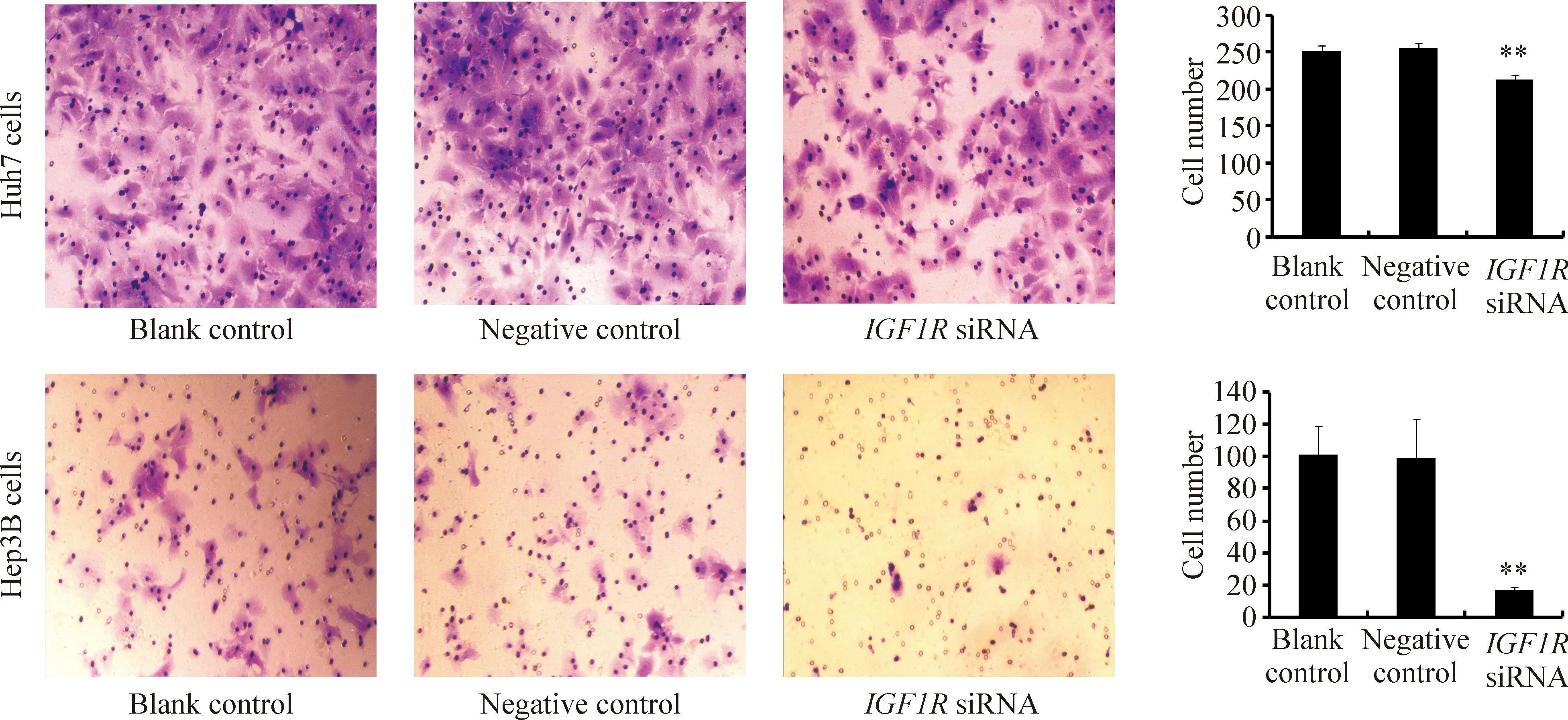
Figure 7.Effect ofIGF1RsiRNA on the migration of Huh7 and Hep3B cells. Mean±SD.n=3.**P<0.01vsnegative control.
图7IGF1RsiRNA对Huh7和Hep3B细胞迁移能力的影响
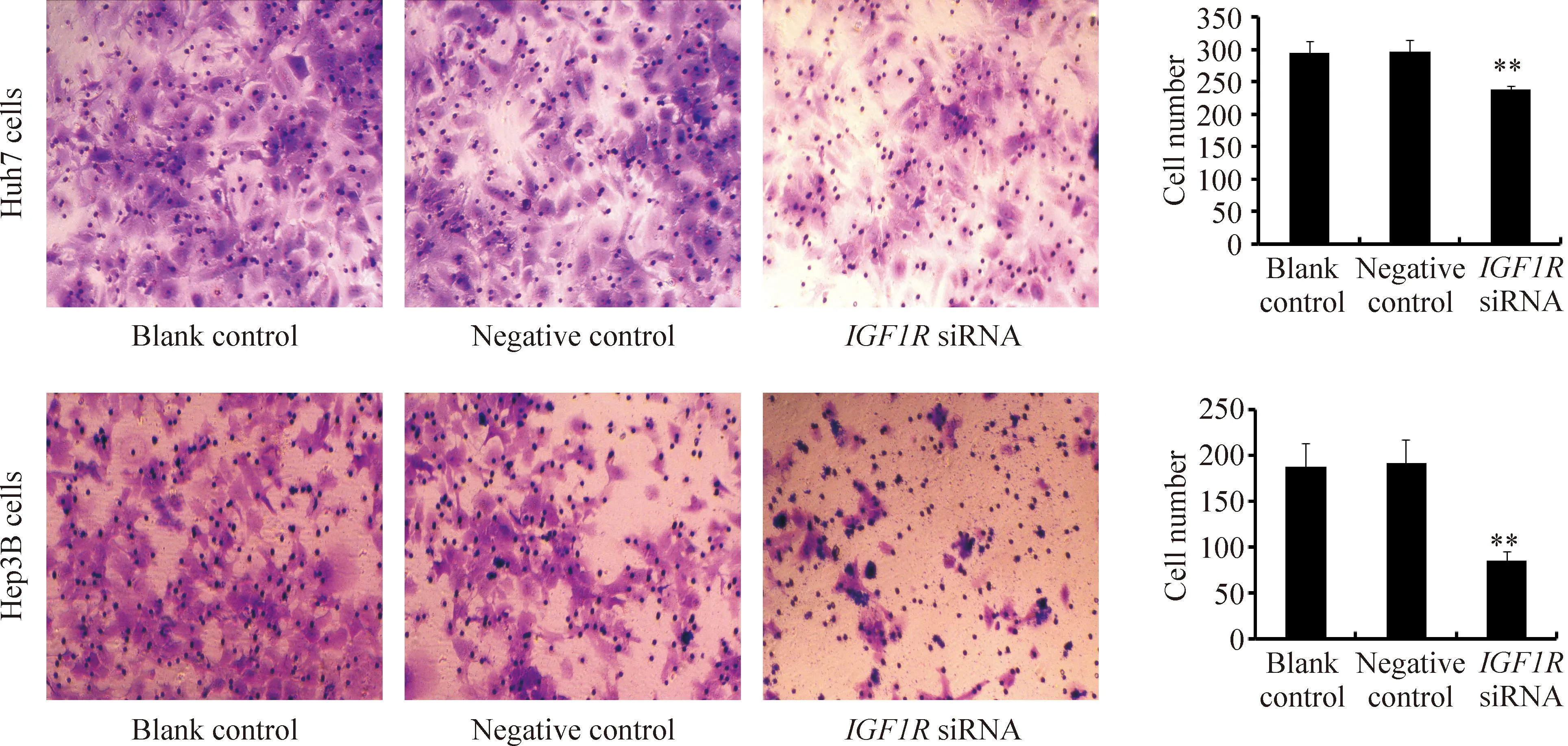
Figure 8.Effect ofIGF1RsiRNA on the invasion of Huh7 and Hep3B cells. Mean±SD.n=3.**P<0.01vsnegative control.
图8IGF1RsiRNA对Huh7和Hep3B细胞侵袭能力的影响
讨论
胰岛素样生长因子轴由IGF1、IGF2、IGF1R、IGF2R、胰岛素受体及IGF结合蛋白组成,它们所介导的信号通路在细胞生长、增殖、分化、凋亡等方面发挥重要作用,其表达异常与多种恶性肿瘤的发生发展密切相关[4]。IGF1R是细胞表面的酪氨酸蛋白激酶受体,它介导IGF1及主要的IGF2生物学功能[5]。研究表明,在HCC中,IGFs的失衡主要表现为IGF2和IGF1R过表达,且IGF2 mRNA 与IGF1R mRNA的表达水平呈正相关。IGF2与IGF1R结合后激活2条信号转导通路,即PI3K/Akt和MAPK,进而促进细胞有丝分裂, 诱导细胞增生,抑制凋亡, 促进肝细胞恶性转化[6-9]。因此,抑制IGF2或IGF1R过表达,干预该通路的活化有可能成为HCC治疗的新靶点[10]。目前,有关应用小分子抑制剂如靶向IGF1R的RNAi, 进行HCC基因治疗的研究非常少,且不够深入。
在本研究中,我们根据siRNA设计原则,设计并合成了3对靶向IGF1R的siRNA序列,分别转染Huh7肝癌细胞,结果筛选出IGF1R_002的抑制效率最高,达78.6%。将表达IGF1R_002的shRNA序列克隆入pLVX-shRNA2 载体,构建成pLVX-shRNA2-IGF1R_002慢病毒载体,经293T细胞包装成功后,检测病毒滴度为2.78×1011TU/L。将慢病毒感染Huh7和Hep3B肝癌细胞,挑选荧光强度大的阳性克隆孔逐级扩大培养,得到了沉默IGF1R基因表达的稳定细胞株。将上述稳定细胞株扩大培养,一系列细胞实验结果显示,感染携带IGF1R干扰序列慢病毒的Huh7和Hep3B肝癌细胞IGF1R mRNA表达水平显著下调,细胞增殖活性明显降低,细胞周期阻滞于G1期,细胞凋亡显著增加,细胞迁移能力和侵袭能力明显受到抑制。这些结果提示,应用RNA干扰技术沉默IGF1R基因表达可显著抑制Huh7和Hep3B肝癌细胞的生长,降低其恶性生物学特征。进一步基因表达检测结果显示,感染携带IGF1R干扰序列慢病毒的Huh7和Hep3B肝癌细胞的IGF1R、细胞增殖相关蛋白Ki-67、PI3K/Akt和MAPK信号通路相关蛋白p-AKT及p-ERK1、Hedgehog信号通路相关蛋白(Gli1)、Wnt/β-catenin 信号通路相关蛋白β-catenin、细胞周期调控相关蛋白cyclin D1及p21、细胞凋亡抑制相关蛋白BCL-XL的表达水平均显著降低。此结果提示:(1)Ki-67、AKT、ERK1、Gli1、β-catenin、cyclin D1、p21及BCL-XL基因可能是IGF1R的下游调控靶基因,一般情况下IGF1R对其可能是正向调控;(2)Huh7和Hep3B肝癌细胞中IGF1R的表达抑制可导致上述基因表达水平显著降低,进而引起Huh7和Hep3B肝癌细胞生长繁殖明显抑制,恶性生物学行为降低;(3)采用RNA干扰技术沉默IGF1R基因表达可能成为HCC基因治疗的一个新靶点。
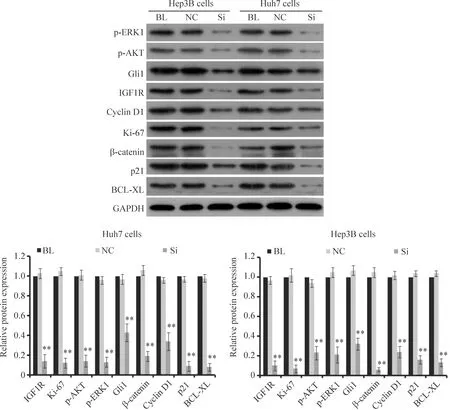
Figure 9.Effect ofIGF1RsiRNA on IGF1R and other protein expression in Huh7 and Hep3B cells. BL: blank control; NC: negative control; Si:IGF1RsiRNA. Mean±SD.n=3.**P<0.01vsnegative control.
图9IGF1RsiRNA对Huh7和Hep3B细胞IGF1R和其它蛋白表达的影响
既往研究显示,多条细胞信号通路的异常活化参与了HCC的发生发展,这些信号通路包括PI3K/Akt、MAPK、Hedgehog、Wnt/β-catenin、IGFs等[11-15]。此外,更为重要的是,在HCC的发生发展过程中,Hedgehog信号通路与PI3K/Akt、MAPK及Wnt/β-catenin信号通路之间存在着重要的交叉对话[15],PI3K/Akt信号通路又可调控Wnt/β-catenin通路[16],而Wnt/β-catenin通路也与PI3K/Akt、MAPK通路之间存在着交叉对话[17]。这些研究结果表明,在HCC中,PI3K/Akt、MAPK、Hedgehog、Wnt/β-catenin等信号通路之间相互影响、相互调控,共同影响肝癌的发生发展。在本研究中,沉默Huh7和Hep3B肝癌细胞IGF1R基因的表达,结果导致上述信号通路中关键分子的表达水平显著下调,表明IGF1R可能调控PI3K/Akt、MAPK、Hedgehog、Wnt/β-catenin信号通路的活性,或提示IGF1R可能先影响上述一至二条信号通路的活性,再进一步通过交叉对话使其它通路的活性发生改变,共同促进肝癌细胞的增殖、迁移和侵袭等生物学行为,目前国内外尚未见相似研究报道。
[参考文献]
[1]Breuhahn K, Schirmacher P. Reactivation of the insulin-like growth factor-II signaling pathway in human hepatocellular carcinoma[J]. World J Gastroenterol, 2008, 14(11):1690-1698.
[2]Singh P, Alex JM, Bast F. Insulin receptor (IR) and insulin-like growth factor receptor 1 (IGF-1R) signaling systems: novel treatment strategies for cancer[J]. Med Oncol, 2014, 31(1):805.
[3]Adachi Y, Yamamoto H, Ohashi H, et al. A candidate targeting molecule of insulin-like growth factor-I receptor for gastrointestinal cancers[J]. World J Gastroenterol, 2010, 16(46):5779-5789.
[4]汤绍辉,吴胜兰,王旷靖,等. hAFP及hTERT双启动子调控的针对人IGF-Ⅱ基因的siRNA特异性抑制人肝癌细胞生长[J]. 中国病理生理杂志,2013,29(8):1422-1427.
[5]Wu XY, Wu ZF, Cao QH, et al. Insulin-like growth factor receptor-1 overexpression is associated with poor response of rectal cancers to radiotherapy [J]. World J Gastroenterol, 2014, 20(43):16268-16274.
[6]Aleem E, Nehrbass D, Klimek F, et al. Upregulation of the insulin receptor and type I insulin-like growth factor receptor are early events in hepatocarcinogenesis [J]. Toxicol Pathol, 2011, 39(3):524-543.
[7]Nussbaum T, Samarin J, Ehemann V, et al. Autocrine insulin-like growth factor-II stimulation of tumor cell migration is a progression step in human hepatocarcinogenesis[J]. Hepatology, 2008, 48(1):146-156.
[8]Alexia C, Bras M, Fallot G, et al. Pleiotropic effects of PI-3′ kinase/Akt signaling in human hepatoma cell proli-feration and drug-induced apoptosis [J]. Ann N Y Acad Sci, 2006, 1090:1-17.
[9]Yan XD, Yao M, Wang L, et al. Overexpression of insulin-like growth factor-I receptor as a pertinent biomarker for hepatocytes malignant transformation[J]. World J Gastroenterol, 2013, 19(36):6084-6092.
[10]Abou-Alfa GK, Capanu M, O′Reilly EM, et al. A phase II study of cixutumumab (IMC-A12, NSC742460) in advanced hepatocellular carcinoma[J]. J Hepatol, 2014, 60(2):319-324.
[11]Whittaker S, Marais R, Zhu AX. The role of signaling pathways in the development and treatment of hepatocellular carcinoma [J]. Oncogene, 2010, 29(36): 4989-5005.
[12]Datta J, Majumder S, Kutay H, et al. Metallothionein expression is suppressed in primary human hepatocellular carcinomas and is mediated through inactivation of CCAAT/enhancer binding protein alpha by phosphatidylinositol 3-kinase signaling cascade[J]. Cancer Res, 2007, 67(6): 2736-2746.
[13]Calvisi DF, Pinna F, Pellegrino R, et al. Ras-driven proliferation and apoptosis signaling during rat liver carcinogenesis is under genetic control[J]. Int J Cancer, 2008, 123(9):2057-2064.
[14]Zhang Y, Wei W, Cheng N, et al. Hepatitis C virus-induced upregulation of microRNA-155 promotes hepatocarcinogenesis by activating Wnt signaling[J]. Hepatology, 2012, 56(5): 1631-1640.
[15]Mishra L, Banker T, Murray J, et al. Liver stem cells and hepatocellular carcinoma[J]. Hepatology, 2009, 49(1):318-329.
[16]Feng Z, Fan X, Jiao Y, et al. Mammalian target of rapamycin regulates expression of β-catenin in hepatocellular carcinoma[J]. Hum Pathol, 2011, 42(5): 659-668.
[17]Wang HX. Wnt/beta-catenin signaling regulates MAPK and Akt1 expression and growth of hepatocellular carcinoma cells[J]. Neoplasma, 2011, 58(3): 239-244.
(责任编辑: 林白霜, 罗森)

*[基金项目]福建省卫生系统中青年骨干人才培养项目(No. 2013-ZQN-JC-2);福建省科技计划重点项目(No. 2014Y0009)
Effect of RNAi-mediatedIGF1Rgene silencing on growth, migration, and invasion of hepatocellular carcinoma cellsBIE Cai-qun1, HUANG Qiu-yan2, YAN Ying2, SHI Heng2, TANG Shao-hui2
(1DepartmentofGastroenterology,TheAffiliatedShenzhenShajingHospital,GuangzhouMedicalUniversity,Shenzhen518104,China;2DepartmentofGastroenterology,TheFirstAffiliatedHospital,JinanUniversity,Guangzhou510632,China.E-mail:tangshaohui205@163.com)
[ABSTRACT]AIM: To investigate the effect of RNA interference (RNAi)-mediated insulin-like growth factor 1 receptor (IGF1R) gene silencing on the growth, migration, and invasion of hepatocellular carcinoma cells. METHODS: The most effective siRNA targeting IGF1R gene was designed and screened. After lentiviral expression vector pLVX-shRNA2-IGF1R carrying the most effective siRNA sequence was constructed, it was transfected into 293T cells and packed into pLVX-shRNA2-IGF1R lentivirus. Huh7 and Hep3B cells were infected with the pLVX-shRNA2-IGF1R lentivirus to screen the positive clone Huh7 cells and Hep3B cells with the lentivirus. These Huh7 cells and Hep3B cells were cultured to analyze the mRNA level of IGF1R, cell proliferation, cell cycle, cell apoptosis, cell migration/invasion, and the protein levels of IGF1R, Ki-67, p-AKT, p-ERK1, Gli1, β-catenin, cyclin D1, p21 and BCL-XL. RESULTS: The mRNA expression of IGF1R in Huh7 cells and Hep3B cells with pLVX-shRNA2-IGF1R lentivirus was significantly reduced. The proliferation of these cells was remarkably inhibited, and the number in G1phase was increased significantly. The percentages of apoptotic cells were increased markedly, and the number of cell migration/invasion was decreased markedly. The protein levels of IGF1R, Ki-67, p-AKT, p-ERK1, Gli1, β-catenin, cyclin D1, p21 and BCL-XL were decreased significantly compared with the blank control group and negative control group. CONCLUSION: The RNAi-mediated IGF1R gene silencing significantly suppresses the growth and the malignant biological characteristics of Huh7 cells and Hep3B cells, which may be involved in the reduced protein levels of the above genes induced by down-regulation of IGF1R expression.
[KEY WORDS]RNA interference; Insulin-like growth factor 1 receptor; Hepatocellular carcinoma
通讯作者△Tel: 0591-88216378; E-mail: hyi8070@126.com
[收稿日期]2015- 06- 15[修回日期] 2015- 09- 24
[文章编号]1000- 4718(2015)12- 2144- 07
doi:10.3969/j.issn.1000- 4718.2015.12.005
[中图分类号]R735; R730.23
[文献标志码]A
