三氧化二砷联合塞来昔布对上皮性卵巢癌细胞的增殖抑制和凋亡诱导作用
2016-01-28薛永飞任中海
张 蕾 薛永飞 任中海
(南阳市中心医院肿瘤内二科,河南 南阳 473000)
三氧化二砷联合塞来昔布对上皮性卵巢癌细胞的增殖抑制和凋亡诱导作用
张蕾薛永飞任中海
(南阳市中心医院肿瘤内二科,河南南阳473000)
摘要〔〕目的探讨三氧化二砷(As2O3)联合塞来昔布(celecoxib)对上皮性卵巢癌细胞的增殖抑制和凋亡诱导作用及其机制。方法以上皮性卵巢癌细胞株(OVCAR-3)为研究对象,As2O3、celecoxib及两药联合作用于细胞株48 h后,噻唑蓝(MTT)法体外检测药物对细胞增殖抑制作用,并采用金正均q值法计算联合用药的q值。采用凋亡染色和流式细胞仪(FCM)检测药物对细胞凋亡和细胞周期影响,蛋白质印迹法(Western印迹)检测Bcl-2和caspase-3凋亡相关蛋白的表达水平。结果As2O3和celecoxib对OVCAR-3细胞呈剂量依赖性的生长抑制作用,As2O3的半数抑制浓度(IC50)为4.00 μmol/L,celecoxib的IC50为40.00 μmol/L;As2O3和celecoxib联合用药后,OVCAR-3细胞的增殖抑制率和凋亡率均大于单药作用组(P<0.05),联合用药的q值>1.15,有显著的协同抗肿瘤效应。 As2O3和celecoxib联合用药后OVCAR-3细胞发生明显的G2/M期阻滞,Bc1-2表达明显下调,而caspase-3表达则明显上调(P< 0.05)。结论As2O3和celecoxib单药对OVCAR-3细胞的生长均有抑制作用,联合用药具有显著的协同作用。As2O3和celecoxib联合用药对于上皮性卵巢癌的药物治疗有重要的应用前景。
关键词〔〕卵巢癌;三氧化二砷;塞来昔布;细胞增殖;细胞凋亡
第一作者:张蕾(1978-),女,主治医师,主要从事肿瘤内科方面的研究。
上皮性卵巢癌近年呈上升趋势,死亡率居首位〔1〕。卵巢癌浸润、转移是造成卵巢癌治疗困难的主要原因〔2〕。三氧化二砷(As2O3)对卵巢癌、膀胱癌、乳腺癌等各种实体瘤有较强的治疗作用,其机制主要为诱导细胞凋亡、提高细胞内活性氧簇(ROS)水平、抑制核因子、清除肿瘤干细胞等〔3,4〕。塞来昔布(celecoxib)是环氧合酶-2抑制剂靶向药物,具有抗感染与抗肿瘤作用。celecoxib的抗肿瘤机制为对肿瘤细胞的增殖抑制和凋亡诱导双重效应。celecoxib对卵巢癌、非小细胞肺癌、前列腺癌等多种恶性肿瘤细胞均具有增殖抑制作用〔5~7〕。临床试验显示,As2O3单药对实体瘤疗效有限,与其他化疗药物联合使用则显示出可观的疗效〔8〕。本研究以上皮性卵巢癌细胞株(OVCAR-3)为研究对象,探讨As2O3联合celecoxib对上皮性卵巢癌细胞的增殖抑制和凋亡诱导作用及其机制。
1材料与方法
1.1细胞系及主要试剂OVCAR-3由中山大学肿瘤防治中心惠赠。1640培养液购自天津海康龙公司,胎牛血清(FBS)购自天津海康龙公司。亚砷酸注射液(主要成分为As2O3和NaCl)购自哈尔滨伊达药业有限公司,Celecoxib标准品(购自白广州优瓦仪器有限公司,纯度99.5%)。胰蛋白酶、噻唑蓝(MTT),二甲基亚砜(DMSO)等(购自Sigma-Aldrich公司),B淋巴细胞瘤-2(Bcl-2),半胱氨酸蛋白酶蛋白-3(caspase-3)、β-肌动蛋白(β-actin)鼠抗人单克隆抗体、羊抗鼠IgG等(购自美国BD公司),丙烯酞胺、十二烷基磺酸钠和聚偏二氟乙烯膜(PDVF)等(购自美国Amresco公司)。蛋白提取试剂盒和化学发光检测试剂盒(购自上海生工生物工程有限公司)。高倍显微镜(美国 Leica-M841 型),高速冷冻离心机(美国 Heal Force),流式细胞仪(FCM)(美国 Accuri),快速温度梯度PCR仪(美国 Bio-RAD),荧光定量PCR反应机(美国 Agilent),琼脂糖电泳仪(美国 Bio-RAD),酶联免疫仪(美国 BioTek),37℃ CO2培养箱(上海新苗)。
1.2细胞培养复苏OVCAR-3细胞用含10% FBS的640培养液,置于37℃,5%CO2饱和湿度培养箱中贴壁培养,细胞呈贴壁生长。隔日换液。在倒置显微镜下观察细胞生长情况,每3~4 d用0.25%胰酶消化并按1∶2传代。
1.3药物干预及MTT法检测细胞增殖取对数生长期的细胞,调整浓度至每孔1×104个细胞接种至96 孔板中,细胞贴壁后,常规培养24 h,用含不同浓度药物的培养液继续培养。药物干预方法为As2O3、celecoxib及两药联合三组。As2O3组等比设置1.00、2.00、4.00、8.00、16.00、32.00 μmol/L 6个浓度,celecoxib组等差设置10.0、20.0、40.0、60.0、80.0、100 μmol/L 6个药物浓度,两药联合组设置1.00 μmol/L As2O3+10.00 μmol/L celecoxib、2.00 μmol/L As2O3+20.00 μmol/L celecoxib以及4.00 μmol/L As2O3+ 40.00 μmol/L celecoxib三组。实验均设置空白组,且每孔最终反应体系中DMSO的浓度均小于0.03%。48 h 后,每孔加 MTT 20 μl,继续孵育 4 h后小心吸弃上清液,每孔加入150 μl的DMSO,振荡10 min,在酶标仪上570 nm波长下测定吸光度值A,细胞存活率(M)=药物组A值/空白组A值。实验重复3次。细胞增殖抑制率(E)=〔1-M/(阴性对照组A值-空白组A值)〕×100%。单药实验中,绘制细胞生长曲线,计算各药物作用的半数抑制浓度(IC50)。按金正均q值法公式〔q=E(a+b)/(Ea+Eb)-Ea×Eb〕计算(a为As2O3,b为celecoxib),评价两种药物联合的协同或拮抗效应,q值为0.85~1.15时,两药合呈单纯相加效应,q>1.15时,两药合用具有协同效应,q<0.85时,两药具有拮抗效应。
1.4凋亡染色法检测细胞凋亡取培养的单细胞悬液,计数细胞约为1.5×105,根据细胞表面及细胞内染色步骤进行细胞染色,事先进行染色分组,设置好空白组,EP管中加入As2O3、celecoxib及两药联合药液。用锡箔纸包裹避光放入37℃,CO2培养箱中培养5 h,取出后以2 000 r/min离心5 min,弃上清,冲洗后加入50 μl磷酸盐缓冲液(PBS)后按分组进行Hoechest33258染色,避光在4℃环境下继续培养15 min,倒置荧光显微镜下观察单药及联合作用的细胞凋亡的形态特征,包括细胞体积缩小、核固缩、染色质边集和凋亡小体形成等。
1.5FCM检测细胞凋亡和周期分布OVCAR-3培养24 h后以单药及二者联合用药处理细胞48 h,并设阴性对照。收集细胞,PBS洗涤,用预冷的70%乙醇溶液固定,离心5 min,再用1% 无DNA酶活性的RNA酶(NAase)和碘化丙啶(PI)染液处理,FCM检测凋亡率及细胞周期分布情况。实验重复3次。
1.6Western印迹检测凋亡相关蛋白的表达对数生长期细胞,经单药以及两药联合作用48 h后,常规方法提取总蛋白。设立阴性对照组。行十二烷基硫酶钠-聚丙烯酰胺凝胶(SDS-PAGE)分离蛋白电泳,转移至聚偏氟乙烯(PVDF)膜,室温3% FBS封闭60 min,加入白蛋白稀释的Bcl-2、caspase-3、β-actin抗体,轻摇过夜,TBST(Tris-Hcl,NaCl,tween20)漂洗4次,辣根过氧化物酶标记的羊抗鼠IgG反应60 min,TBST漂洗4次,加入增强化学发光(ECL)试剂反应3 min。以目的蛋白条带的灰度值/内参条带的灰度值表示目的蛋白的相对表达量。
1.7统计学方法应用SPSS19.0软件进行Spearman等级相关检验、χ2检验、t检验,IC50值的计算采用概率单位法。
2结果
2.1对OVCAR-3细胞增殖的抑制作用MTT结果显示,1.00 μmol/L As2O3和10.00 μmol/L celecoxib对OVCAR-3细胞的抑制作用不明显,分别为(5.2±0.9)%、(5.4±0.6)%(P>0.05),16.00 μmol/L As2O3〔(86.7±2.3)%〕、32.00 μmol/L As2O3〔(88.9±2.4)%〕、80.00 μmol/L celecoxib〔(81.1±1.9)%〕、100.00 μmol/L celecoxib〔(83.2±1.9)%〕以及4.00 μmol/L As2O3+40.00 μmol/L celecoxib〔(90.4±2.3)%〕、1.00 μmol/L As2O3+10.00 μmol/L celeooxib〔(56.7±1.7)%〕、2.00 μmol/L As2O3+20.00 μmol/L cellcoxib〔(89.3±2.1)%〕对OVCAR-3细胞的抑制作用减弱(P<0.05)。2.00、4.00、8.00 μmol/L As2O3〔(15.1±1.31)%、(49.5±1.4)%、(83.7±2.1)%〕和20.00、40.00、60.00 μmol/L celecoxib〔(13.7±1.5)%、(50.6±1.2)%、(68.9±1.8)%〕对OVCAR-3细胞均具有显著的剂量依赖性抑制作用(P<0.05),As2O3的IC50值为4.00 μmol/L,celecoxib的IC50为40.00 μmol/L;As2O3联合celecoxib后,OVCAR-3细胞的增殖抑制率均高于同浓度As2O3和celecoxib单药的抑制率(P<0.05)。其中1.00 μmol/L As2O3为11.24%,2.00 μmol/L As2O3为15.1%,10.00 μmol/L celecoxib为8.76%,20.00 μmol/L celecoxib为13.7%,1.00 μmol/L As2O3+10.00 μmol/L celecoxib为56.7%,2.00 μmol/L As2O3+ 20.00 μmol/L celecoxib为89.3%。1.00 μmol/L As2O3+10.00 μmol/L celecoxib联合用药的q值为2.83,2.00 μmol/L As2O3+20.00 μmol/L celecoxib联合用药的q值为3.08。As2O3和celecoxib两药联合作用对OVCAR-3细胞具有显著的协同抗肿瘤效应。
2.2对OVCAR-3细胞凋亡的影响OVCAR-3细胞经不同浓度的As2O3和celecoxib作用后,均能观察到细胞体积缩小、核固缩、染色质边集以及凋亡小体形成等细胞凋亡。As2O3和celecoxib两药联合后凋亡细胞数明显多于As2O3和celecoxib单药组。FCM结果显示,As2O3和celecoxib单药组VCAR-3细胞凋亡率均呈药物浓度依赖性改变。2.00 μmol/L As2O3+20.00 μmol/L celecoxib联合用药后OVCAR-3细胞凋亡率最严重(P<0.05)。见表1。
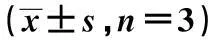
表1 单药以及两药联合对OVCAR-3细胞凋亡的影响
与空白组比较:1)P<0.05;与任一单药比较:2)P<0.05
2.3对OVCAR-3细胞周期的阻滞作用FCM结果显示,OVCAR-3细胞分别经As2O3和celecoxib单独处理后,细胞周期G1和S的影响不明显(P>0.05),而对细胞周期G2/M阻滞明显(P<0.05)。2.00 μmol/L As2O3+20.00 μmol/L celecoxib联合用药后OVCAR-3细胞周期G2/M阻滞最明显(P<0.05),见表1。
2.4对OVCAR-3细胞中凋亡相关蛋白表达的影响Western印迹OVCAR-3细胞经2.00 μmol/L As2O3和40 μmol/L celecoxib单药及1.00 μmol/L As2O3+10.00 μmol/L celecoxib联合作用后,与空白组Bcl-2 0.97,caspase-3 0.85比较,联合用药组的凋亡抑制蛋白Bcl-2表达明显下调,分别为0.57,0.52,0.28;而激活型蛋白caspase-3的表达水平上调,分别为1.42,1.57,2.34(P<0.05)。
3讨论
上皮性卵巢癌是病死率最高的妇科恶性肿瘤之一,目前以手术加化疗为主要治疗手段。化疗在上皮性卵巢癌的治疗中具有举足轻重的地位。国内学者报道,celecoxib与As2O3联合用药对慢性粒细胞白血病原代细胞融合蛋白的表达及相关信号转导通路具有协同抑制作用〔9〕。一般化疗药和抗代谢药物与celecoxib联合应用在如膀肤癌、肝癌和卵巢癌中有报道且疗效较好〔4,5,10〕。
As2O3和celecoxib联合用药的协同机制可能与肿瘤细胞的凋亡机制有关,为验证其作用机制,结果表明,荧光显微镜凋亡染色显示As2O3和celecoxib两药联合后凋亡细胞数明显多于As2O3和celecoxib单药组。通过研究有力证明了在上皮性卵巢癌细胞中As2O3和celecoxib联合用药协同抗肿瘤效应机制与细胞凋亡密切相关。
细胞凋亡与Bcl-2蛋白密不可分,Bcl-2为抗凋亡蛋白,细胞凋亡时Bcl-2表达受到抑制,线粒体膜通透性被破坏,细胞色素C等释放〔11〕。活化caspase-3切割底物使细胞发生凋亡。活化的caspase-3是级联反应中关键的蛋白酶,是多种凋亡途径的共同下游效应部分〔12〕。提示As2O3和celecoxib联合用药诱导肿瘤细胞凋亡时线粒体凋亡通路起到了重要作用。
综上,As2O3和celecoxib单药对OVCAR-3细胞的生长均有抑制作用,联合用药具有显著的协同作用。As2O3和celecoxib联合用药对于上皮性卵巢癌的药物治疗有重要的应用前景。
参考文献4
1Hu Z,Wei TT,Yang M,etal.Diagnostic value of osteopontin in ovarian cancer:a meta-analysis and systematic review 〔J〕.PLoS One,2015;10(5):e0126444.
2高克非,曾根.维生素C对三氧化二砷抑制上皮性卵巢癌增殖的增敏效应研究〔J〕.海南医学,2014;25(16):2350-3.
3李娜,孙朝阳,周波,等.Cdk1在浆液性卵巢癌中的表达及其与化疗耐药及预后的相关性〔J〕.现代生物医学进展,2014;14(8):1467-70.
4高克非,玛艳玲,黄永文,等.三氧化二砷联合塞来昔布对卵巢癌细胞的增殖抑制和凋亡诱导作用〔J〕.肿瘤,2014;34(7):602-8.
5黄艳青,孙辉,李矛,等.塞来昔布增强KB/VCR细胞对长春新碱敏感性与诱导凋亡的相关性研究〔J〕.口腔医学,2015;35(1):6-10.
6Jendrossek V.Targeting apoptosis pathways by Celecoxib in cancer〔J〕.Cancer Lett,2013;332(2):313-24.
7Winfield LL,Payton-Stewart F.Celecoxib and Bcl-2:emerging possibilities for anticancer drug design〔J〕.Future Med Chem,2012;4(3):361-83.
8张维民,杨希才.三氧化二砷抗肿瘤临床运用进展〔J〕.中外医疗,2014;33(26):195-6.
9刘定胜,李玉峰,李敏,等.塞来昔布联合二氧化二砷对慢性粒细胞白血病原代细胞bcr-abl蛋白及信号转导的影响〔J〕.白血病·淋巴瘤,2011;20(12):738-41.
10王绩英,赵雪强,王昌明,等.三氧化二砷通过抑制NF-κB增强TRAIL诱导A549细胞凋亡的作用研究〔J〕.四川大学学报:医学版,2012;43(6):834-8.
11Khodapasand E,Jafarzadeh N,Farrokhi F,etal.Is bax/bcl-2 ratio considered as a prognostic marker with age and tumor location in colorectal cancer〔J〕?Iran Biomed J,2015;19(2):69-75.
12Liu X,He Y,Li F,etal.Caspase-3 promotes genetic instability and carcinogenesis〔J〕.Mol Cell,2015;58(2):284-96.
〔2014-12-09修回〕
(编辑袁左鸣/滕欣航)
通讯作者:任中海(1968-),男,硕士,主任医师,主要从事肿瘤内科方面的研究。
中图分类号〔〕R737.31〔
文献标识码〕A〔
文章编号〕1005-9202(2015)21-6059-03;doi:10.3969/j.issn.1005-9202.2015.21.023
