三氧化二砷对黑色素瘤细胞B16-F10的效应及其分子机制研究
2020-02-25成志强王晓玫
王 洋,成志强,王晓玫,娄 楠
(1.深圳市人民医院(暨南大学第二临床医学院,南方科技大学第一附属医院),广东 深圳518020;2.香港大学深圳医院)
黑色素瘤是起源于神经嵴黑素细胞的具有高度侵袭性的恶性肿瘤,病变早期就可以侵及深部,发生局部淋巴结和/或血行转移,预后较差。过度的紫外线照射是其明确的病因之一,严重威胁到户外活动较多的儿童及青少年人群,发病率呈持续上升趋势[1,2]。恶性肿瘤的传统治疗方式是通过手术、放疗和化疗,但是由于黑色素瘤细胞显示出高侵袭性、耐药性和抗辐射性等特征,晚期患者传统治疗的效果并不理想[3]。随着精准治疗理念的提出,在黑色素瘤分子分型研究中发现约50%的晚期患者存在BRAF(B Rapidly Accelerated Fibrosarcoma)基因突变[4]。针对BRAFV600E突变的抑制剂Vemurafenib,使部分晚期BRAF突变的黑色素瘤患者肿瘤进程得到有效缓解,但该药物易出现短期耐药和肿瘤复发的现象以及诱发皮肤鳞状细胞癌、慢性淋巴细胞性白血病等不良后果不容忽视[5,6]。近年来在肿瘤免疫治疗研究方面,美国FDA于2014-2015年间先后批准PD-1(Programmed Death 1)的抑制剂Nivolumab,用于治疗BRAFV600E突变的晚期不可切除的黑色素瘤患者;CTLA-4(Cytotoxic T- lymphocyte- associated Antigen 4)的抑制剂Ipilimumab,用于Ⅲ期黑色素瘤患者术后的辅助治疗[7,8]。这些用于免疫治疗的药物使部分患者的肿瘤进程得到有效控制,但同样由于耐药和肿瘤复发的迅速产生,副作用的影响以及高额的费用,临床超过半数用药有效的患者不得不选择放弃治疗[9,10]。目前晚期黑色素瘤患者短期迅速耐药的难题亟待解决。
三氧化二砷(arsenic trioxide)早在2000多年前已被我国中医药领域广泛应用,如今作为化疗药物,三氧化二砷已经被成功应用于白血病的治疗中:研究表明砷化物可以诱导白血病中肿瘤细胞的分化,并促进这类细胞自身发生凋亡[11];此外三氧化二砷在其他一些实体肿瘤治疗的实验研究和临床疗效方面,同样取得了显著的进展,包括从体外细胞系研究,进一步过渡到动物体内的移植瘤研究,再逐渐扩展到临床应用,证明其在抗肿瘤这一艰巨且迫切的任务中拥有巨大治疗潜力和广阔的应用前景[12-15]。结合目前黑色素瘤治疗研究所遇到的困难,且三氧化二砷作用于黑色素瘤细胞的相关研究报道并不多见。因此本研究另辟蹊径,拟对三氧化二砷作用于黑色素瘤细胞的效应及相关分子机制进行探讨,可以为晚期黑色素瘤的临床治疗研究提供新的研究方向。
1 材料与方法
1.1 相关材料试剂
小鼠黑色素瘤细胞B16-F10来自于美国ATCC资源中心;H-DMEM培养基购自Gibico公司;胎牛血清购自杭州四季青生物公司;三氧化二砷购自于黑龙江哈尔滨医大药业股份有限公司;CCK8细胞活性检测试剂盒、细胞周期检测试剂盒及Annexin V-FITC/PI检测试剂盒分别购买于上海碧云天生物技术有限公司;提取RNA所用试剂购自于美国赛默飞公司;DNaseI(RNase free)购自于Promega Corporation;逆转录试剂盒及相关PCR引物均来自于宝日医生物技术有限公司;qPCR相关试剂购自爱普拜斯应用生物系统贸易有限公司。
1.2 三氧化二砷对B16-F10细胞的处理
稀释三氧化二砷储存液,配置终浓度分别为:0 μM,5 μM,10 μM,20 μM,40 μM,80 μM的砷化物工作液。在37℃、5% CO2条件下,取细胞培养箱中用含10%FBS的H-DMEM培养基培养的指数增长期的B10-F10细胞,以2.0×105个/ml的细胞密度,接种于所需的6 cm培养皿中,或以2×103个细胞/孔的细胞密度,接种于96孔培养板内,培养24 h后,分别加入不同浓度的三氧化二砷溶液再继续培养24 h,以0 μM组为阴性对照,分别进行后续检测。
1.3 三氧化二砷作用后B16-F10细胞增殖的检测
剂量效应曲线的绘制:取如1.2中所述0 μM,5 μM,10 μM,20 μM,40 μM,80 μM浓度三氧化二砷处理的细胞,分别加入CCK-8溶液(10 μl/孔),于恒温箱内37℃孵育2 h,检测OD490 nm吸光度数值,绘制三氧化二砷作用于B16-F10细胞的剂量效应曲线。时间效应曲线的绘制:另取如1.2中所述0 μM,5 μM浓度三氧化二砷处理的细胞,连续5 d进行检测,并绘制三氧化二砷作用于B16-F10细胞的时间效应曲线。本实验所涉及计算公式:细胞存活率(%)=[实验组平均OD值/对照组平均OD值]×100%;IC50=lg-1[Xm -i(Σp-0.5) ],公式中Xm为设计的最大浓度的对数值;i代表相邻两组浓度对数值之差;Σp表示各组生长抑制率之和,(生长抑制率p (%)=[(对照组平均OD值-实验组平均OD值)/对照组平均OD值]×100%);0.5为经验常数。
1.4 三氧化二砷作用后B16-F10细胞凋亡的检测
取如1.2中所述0 μM,5 μM浓度三氧化二砷处理的细胞,胰酶(不含EDTA)消化后收集细胞,分别加入Annexin V-FITC检测溶液(5 μl/管),避光,4℃孵育15 min后,再次加入PI检测溶液(10 μl/管),避光,4℃孵育,1 h内用流式细胞仪进行检测。 其中设置对照组:Annexin V-FITC和PI均未添加组;只添加加Annexin V-FITC组;只添加PI组;Annexin V-FITC和PI全部添加组。
1.5 三氧化二砷作用后B16-F10细胞周期的检测

1.6 qPCR检测相关基因表达
取如1.2中所述0 μM,5 μM浓度三氧化二砷处理的细胞进行RNA提取(Trizol);OD值的测定(分光光度计),计算RNA浓度[RNA浓度(ug/ul)=OD260×40×稀释倍数];运用RT试剂进行RNA逆转录;PCR引物的选择:小鼠RPL13作为内参,上游序列:5’-CGA GTT GGC TGG AAG TAC C-3’,下游序列5’-CTT CTG GCC TGT TTC CGT AG-3’;小鼠STC1为目的基因,上游序列5’-CTT AAA GTG CAT CGC CAA TGG G-3’,下游序列5’-GCT TCG GAC AAG TCT GTT GTA-3’,运用Sybe Green实时荧光定量PCR反应体系(详见试剂说明书)进行qPCR反应,获得相应的Ct值,通过2(-△△Ct)定量基因的表达(△Ct值=目的基因Ct值-内参Ct值。△△Ct值=5 μM三氧化二砷处理△Ct值-0 μM三氧化二砷处理△Ct值)。
1.7 统计学处理
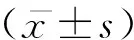
2 结果
2.1 三氧化二砷抑制B16-F10细胞增殖
肿瘤的发生最直观的体现就是生长失控,与肿瘤细胞异常增殖密切相关。我们发现不同浓度的三氧化二砷作用于B16-F10细胞后,细胞增殖程度均被不同程度的抑制,如图1A所示,在5 μM的三氧化二砷作用下,细胞的增殖率明显下降(P<0.05),细胞增殖率随着砷化物剂量的增加,下降越明显;如图1B所示,在5 μM的三氧化二砷作用24 h即可显著降低细胞增殖率(P<0.05),作用48 h对细胞增殖抑制更为显著(P<0.01),48 h后无显著差别;如表1所示,计算IC50值=65.3±6.5 μM。这些结果表明三氧化二砷在较低浓度(5 μM)作用24 h就可以显著抑制B16-F10细胞的增殖,且砷化物浓度与细胞增殖抑制程度呈剂量效应关系。

图1 三氧化二砷抑制B16-F10细胞增殖
注:A代表不同浓度三氧化二砷作用于B16-F10细胞的剂量效应关系;B代表5 μM三氧化二砷作用于B16-F10细胞的时间效应关系,*P<0.05,**P<0.01。

表1 三氧化二砷抑制B16-F10细胞增殖分析及IC50
注:*P<0.05,**P<0.01。
2.2 三氧化二砷促进B16-F10细胞的凋亡
化疗药物杀伤肿瘤细胞的重要机制之一就是诱发细胞凋亡。本研究同时检测了三氧化二砷作用下B16-F10细胞的细胞凋亡情况。如图2所示,我们发现在5 μM的三氧化二砷作用下,细胞的凋亡率显著增加(P<0.05);随着砷化物剂量的增加,凋亡率增加越明显;如表2所示,计算IC50值=70.4±3.6 μM。表明较低浓度(5 μM)的三氧化二砷可以显著促进B16-F10细胞的凋亡,且砷化物浓度与细胞凋亡程度呈剂量效应关系。

表2 三氧化二砷促进B16-F10细胞凋亡分析及IC50
注:*P<0.05,**P<0.01。
2.3 三氧化二砷阻断细胞G1→S期进程
为探寻三氧化二砷抑制细胞增殖的作用机制,本研究继续运用利用流式细胞术,检测三氧化二砷(5 μM)处理的B16-F10细胞周期的改变。结果如图3所示,砷化物可以显著减少S期的细胞数量, 并显著增加G0/G1期细胞数量,如表3所示,细胞周期相关的SPF及PI明显减低(P<0.05)。这些结果提示三氧化二砷是通过阻断细胞G1→S期进程,降低细胞增殖的活性。
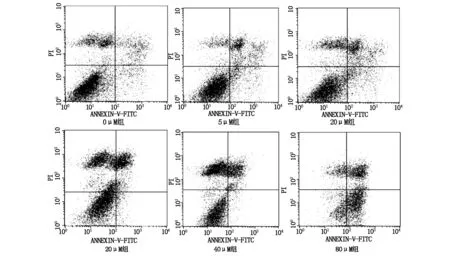
图2.2 三氧化二砷促进B16-F10细胞凋亡
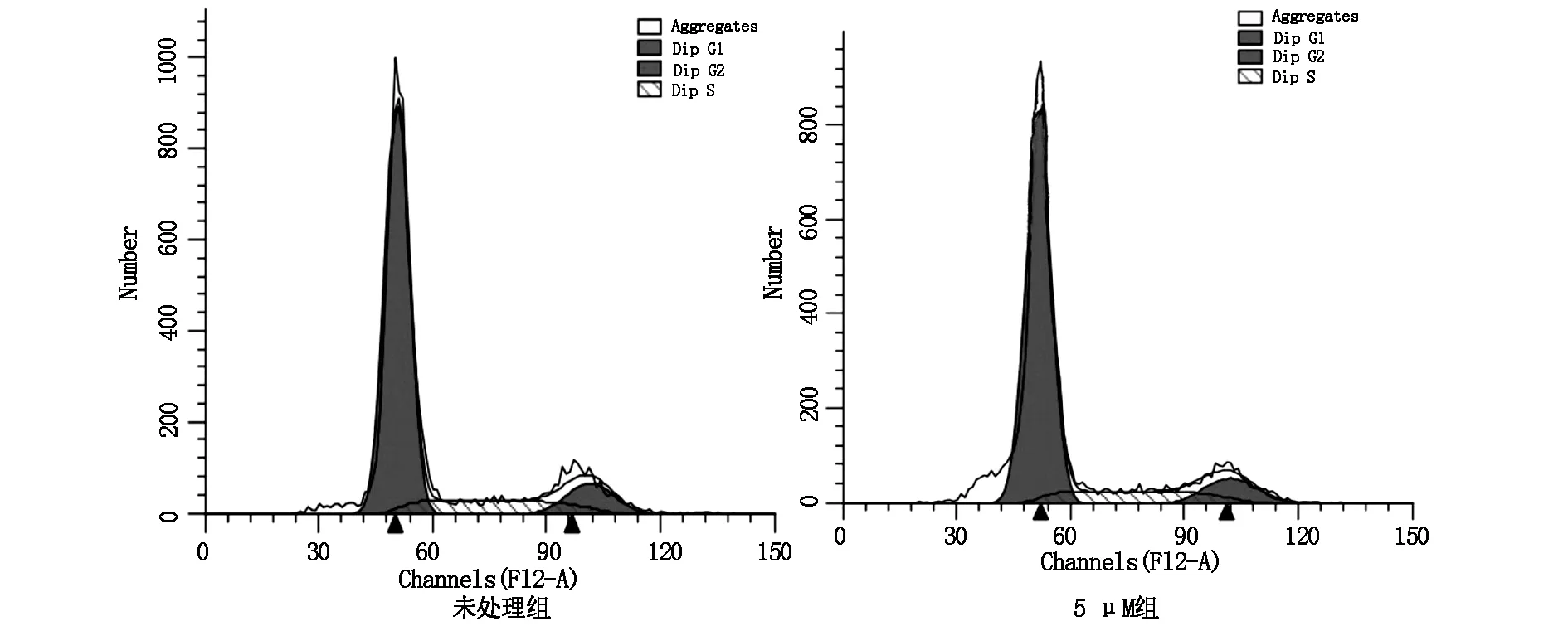
图3 三氧化二砷阻断B16-F10细胞G1→S期进程


组别G0/G1SG2/MSPF(%)PI(%)未处理组72.84±1.415.92±1.211.24±1.315.92±1.127.16±1.55 μM砷处理组78.14±1.512.05±2.69.81±1.412.05±1.6*16.86±1.5*
注:*P<0.05。
2.4 三氧化二砷降低了B16-F10细胞STC1的mRNA水平
为进一步探讨三氧化二砷的作用机制,本研究检测了砷化物作用下B16-F10细胞STC1的mRNA水平,如表4所示。在5 μM浓度的三氧化二砷作用下,斯钙素1(Stanniocalcin-1,STC1)的mRNA表达水平显著下调,为对照组的42.51±5.62% (P<0.01)。该结果提示三氧化二砷对黑色素瘤细胞的作用机制可能与抑制了细胞内STC1的mRNA水平,进而阻断了细胞G1→S期进程,并引起细胞凋亡相关。

表4 STC1的mRNA表达的分析
注:**P<0.01。
3 讨论
尽管晚期黑色素瘤的研究从分子分型到免疫治疗等方面取得了重要进展,在世界范围内发表的探索性科研成果日益增多,但目前患者短期内耐药复发的情况依然存在,尚缺乏安全有效的治疗措施,其根本原因在于靶向杀伤黑色素瘤细胞的相关调控机制尚未清晰,制约了防治研究的进程。
在从白血病到实体瘤的研究中表明三氧化二砷可以直接作用于线粒体,还能绕过线粒体上游的传导阶段,诱导细胞凋亡[14];砷化物还能直接作用于氧化还原酶,引起细胞内活性氧含量增加,进而抑制细胞有丝分裂,并诱导细胞发生凋亡[15];还可以抑制端粒酶活性诱导癌细胞凋亡[16]等等。但目前三氧化二砷对黑色素瘤细胞产生的效应及分子机制的相关研究还并不多见。
本研究发现三氧化二砷在较低浓度(5 μM)作用24 h就可以显著抑制B16-F10细胞的增殖,且砷化物浓度与细胞增殖抑制程度呈剂量效应关系;同时较低浓度(5 μM)的三氧化二砷可以显著促进B16-F10细胞的凋亡,且砷化物浓度与细胞凋亡程度呈剂量效应关系。上述两部分结果共同提示黑色素瘤细胞对三氧化二砷具有较高的敏感性,砷化物在治疗黑色素瘤方面颇具潜力。
进一步研究发现,三氧化二砷(5 μM)可以显著增加G0/G1期细胞数量,并明显减低细胞周期相关的SPF及PI(P<0.05)。这些结果提示三氧化二砷是通过阻断细胞G1→S期进程,降低细胞增殖的活性;在三氧化二砷(5 μM)作用下,STC1的mRNA水平显著下调,为对照组的42.51±5.62%(P<0.01)。STC1作为一种分泌型糖蛋白,通过抑制过氧化物生成,参与调节线粒体功能[17]。STC1在多种肿瘤细胞及其动物模型中都具有促进细胞增殖等作用,可以促进细胞周期G1→S期进程及减少细胞的凋亡[18,19]。由此可见,三氧化二砷对B16-F10细胞的作用机制是抑制细胞内STC1的mRNA水平,阻断了细胞G1→S期进程,引起细胞凋亡。结合本研究的前期工作[12],可以进一步推断在黑色素瘤中三氧化二砷通过抑制细胞内STC1的mRNA水平,影响和改变氧化还原酶的活性,增加细胞内的活性氧,阻断了B16-F10细胞G1→S期进程,引起细胞凋亡,更详细的相关机制是本研究后续将要深入探讨的部分。
综上所述,三氧化二砷可以显著抑制B16-F10细胞增殖并促进细胞凋亡,作为一种潜在的治疗药物,为晚期黑色素瘤的辅助治疗提供新的思路;可能的作用机制是抑制细胞内STC1的mRNA水平,阻断了细胞G1→S期进程,引起细胞凋亡,提示STC1可以作为黑色素瘤治疗的靶点,值得进一步研究。
