AngⅡ上调Th17/白细胞介素-17表达对兔动脉粥样硬化形成的影响
2016-01-28谢家和谢东明廖祥中朱金海张古老
谢家和 谢东明 廖祥中 朱金海 张古老
(赣南医学院第一附属医院心内二科,江西 赣州 341000)
AngⅡ上调Th17/白细胞介素-17表达对兔动脉粥样硬化形成的影响
谢家和谢东明廖祥中朱金海张古老
(赣南医学院第一附属医院心内二科,江西赣州341000)
摘要〔〕目的观察Th17/白细胞介素(IL)-17对兔动脉粥样硬化形成的影响。方法通过导管球囊损伤动脉血管加高脂饲养的方法建立兔动脉粥样硬化模型。22只新西兰大白兔随机分为正常对照组、高脂组、贝那普利组。饲养12 w后,检查兔动脉粥样斑块的大小、血脂水平、血浆血管紧张素(Ang)Ⅱ、IL-17、超敏C-反应蛋白(hs-CRP)水平。结果成功建立起兔动脉粥样硬化模型;高脂组、贝那普利组总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、极低密度脂蛋白胆固醇(VLDL-C)及血浆AngⅡ、IL-17、hs-CRP表达水平明显高于正常对照组(P<0.05);贝那普利组血浆AngⅡ、IL-17、hs-CRP表达水平明显低于高脂组(P<0.05),血脂水平(TC、LDL-C、VLDL-C)表达没有差异(P>0.05),血浆AngⅡ与IL-17水平呈正相关(P<0.05),血浆IL-17与hs-CRP水平呈正相关(P<0.05)。结论AngⅡ会促使动脉粥样硬化的形成,其一个机制可能为AngⅡ上调Th17/ IL-17表达, Th17/ IL-17可能通过引起和加剧机体炎症反应参与动脉粥样硬化的发生、发展。
关键词〔〕血管紧张素(Ang)Ⅱ;动脉粥样硬化;Th17/白细胞介素(IL)-17;超敏C-反应蛋白(hs-CRP)
第一作者:谢家和(1985-),男,住院医师,主要从事动脉粥样硬化研究。
动脉粥样硬化(AS)是心脑血管疾病中最常见的疾病,严重危害人类尤其是老年人的健康,其导致心脏缺血、心肌梗死、脑卒中等心脑血管疾病的发生〔1〕。研究报道,血管紧张素Ⅱ(AngⅡ)在AS发生、发展中有重要作用〔2,3〕,对AngⅡ导致AS的发生确切机制尚未完全阐明。最近有研究报道,Th17/白细胞介素(IL)-17功能的异常与AS发生密切相关,但其对AS具体影响有一定争议〔4,5〕,本文拟观察Th17/IL-17在AS的表达及其是否介导AngⅡ参与AS的形成。
1材料和方法
1.1主要试剂AngⅡ放射免疫分析试剂盒购于北方生物技术研究所,贝那普利(北京诺华制药有限公司)购于赣州市华尔康大药房,IL-17、超敏C-反应蛋白(hs-CRP)酶联免疫检测试剂盒购于生工生物工程有限公司。
1.2实验动物及饲料新西兰雄性大白兔,体重(2.0±0.2)kg,3~4月兔龄,购于赣州畜牧研究所,合格证号:0000236;普通饲料购于赣州畜牧研究所,高脂饲料购于北京博泰宏达生物技术有限公司。
1.3兔AS模型新西兰大白兔在适应性饲养1 w后行导管球囊(导管球囊来源于医院废弃导管球囊经消毒处理)损伤兔左侧颈总动脉,具体操作参考文献〔6〕介绍的方法同时给予高脂饲料饲养,高脂饲料配方参照于丽娜等〔7〕介绍的方法:1%胆固醇+5%猪油+10%蛋黄粉+84%普通饲料。饲养满12 w后用超声探查左侧颈总动脉斑块是否形成判断模型成功与否的标志。
1.4实验分组、饲养与给药22只兔随机分正常对照组6只,造模兔16只;造模兔行导管球囊损伤左侧颈总动脉后,随机分为高脂组,贝那普利组。①正常对照组,每只兔饲养普通饲料100 g/d,早晚各50 g。②高脂组,每只兔饲养高脂饲料100 g/d,早晚各50 g,并定时按2 mg ·kg-1·d-1行生理盐水灌胃。③贝那普利组,每只兔饲养高脂饲料100 g/d,早晚各50 g,并定时按2 mg ·kg-1·d-1行贝那普利灌胃。
1.5造模成功后实验兔的血浆、血清及组织的提取兔AS模型成功后,禁食不禁水24 h后,通过空气栓塞处死兔,取右心房血装入抗凝管、促凝管及AngⅡ专用管,30 min内离心,保存于-80℃冰箱用于做相关检测,解剖兔主动脉、左颈动脉等组织、清洗后,保存于-80℃冰箱做相关检测。血脂水平由我院检验科帮助完成;取兔主动脉粥样硬化组织常规固定,石蜡包埋,连续切片,切片的厚度约5 μm,做常规HE染色,在光学显微镜下观察各组兔动脉组织HE切片形态变化;血浆AngⅡ的检测严格按照放射免疫分析试剂盒说明书操作步骤;血浆IL-17、hs-CRP的检测严格按照酶联免疫检测试剂盒说明书操作步骤。
1.6统计学方法采用SPSS19.0软件行t检验、单因素方差分析及SNK-q检验;相关性分析采用线性回归相关性分析。
2结果
2.1各组实验兔主动脉内膜组织肉眼观及HE病理切片观察正常对照组兔主动脉内膜肉眼观为内膜光滑、平整、没有油脂状物质增生;高脂组兔主动脉内膜肉眼观为内膜可见一层油脂状物质,表面凹凸不平,突出管腔明显;贝那普利组兔主动脉内膜肉眼观为内膜可见一层油脂状物质,表面凹凸不平,突出管腔,较高脂组比较,病变程度减轻。见图1。正常对照组兔主动脉病理切片为内膜光滑,平整,无泡沫细胞;高脂组兔主动脉病理切片为内膜增生明显,大量泡沫细胞堆积,胶原、钙化及脂质沉积,斑块破裂;贝那普利组兔主动脉病理切片为内膜增生明显,胶原沉积、钙化及脂质沉积,与高脂组比较,病变程度减轻。见图2。
2.2血脂水平饲养12 w后检测各组兔的血脂水平总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、极低密度脂蛋白胆固醇(VLDL-C),正常对照组、高脂组、贝那普利组血脂水平差异显著(P<0.05);高脂组和贝那普利组与正常对照组之间差异显著(P<0.05),见表1。
2.3血浆AngⅡ水平的表达正常对照组、高脂组、贝那普利组血浆AngⅡ差异均有统计学意义(P<0.05);见表1。
2.4血浆IL-17水平的表达正常对照组、高脂组、贝那普利组间血浆IL-17差异均显著(P<0.05),见表1。
2.5血浆hs-CRP水平的表达正常对照组、高脂组、贝那普利组之间血浆hs-CRP水平有统计学差异(P<0.05),见表1。
2.6血浆AngⅡ水平与IL-17水平的相关性血浆AngⅡ水平与IL-17水平呈正相关(r=0.79,P<0.05)。见图3。
2.7血浆IL-17水平与hs-CRP水平相关性血浆IL-17水平与hs-CRP水平呈正相关(r=0.74,P<0.05),见图4。

图1 各组兔主动脉内膜大体标本
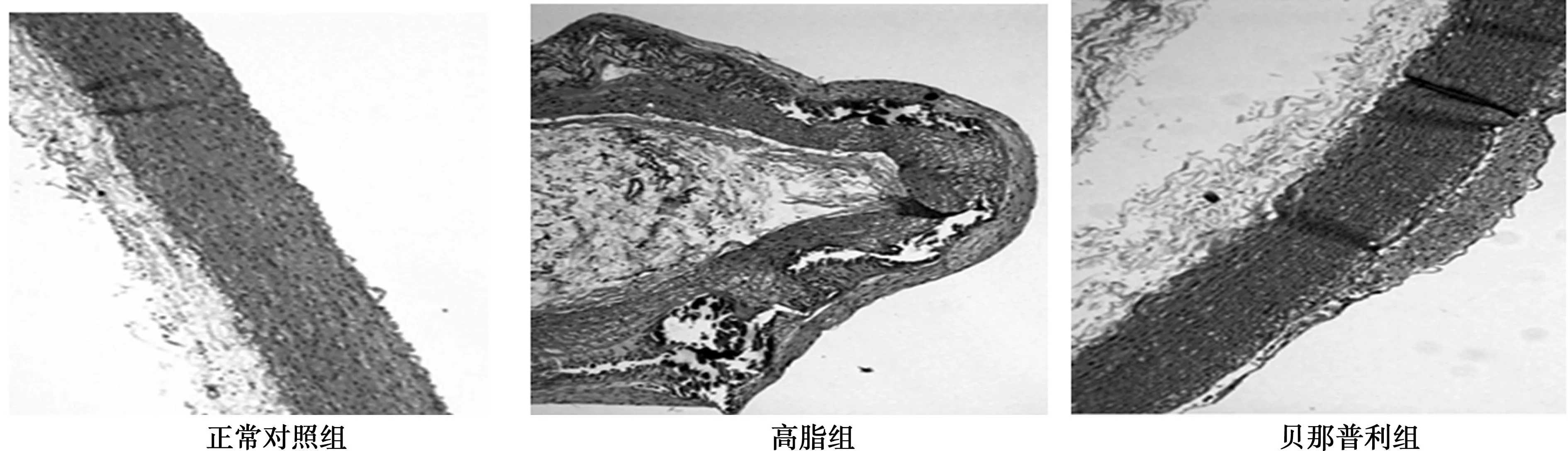
图2 各组兔主动脉内膜病理学观察(HE,×200)

组别nTC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)VLDL-C(mmol/L)AngⅡ(pg/ml)IL-17(pg/ml)hs-CRP(pg/ml)正常对照组61.29±0.711.16±0.680.51±0.150.65±0.500.67±0.161238.32±125.6096.99±28.290.96±0.42高脂组829.1±1.861)5.89±5.911.19±2.6619.0±1.031)8.02±2.781)1554.38±32.231)221.50±36.541)21.91±5.021)贝那普利组828.7±1.501)6.64±5.692.42±2.4516.7±4.371)6.93±2.911)2)1419.76±32.781)157.05±41.681)2)13.23±4.021)2)
与正常对照组比较:1)P<0.05,与高脂组比较:2)P<0.05

图3 血浆AngⅡ水平与IL-17水平相关性

图4 血浆IL-17水平与hs-CRP水平相关性
3讨论
Th17细胞是在研究自身免疫性疾病过程中逐渐被发现的一类新的效应性CD4+T细胞亚群,Th17细胞在IL-6、转化生长因子(TGF)-B、IL-21、IL-23等因子作用下由初始CD4+T细胞分化而来〔8,9〕。Th17能够分泌IL-17A、IL-17B、IL-17C、IL-17D、 IL-17F、IL-22以及肿瘤坏死因子(TNF)-α等细胞因子,以分泌IL-17为特征,通常说IL-17一般指IL-17A,维甲酸相关核孤儿受体tγ(ROR-γt)是Th17细胞特异的转录因子,是控制Th17细胞分化的关键性转录因子。Th17细胞的功能主要体现在分泌因子IL-17上,IL-17的功能研究主要集中在IL-17A,其他的亚型研究很少〔10,11〕。IL-17是一个前炎性因子,其主要效应细胞为表皮细胞、内皮细胞、成纤维细胞、淋巴细胞等。
本实验结果推测,Th17/IL-17可能会促使AS形成。国外有报道,在AS ApoE(-/-)小鼠模型中,发现其动脉斑块IL-17、 ROR-γt的mRNA水平与对照组有明显升高,且Th17细胞增加的水平与斑块的大小成正相关,中和性抗体IL-17Ab能减轻其斑块的发展,并使斑块更加稳定〔12〕。在急性冠脉综合征患者的外周血中Th17比例,IL-17的蛋白和 mRNA 水平都比健康对照组有明显升高〔13〕。也有一些研究得出不一致的研究结果,有研究认为Th17/IL-17就有抗AS作用,Taleb等〔14〕研究发现小鼠中(SOCS-3)细胞因子3信号抑制物的失活增加了IL-17A和IL-10的产生,减少了自身免疫反应表型的巨噬细胞,进而减轻了炎症反应及减少了斑块的形成。导致各个研究之间差异的原因很多,可能与采血时间、试剂的厂家及使用方法等不同有关,而研究者也指出,IL-17 家族因子的作用可能依赖疾病所处的阶段和是否处于活动期等因素有密切的关系〔15〕。目前有研究认为,Th17/IL-17可能通过NF-κB、MAPK信号途径诱导下游IL-6、hs-CRP等炎性因子表达升高,参与AS的形成。IL-17 能通过NF-κB信号激活支气管上皮细胞分泌IL-6、hs-CRP、CXCL-1,-2,-3,-5等炎性、趋化因子,引起和加剧机体炎症反应,导致相关疾病的发生〔16〕。大量研究发现 IL-6、hs-CRP是AS形成的独立危险因子,促使和加快AS形成。本实验结果显示高脂组hs-CRP水平最高,其次贝那普利组,正常对照组最低,通过对hs-CRP与IL-17相关性分析,hs-CRP与IL-17呈明显正相关,差异有统计学意义,因此推测Th17/IL-17促动脉粥样硬化的机制可能与增加hs-CRP等炎性物质表达有关。
AngⅡ与Th17/IL-17之间有密切关系,最近有研究报道,AngⅡ可以上调Th17/IL-17(一类新的效应性CD4+细胞亚群及其分泌因子)表达,给予不同剂量AngⅡ刺激健康人外周血单个核细胞后,Th17细胞比例上升,培养细胞ROR-γt mRNA(维甲酸相关核孤儿受体tγ,是控制Th17细胞分化的关键性转录因子) 表达增加,上清液IL-17水平显著升高,且呈浓度依赖性〔17〕。本实验结果显示,高脂组AngⅡ、IL-17水平最高,其次贝那普利组,正常对照组最低。通过对AngⅡ与IL-17相对比值相关性分析,结果表明IL-17水平与AngⅡ水平相对比值成正相关。因此,本文推测AngⅡ可能通过上调Th17/IL-17表达引起IL-6、hs-CRP等炎性因子升高,参与AS的形成。这些研究结果对预防AS,防止其发生与发展,对防治心脑血管等疾病有一定意义。
参考文献4
1李玉林.病理学〔M〕.北京:人民卫生出版社,2008:113-6.
2Fukui K,Yamada H,Matsubara H,etal.Pathophysiological role of tissue renin-angiotensin aldosterone system (RAAS) in human atherosclerosis 〔J〕.Nihon Rinsho,2012;70(9):1556-61.
3Hirata Y,Fukuda D,Sata M.Critical role of rennin-angiotensin system in the pathogenesis of atherosclerosis〔J〕.Nihon Rinsho,2011;69(1):55-9.
4Soraya Taleb,Alain Tedgui Ziad Mallat.Interleukin-17:friend or foe in atherosclerosis 〔J〕.Curr Opin Lipidol,2010;21(5):404-8.
5Dart ML,Jankowska-Gan E,Greenspan S,etal.Interleukin-17-dependent autoimmunity to collagen type V in atherosclerosis〔J〕.Circ Res,2010;107(9):1106-16.
6Da Cunha V,Tham DM,Martin-McNuhy B,etal.Enalapfl attenuates angiotensin Ⅱ-induced atherosclerosis and vascular inflammation〔J〕.Atherosclerosis,2005;178(1):9-17.
7于丽娜,徐延敏,赵辉.氯沙坦对兔动脉粥样硬化炎症因子的影响〔J〕.中国动脉硬化杂志,2010;18(6):377-8.
8Soraya Taleb,Alain Tedgui,Ziad Mallat.Adaptive T cell immune responses and atherogenesis〔J〕.Curr Opin Pharmacol,2010;21(2):197-202.
9Korn T,Bet E,Gao W,etal.IL-21 initiates an alternative pathway to in duce proinflammatory T(H) 17 cells〔J〕.Nature,2007;448(7152):484-7.
10Park H,Li Z,Yang XO,etal.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17〔J〕.Nat Immunol,2005;6(6):1133-41.
11Harrington LE,Hatton RD,Mangan PR,etal.Interleukin17-producing CD4 effector T cells develop via a lineage distinct from the T heper type 1 and 2 lineages〔J〕.Nat Immunol,2005;6(11):1123-32.
12Gao Q,Jiang Y,Zhang L,etal.A critical function of Th17 pro-inflammatory cells in the development of atherosclerotic plaque in mice〔J〕.Immunol,2010;5(10):5820-7.
13Wang Z,Lee J,Zheng Q,etal.Increased Th17 cells in coronary artery disease are associated with neutrophilic inflammation〔J〕.Scand Cardiovasc,2011;45(6):54-61.
14Taleb S,Romain M,Ramkhelawon B,etal.Loss of SOCS3 expression in T cells reveals a regulatory role for interleukin-17 in atherosclerosis〔J〕.Exp Med,2009;206(10):2067-77.
15De Boer OJ,van der Meer JJ,Teeling P,etal.Differential expression of interleukin17 family cytokines in intact and complicated human atherosclerotic laques〔J〕.J Pathol,2010;220(4):499-508.
16Huang F,Kao CY,Wachi S,etal.Requirement for both JAK-mediated PI3K signaling and ACT1/TRAF6/TAK1-dependent NF-kappaB activation by IL-17A in enhancing cytokine expression in human airway epithelial cells 〔J〕.Immunology,2007;179(10):6504-13.
17吉庆伟.高血压合并颈动脉粥样硬化患者效应性T细胞活性和血管紧张素Ⅱ水平研究〔D〕.武汉:华中科技大学,2010.
〔2014-09-17修回〕
(编辑赵慧玲/曹梦园)
通讯作者:谢东明(1969-),男,主任医师,教授,硕士生导师,主要从事动脉粥样硬化研究。
基金项目:江西省科技厅项目(No.20133097)
中图分类号〔〕R544.1〔
文献标识码〕A〔
文章编号〕1005-9202(2015)21-6030-04;doi:10.3969/j.issn.1005-9202.2015.21.012
