三氧化二砷对人骨肉瘤细胞MG-63增殖和凋亡的影响
2020-05-12张卫华刘思源华长城
张卫华, 刘思源, 华长城
(1.永康市第一人民医院 手外科,浙江 永康 321300; 2.河北医科大学第三医院 骨与软组织肿瘤科,河北 石家庄 050051;3.亳州市人民医院 骨科,安徽 亳州236800)
骨肉瘤在骨科恶性肿瘤中较为常见。骨肉瘤常用化疗药物包括氨甲喋呤、顺铂、阿霉素及异环磷酰胺等。骨肉瘤患者常对化疗药物耐药,放化疗效果欠佳,预后较差[1]。三氧化二砷是中药砒霜的有效成分,我国学者应用砷剂治疗急性早幼粒细胞白血病(APL),疗效显著[2]。目前国内外对三氧化二砷治疗骨肉瘤的研究较少,本研究旨在探讨三氧化二砷(arsenic trioxide, ATO)对人骨肉瘤细胞株MG-63的作用,以期对临床应用提供指导。
1 材料和方法
1.1 主要试剂 DMEM培养基及胎牛血清购自美国Gibco公司,二甲基亚砜(DMSO)、胰蛋白酶-EDTA消化液购自北京索莱宝生物科技有限公司,四甲基偶氮唑蓝(MTT)购自美国Sigma公司,增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、Caspase-3酶原抗体及CyclinE均购自武汉博士德生物工程有限公司,Bax、Bcl-2、CyclinD1均购自SANTA公司,三氧化二砷购自哈尔滨医大药业有限公司(国药准字:H19990191)。
1.2 细胞培养 人骨肉瘤细胞MG-63为河北医科大学第三医院实验中心冻存品。以含有10%胎牛血清的DMEM培养基,在37℃、5% CO2、饱和湿度条件下培养。每2~3 d传代1次,取对数期生长细胞用于实验。
1.3 光镜观察 将MG-63细胞接种于96孔板培养皿中,待细胞贴壁生长至对数生长期,分成对照组(不含药物培养基)及实验组(含8 μmol/L ATO培养基)继续培养,每组设3个复孔,置于倒置相差显微镜下,于24 h及36 h照相观察其形态变化。
1.4 MTT法 取对数生长期的MG-63细胞经胰酶消化后,将细胞调整为1.0×104/ mL,接种于96孔板,培养6~8 h,待细胞贴壁后用于实验。设置对照组(不含药培养基),含不同浓度ATO组(10、8、6、4 μmol/L)。每组设5个复孔,分别培养24、36、48、60 h后,每孔加入MTT液继续培养4 h后加入DMSO,37℃放置10~20 min,采用酶标仪(波长570 nm)测量吸光度,细胞生长抑制率(%)=[1-(A加药-A空白)/(A对照-A空白)]×100%。
1.5 流式细胞术 将MG-63细胞接种在25 mL培养瓶中,待细胞长到80%融合,更换含不同浓度药物的培养基作用36 h,每组3瓶。收集细胞,PBS洗涤,冰预冷的70%乙醇固定、离心,加入碘化丙啶室温避光染色30 min, 用Epics-XLⅡ型流式细胞仪检测细胞凋亡和细胞周期分布。
1.6 蛋白印迹法 MG-63细胞经药物作用36 h后,收集细胞,每瓶细胞加100L含PMSF的裂解液(50 mmol/L Tris-Hcl pH7.4,1 mmol/L EDTA, 150 mmol/L Nacl, 1 mmol/L PMSF),于冰上裂解30 min后,4℃ 12 000 rpm,离心半径10 cm 离心5 min。取上清移于-20℃保存。SDS-PAGE电泳后将蛋白转移至硝酸纤维素膜。含10%小牛血清的TBST室温下封闭1 h后,加入1.5%BSA稀释的一抗PCNA(1∶500)、Cyclin D1(1∶200)、Cyclin E(1∶500)、Bcl-2(1∶200)、Bax (1∶1 000)、Caspase-3(1∶500)孵育过夜。TBST缓冲液洗4次后,加入1.5%BSA稀释的二抗(1∶5 000),孵育1 h。TBST洗4次,ECL化学发光试剂反应2 min,检测条带并照相、分析、保存。
1.7 统计学分析 采用SPSS17.0统计软件,数据采用均数±标准差表示,采用方差分析进行显著性检验,P<0.05为差异有统计学意义。
2 结果
2.1 三氧化二砷对细胞形态的影响 8 mol/L 三氧化二砷处理MG-63细胞24 h、36 h,细胞贴附能力减弱、漂浮细胞增多,并出现细胞皱缩、体积变小、胞质浓缩,最后破裂凋亡等变化。对照组细胞数量多而完整、完全贴壁、胞质均匀、状态良好、无细胞破裂。见图1。
2.2 三氧化二砷对MG-63细胞生长的抑制作用 三氧化二砷可抑制MG-63细胞的生长,其效果与时间和浓度相关,见表1。三氧化二砷对MG-63细胞24、36、48、60 h的IC50分别为12.12、9.29、7.59、6.96 μmol/L。
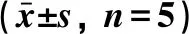
表1 三氧化二砷对MG-63细胞生长的抑制作用
A.对照组;B.8 μmol/L三氧化二砷,24 h; C.8 μmol/L三氧化二砷, 36 h
图1 倒置显微镜观察三氧化二砷作用下MG-63细胞形态学变化(×100)
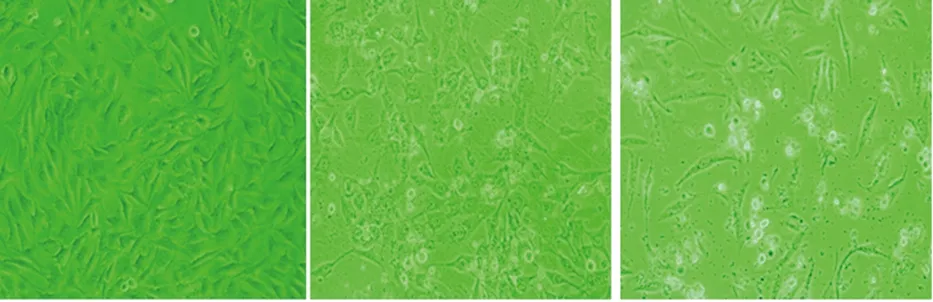
2.3 三氧化二砷对MG-63细胞周期的影响 与对照组G0/G1期细胞比例(32.92±2.01)比较,4 μmol/L三氧化二砷组(12.53 ±1.18)、6 μmol/L三氧化二砷组(2.66±0.44)、8 μmol/L三氧化二砷组(15.13±0.71)、10 μmol/L三氧化二砷组(9.15±0.73)的G0/G1期细胞比例均减少,差异均有统计学意义(P<0.05)。与对照组S期细胞比例(42.45±1.44)比较,4 μmol/L三氧化二砷组(74.42±1.06)、6 μmol/L三氧化二砷组(72.93±1.07)、8 μmol/L三氧化二砷组(52.36±2.33)、10 μmol/L三氧化二砷组(81.48±1.56)的S期细胞比例均增加,差异均有统计学意义(P<0.05)。见图2。
2.4 三氧化二砷对MG-63细胞凋亡的影响 与对照组凋亡率(1.30±0.31)比较,4 μmol/L三氧化二砷组(2.79±0.22)、6 μmol/L三氧化二砷组(13.60±0.91)、8 μmol/L三氧化二砷组(9.58±0.84)、10 μmol/L三氧化二砷组(9.46±1.34)的凋亡率均增加,差异均有统计学意义(P<0.05);三氧化二砷作用后各组细胞均出现凋亡峰。见图2。
A.对照组;B.4 μmol/L三氧化二砷; C.6 μmol/L三氧化二砷; D.8 μmol/L三氧化二砷; E. 10 μmol/L三氧化二砷。
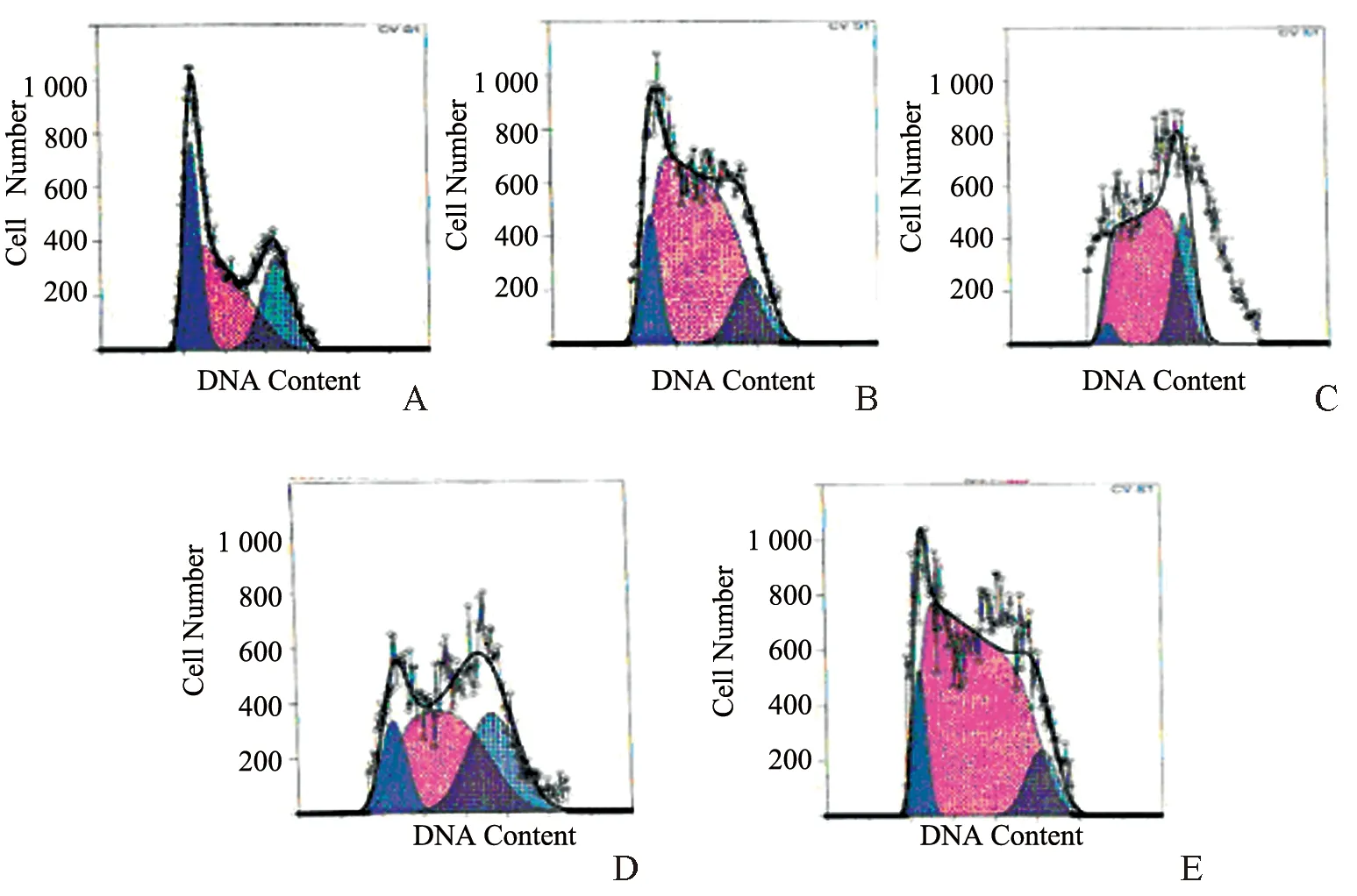
2.5 三氧化二砷对MG-63细胞相关蛋白表达水平的影响 Western blot结果显示,与对照组相比,8 μmol/L 三氧化二砷组处理36 h后的PCNA、Cyclin D1、Cyclin E和Bcl-2蛋白表达降低,Bax、Caspase-3蛋白表达升高,差异均有统计学意义(P<0.05),见图3。
*与control组比较,P<0.05。
3 讨论
骨肉瘤患者常存在肉眼难以察觉的细小转移灶,单纯手术不能解决所有问题[3-5]。骨肉瘤一旦发生转移和复发,一般预后较差[6]。新辅助化疗理念是术前化疗+手术+术后化疗,强调术前化疗6~10周使肿瘤局限,可使部分骨肉瘤患者实现保肢治疗[7-8]。筛选有效的骨肉瘤化疗药物对于实施新辅助化疗非常关键。
Chen等[9]研究表明,三氧化二砷可诱导APL细胞凋亡和部分分化。大量研究表明[10-12],除了对血液系统恶性肿瘤具有抑制增殖和诱导凋亡作用外,三氧化二砷对其他系统肿瘤也具有抑制增殖和诱导凋亡作用。郭卫等[13]研究发现,三氧化二砷对Ⅲ期骨肉瘤、尤文肉瘤患者有较好的近期临床疗效。本研究结果表明,三氧化二砷对MG-63细胞的生长抑制具有剂量-时间效应。Cyclin蛋白通过调节相应的CDKS组成蛋白激酶复合物来实现细胞的复制和增殖。Cyclin D在细胞周期中属正性调节因子,过度的表达可激活CDK-4,促进细胞增殖[14]。细胞增殖的基因扩增引起Cyclin E蛋白表达增强[15]。Cyclin D调节G1进展,Cyclin E是实现G1/S转换。本研究结果显示,三氧化二砷将MG-63细胞阻滞于S期,提示三氧化二砷能干扰MG-63细胞的DNA合成及有丝分裂。
PCNA是细胞DNA合成所需蛋白,其表达、合成与细胞周期关系密切。PCNA在G1期合成增加,S期达到高峰。PCNA常作为测定细胞增殖水平的指标,PCNA表达减少,表明细胞增殖受到抑制。Bcl-2家族是目前研究较多的凋亡相关基因家族,Bcl-2和Bax均属于Bcl-2家族, Bax/Bcl-2比值升高说明促进细胞凋亡,Bax/Bcl-2比值降低说明抑制细胞凋亡。Caspase家族是实现凋亡信号转导的关键蛋白,Caspase3处于Caspase家族完成细胞凋亡信号转导过程中的中心位置,是最主要的终末剪切酶,受上下游蛋白酶的调控。Caspase3表达增强,说明促进细胞凋亡。本研究结果显示,三氧化二砷下调MG-63细胞的PCNA、CyclinD1、CyclinE和Bcl-2蛋白表达,上调Bax、Caspase-3蛋白表达。
综上所述,三氧化二砷对体外MG-63细胞具有抑制增殖和促进凋亡的作用,能下调PCNA、CyclinD、CyclinE和Bcl-2蛋白表达,上调Bax、Caspase-3蛋白表达。
