脂联素抑制脂肪组织MHCⅡ表达及对糖脂代谢的影响
2016-01-12汤爱莲,李灿,邹楠等
脂联素抑制脂肪组织MHCⅡ表达及对糖脂代谢的影响*
汤爱莲,李灿,邹楠,张霞△
(重庆医科大学附属第二医院消化内科,重庆 400016)
[摘要]目的: 探讨脂联素是否通过影响脂肪组织主要组织相容性复合物Ⅱ类(MHCⅡ)的表达调节糖脂代谢。方法: 脂联素基因敲除小鼠(KO)和C57BL/6小鼠 (WT)分别给予高脂饲料或普通饲料,24周后,测量小鼠体重、空腹血糖(FBG)、空腹胰岛素(FINS)、稳态胰岛素评价指数(HOMA-IR)、血清甘油三酯(TG)、血清总胆固醇(TC)、血清低密度脂蛋白胆固醇(LDL-C)和血清高密度脂蛋白胆固醇(HDL-C);行肝脏组织病理形态学评价;检测脂肪组织MHCⅡ反式激活因子(CIITA)、小鼠MHCⅡ抗原Eβ(H2-Eb1)、MHCⅡ恒定链(CD74) mRNA及MHCⅡ相关蛋白质表达水平。用siRNA沉默3T3-L1脂肪细胞中MHC Ⅱ的表达及用过表达载体升高3T3-L1脂肪细胞中的脂联素和(或)MHC Ⅱ的表达,检测脂联素对MHC Ⅱ蛋白水平的影响。结果: 高脂饲料或普通饲料喂养的KO小鼠体重、FBG、FINS、HOMA-IR、TC、TG、LDL-C、肝脂肪变性、脂肪组织中CIITA、H2-Eb1、CD74 mRNA和MHCⅡ蛋白表达水平均高于WT小鼠。在脂肪细胞中,抑制脂联素能够在一定程度上逆转siRNA干扰所引起的MHCⅡ表达降低,过表达脂联素后脂肪细胞中MHCⅡ的表达降低。结论: 脂联素可以通过抑制脂肪组织中MHCⅡ的表达改善糖脂代谢。
[关键词]脂联素; 主要组织相容性复合物Ⅱ类; 糖脂代谢
[中图分类号]R363[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.017
[文章编号]1000-4718(2015)11-2033-06
[收稿日期]2015-05-04[修回日期] 2015-07-07
[基金项目]*山东省自然科学基金资助项目(No.ZR2012HL14); 济南市青年科技明星计划(No.20120145)
通讯作者△Tel: 0531-68616034; E-mail: liuming404@163.com
Protective effect of adiponectin on glucose and lipid metabolism by suppressing MHCⅡ expressionTANG Ai-lian, LI Can, ZOU Nan, ZHANG Xia
(DepartmentsofGastroenterologyandHepatology,TheSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China.E-mail:sunnyzhangx@gmail.com)
ABSTRACT[]AIM: To investigate whether the protective effect of adiponectin on glucose and lipid metabolism is achieved through down-regulating major histocompatibility complex class Ⅱ (MHCⅡ) in the adipose tissue. METHODS: Adiponectin knockout (KO) mice and C57BL/6 (WT) mice were fed with high-fat diet and standard diet for 24 weeks, respectively. The body weight, fasting blood glucose (FBG), fasting insulin (FINS), homeostasis model assessment of insulin resistance (HOMA-IR), triglyceride (TG), total cholesterol (TC), low-density lipoprotein cholesterol (LDL-C), high-density lipoprotein cholesterol (HDL-C), hepatic histology, and class Ⅱ trans-activator (CIITA), histocompatibility 2 class II antigen E beta (H2-Eb1) and cluster of differentiation 74 (CD74) mRNA and MHC II protein levels in adipose tissue were measured at sacrifice. siRNA targeting MHC II and overexpression vector was used in 3T3-L1 cells to explore the effect of adiponectin on the protein level of MHCⅡ. RESULTS: The levels of body weight, FBG, FINS, HOMA-IR, TC, TG, LDL-C, hepatic steatosis, CIITA, H2-Eb1 and CD74 mRNA expression, and MHCⅡ protein expression in the KO mice were higher than those in the WT mice that fed with high-fat diet or standard diet. In 3T3-L1 cells, inhibition of adiponectin reversed MHC II protein level induced by specific siRNA. The expression of MHC II in adipocytes decreased after adiponectin was overexpressed. CONCLUSION: Adiponectin improves glucose and lipid metabolism through suppressing the expression of MHCⅡ in the adipose tissue.
[KEY WORDS]Adiponectin; Major histocompatibility complex class Ⅱ; Glucose and lipid metabolism
脂肪组织不仅是能量储存器,也是内分泌和免疫活性器官。它可分泌多种生物活性因子,其中脂肪细胞表达量最大的脂肪因子——脂联素(adiponectin)在调节全身能量代谢和免疫/炎症平衡中起着重要作用[1]。肥胖和胰岛素抵抗患者中,循环脂联素水平降低[2-3]。研究发现,肥胖患者脂肪细胞中主要组织相容性复合体Ⅱ类(major histocompatibility complex class Ⅱ,MHCⅡ)表达增高。通过介导脂肪组织中淋巴细胞和巨噬细胞的相互作用,MHCⅡ可以造成全身炎症反应和胰岛素抵抗。暴露于高脂饮食的MHCⅡ基因敲除小鼠比野生型小鼠有更高的胰岛素敏感性和血清脂联素水平[4]。目前研究表明,脂联素主要通过激活过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)和腺苷酸活化蛋白激酶 (adenine monophosphate-activated protein kinase,AMPK)增强脂肪酸氧化,降低循环血糖水平,提高胰岛素敏感性[5-6]。而脂联素是否可以通影响脂肪组织中MHCⅡ的表达参与调节糖脂代谢,目前尚没有相关的研究。因此本实验主要探讨脂联素对脂肪组织MHCⅡ表达及糖脂代谢的影响。
材料和方法
1实验动物和细胞
10只雄性、6 周龄、体重16~20 g 的C57BL/6野生型(wild-type,WT)小鼠,由重庆医科大学实验动物中心提供。10只雄性、6 周龄、体重16~20 g以C57BL/6为遗传背景的基因敲除(knockout,KO)小鼠,购自上海南方模式生物研究中心。3T3-L1前脂肪细胞系购自中国医学科学院基础医学研究所细胞中心。实验过程中对动物的饲养和取材均遵守重庆医科大学实验动物管理条列和实验动物保护的相关规定。
2主要试剂
高脂饲料(普通混合饲料86%,猪油12%,胆固醇2%)购自上海斯莱克实验动物有限公司;胰岛素放射免疫试剂盒购自北京原子高科股份有限公司;TRIzol、逆转录 PCR 试剂盒和PCR 扩增试剂盒均购自TaKaRa;CIITA、H2-Eb1和CD74引物由生工生物工程股份有限公司合成;脂联素I抗购自CST;MHCⅡ和CIITA的I抗购自Abcam;β-actin的I抗和辣根酶标记山羊抗兔IgG Ⅱ抗购自武汉三鹰生物技术有限公司。
3主要方法
3.1动物分组和标本取材将WT小鼠随机分为2组:普通饲料组(NWT组)和高脂饲料组(HWT组),将KO小鼠随机分为2组:普通饲料组(NKO组)和高脂饲料组(HKO组),小鼠自由进水、进食。每日观察小鼠摄食及生长情况,每隔2周称量小鼠体重并记录。第24周末,小鼠禁食水12 h后称重,摘除眼球取血并于4 000 r/min 离心15 min后分离出血清保存于-80 ℃冰箱备用,小鼠肝脏及腹腔脂肪用液氮速冻后保存于-80 ℃冰箱备用。
3.2肝脏组织病理形态学检查取小鼠部分肝脏,10%的甲醛溶液固定,石蜡包埋,常规 HE 染色。光镜下观察肝脏组织病理形态学变化。
3.3血清学指标测定按摩小鼠尾静脉,75%乙醇消毒,待干后采血1滴,用快速血糖仪检测鼠尾静脉中葡萄糖浓度。取200 μL血清于全自动放射免疫分析仪上检测空腹胰岛素(fasting insulin,FINS),取500 μL血清于全自动生化分析仪上检测血清甘油三酯(triglyceride,TG)、血清总胆固醇(total cholesterol,TC)、血清高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和血清低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)。
3.4实时荧光定量PCR(real-time PCR)检测脂肪组织中CIITA、H2-Eb1和CD74的mRNA表达水平取80 mg脂肪组织加入液氮研磨,研至粉末状时加入1 mL TRIzol液提取总RNA,将逆转录后的 cDNA 在定量PCR仪上进行实时荧光PCR反应,检测脂肪组织MHCⅡ相关基因的表达。实验中涉及的引物如下所示:Ciita的上游引物为5’-CCACGAGACACAGCAACCT-3’,下游引物为5’-TGCCCAGCACATACACATCT-3’;H2-Eb1的上游引物为5’-TGGACTTCAGCCAACAGGAC-3’,下游引物为5’-GGGATAAACAGCCATCAGGA-3’;Cd74的上游引物为5’-GTGCCTCAGCCCTTCTTATG-3’,下游引物为5’-GACTTCATTTGCCGTGTCCT-3’;内参照甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的上游引物为 5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物 为5’-GGGGTCGTTGATGGCAACA-3’。扩增条件:95 ℃ 1 min,95 ℃ 10 s,60 ℃ 40 s,39 个循环;72 ℃ 7 min,4 ℃保存。Real-time PCR 结果由CFX96 Manager Software软件进行数据分析,以2-ΔΔCt值表示目的基因的相对表达水平。
3.5细胞分组和培养3T3-L1前脂肪细胞系用含10%胎牛血清的H-DMEM培养基于37 ℃、5% CO2的培养箱中孵育。每2天更换培养液1次,细胞达约70%~80% 丰度时,传代或用于实验。siRNA转染细胞分为对照组(control,Con)、siRNA沉默脂联素组(si-Adipo)、siRNA沉默MHCⅡ组(si-MHCⅡ)及siRNA共沉默脂联素和MHCⅡ组(si-Adipo+si-MHCⅡ)。质粒pcDNA 3.1转染细胞分为对照组(pNC)、过表达脂联素组(pAdipo)、过表达MHC Ⅱ组(pMHC Ⅱ)、过表达脂联素和MHC Ⅱ组(pAdipo+pMHC Ⅱ)。
3.6siRNA合成、转染及过表达脂联素和MHC Ⅱ 特异性靶向脂联素以及MHC Ⅱ的siRNA以及阴性对照siRNA,过表达脂联素和MHC II的质粒均由锐博生物科技公司设计合成。HiPerFect转染试剂购自QIAGEN,转染步骤按说明书进行。
3.7Western blot法检测脂肪组织中MHCⅡ和CIITA以及3T3-L1脂肪细胞中脂联素和MHCⅡ的蛋白表达水平取脂肪组织和脂肪细胞加入裂解液裂解,提取总蛋白,用BCA 法蛋白定量。加入电泳加样缓冲液沸水浴中10 min,行 SDS-PAGE 电泳。电转膜仪转膜,将蛋白膜加入Western blot封闭液中,室温封闭1 h;加入MHCⅡ、CIITA、脂联素和β-actin 的 I 抗,4 ℃ 冰箱孵育过夜,洗膜 3 次,Ⅱ抗(HRP-羊抗兔 IgG)37 ℃ 孵育 1 h,ECL 显影。
4统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 19.0统计软件分析,组间均数比较用单因素方差分析,两两比较采用SNK-q检验,以P<0.05 为差异有统计学意义。
结果
1小鼠肝脏组织病理形态学比较
HE染色观察肝脏组织形态学变化,普通饲料喂养的WT和KO小鼠肝组织结构均清楚完整,肝小叶结构正常,肝细胞为多边形排列成索状,在中央静脉周围呈放射状分布。而高脂饲料喂养的WT和KO小鼠肝小叶结构破坏,肝细胞肿大变圆,部分脂滴形成大空泡,将细胞核推挤至细胞一侧,肝细胞排列紊乱,并伴大量肝细胞肿胀,部分呈气球样变,小叶内炎症明显。同给予高脂饲料的KO小鼠肝脏脂肪变性,小叶炎症及肝细胞气球样变比WT小鼠更为明显,见图1。
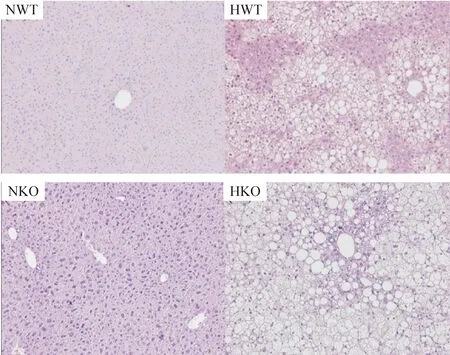
Figure 1.Representative images of the liver sections (HE staining, ×200).
图1各组小鼠肝脏组织HE染色
2小鼠体重和血清生化指标比较
24周后,高脂组KO和WT小鼠均出现明显的肥胖、高血糖、胰岛素抵抗和高脂血症。高脂饲料或普通饲料喂养的KO小鼠体重、空腹血糖、空腹胰岛素、HOMA-IR、总胆固醇、甘油三酯和低密度脂蛋白胆固醇水平均高于WT小鼠 ,见表1。
3小鼠脂肪组织CIITA、H2-Eb1和CD74的mRNA表达水平比较
为了解KO和WT小鼠脂肪组织中MHCⅡ相关基因的变化,我们采用real-time PCR法检测脂肪组织中CIITA、H2-Eb1和CD74 的mRNA表达水平。CIITA为调控MHCⅡ表达的关键分子并协调多种转录因子与 MHCⅡ基因启动子。小鼠主要组织相容性基因H2-Eb1为人HLA-DRB1基因的同源基因。CD74即MHC Ⅱ恒定链参与MHC Ⅱ类分子的形成且与MHC Ⅱ同抗原肽的结合有关。实验结果显示长时间的高脂饮食导致KO和WT小鼠脂肪组织中CIITA、H2-Eb1、CD74的mRNA表达增加,且高脂饲料组KO小鼠脂肪组织中CIITA、H2-Eb1和CD74 的mRNA表达水平明显高于WT小鼠,见图2。

表1 各组小鼠体重和血清生化指标结果的比较
*P<0.05vsNWT group;#P<0.05vsHWT group.
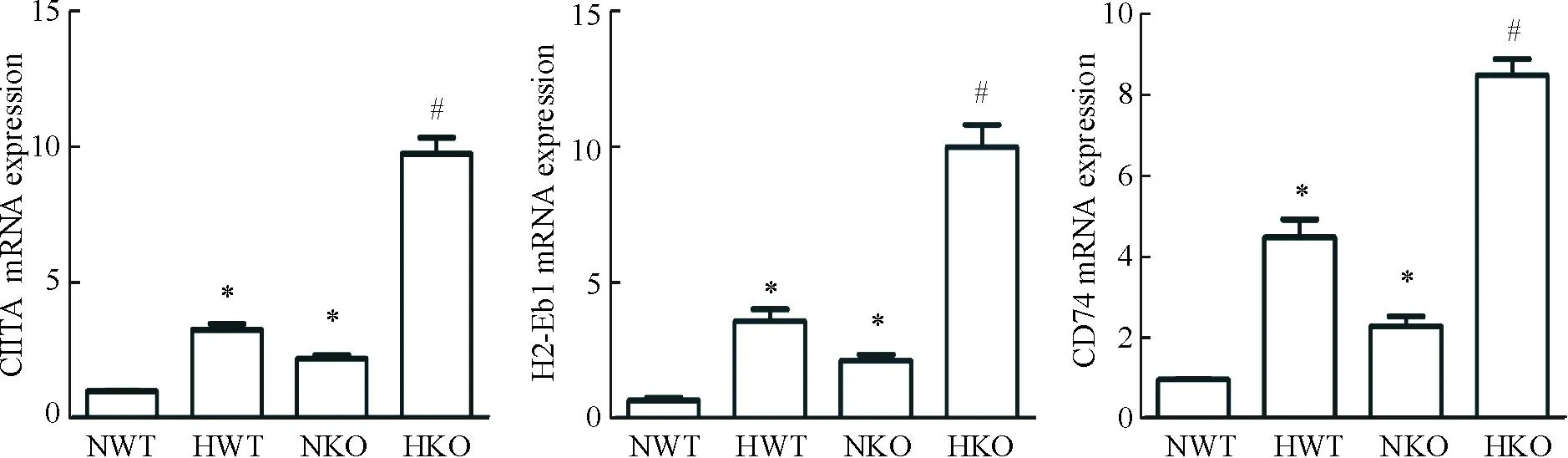
Figure 2.The mRNA expression of CIITA,H2-Eb1 and CD74 in the adipose tissues. Mean±SD.n=5.*P< 0.05vsNWT group;#P<0.05vsHWT group.
图2各组小鼠脂肪组织中CIITA、H2-Eb1和CD74的mRNA表达水平
4小鼠脂肪组织CIITA和MHCⅡ的蛋白表达水平比较
高脂组WT小鼠脂肪组织CIITA和MHCⅡ的蛋白表达水平显著高于普通饲料组,且高脂组KO小鼠脂肪组织MHCⅡ的蛋白表达水平明显高于WT小鼠,见图3。

Figure 3.The protein expression of CIITA and MHCⅡ in the adipose tissues. Mean±SD.n=5.*P< 0.05vsNWT group,#P<0.05vsHWT group.
图3各组小鼠脂肪组织中CIITA和MHCⅡ蛋白表达水平
5脂联素抑制脂肪细胞中MHC Ⅱ的表达
为了检测脂联素对脂肪细胞中MHC Ⅱ表达的影响,我们用特异性靶向脂联素的siRNA干扰细胞中脂联素的表达。沉默3T3-L1细胞中脂联素的表达后,MHC Ⅱ的水平明显升高。同时,我们还筛选了一个特异性靶向MHC Ⅱ的siRNA。结果发现,沉默了3T3-L1细胞中的MHC Ⅱ后,脂联素的水平没有明显改变。在3T3-L1细胞中转染特异性沉默MHC Ⅱ的siRNA 24 h后,更换新鲜培养基,再次共转染靶向脂联素的siRNA,结果si-Adipo能够在一定程度上逆转si-MHC Ⅱ所引起的MHC Ⅱ表达下调。这些结果表明,脂联素能够在脂肪细胞中反向调控MHC Ⅱ的表达,见图4。

Figure 4.The protein expression of adiponectin and MHC Ⅱ in the 3T3-L1 cells transfected with siRNA. Mean±SD.n=5.*P<0.05vsCon group;#P<0.05vssi-MHC Ⅱ group.
图4转染siRNA的3T3-L1脂肪细胞中脂联素和MHCⅡ蛋白表达水平
6过表达脂联素后脂肪细胞中MHC Ⅱ的表达降低
为了进一步确定脂联素对脂肪细胞中MHC Ⅱ表达的影响,我们用过表达载体升高脂肪细胞中脂联素和/或MHC Ⅱ的表达。在3T3-L1细胞中过表达脂联素后,MHC Ⅱ的水平明显降低;然而,过表达MHC Ⅱ后,脂联素的水平没有明显改变。当我们在3T3-L1细胞中同时过表达脂联素和MHC Ⅱ后,脂联素过表达引起的MHC Ⅱ表达降低在一定程度上逆转。这些结果再次表明,脂联素能够在脂肪细胞中反向调控MHC Ⅱ的表达,见图5。
讨论
肥胖为慢性炎症过程,而脂肪组织的慢性炎症在肥胖相关的胰岛素抵抗的发生发展过程中起着重要的作用。相关研究表明肥胖个体脂肪组织中T淋巴细胞的数量增加、活性增强,炎症因子IFN-γ的表达量增加[7]。IFN-γ诱导脂肪细胞MHCⅡ表达增加并介导T淋巴细胞和巨噬细胞相互作用,引起脂肪组织内巨噬细胞聚集并向炎症表型M1极化,最终造成脂肪组织炎症和胰岛素抵抗[4]。高脂饲料喂养MHCⅡ基因敲除小鼠和野生型小鼠, MHCⅡ基因敲除小鼠肝重、肝脂肪变性、血糖、胰岛素、游离脂肪酸水平均低于野生型小鼠[8]。这些提示MHC Ⅱ在肥胖引起的糖脂代谢紊乱中起着一定的作用。
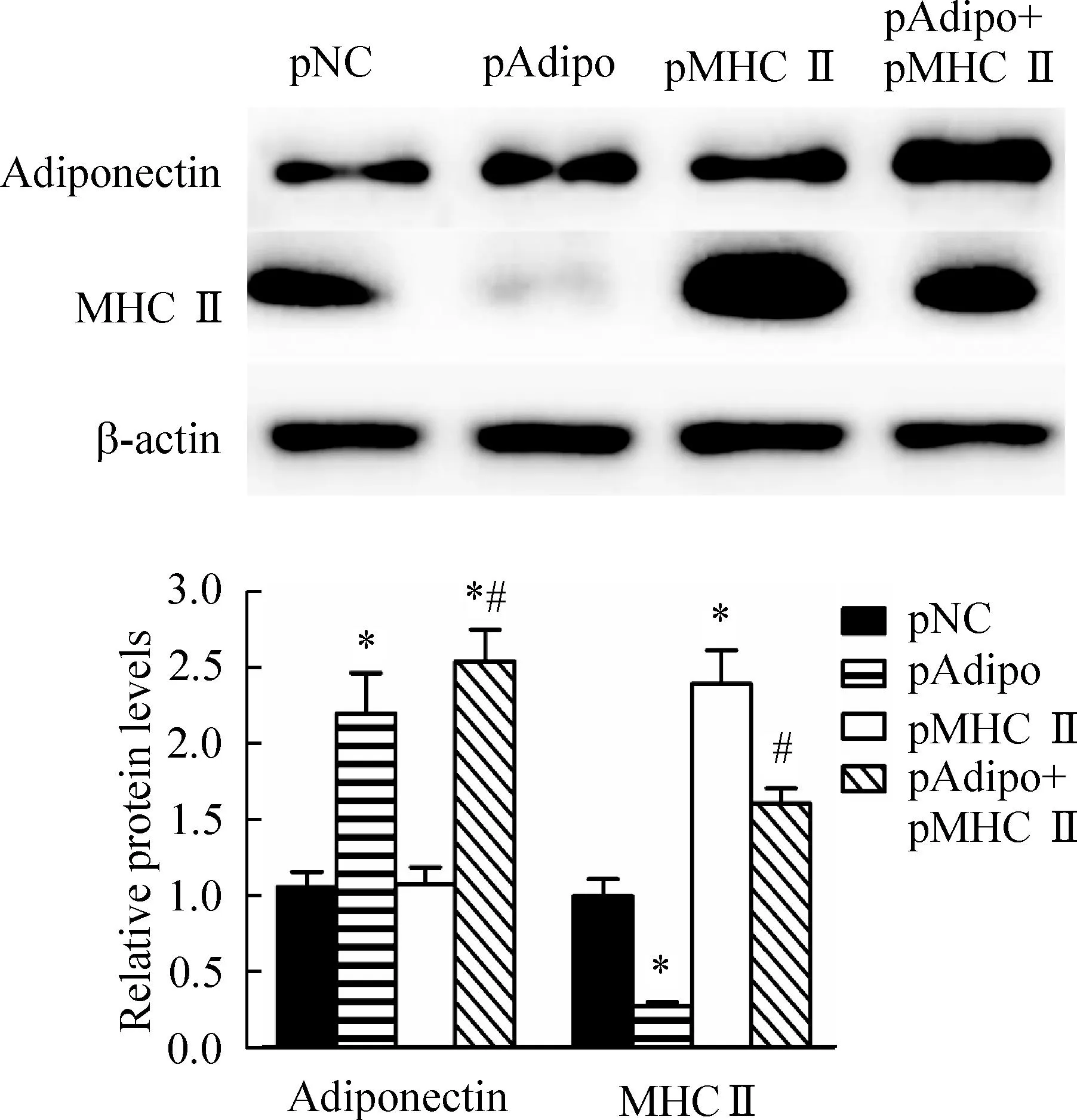
Figure 5.The protein expression of adiponectin and MHC Ⅱ in the 3T3-L1 cells transfected with overexpression vectors. Mean±SD.n=5. *P<0.05vspNC group;#P<0 .05vspMHC Ⅱ group.
图5转染过表达载体的3T3-L1脂肪细胞中脂联素和MHCⅡ蛋白表达水平
脂联素是脂肪细胞分泌的具生物活性的细胞因子,占血浆总蛋白的0.01%。脂联素自发现以来因其调节代谢、抗炎等生理作用备受关注。循环中脂联素水平主要由遗传因素、营养、运动和腹部脂肪决定。肥胖、代谢综合征和心血管疾病患者血清脂联素水平降低[9]。脂联素通过增强脂肪酸氧化和胰岛素敏感性,抑制肝脏糖异生降低循环血糖水平,提高骨骼肌胰岛素敏感性来调节机体的能量代谢[10]。除参与调节新陈代谢外,脂联素也调节免疫反应,可显著抑制抗原特异性的T细胞增殖和巨噬细胞的吞噬活性,促使巨噬细胞向抗炎M2表型极化,减少炎症细胞因子IFN-γ、TNF-α和IL-2的产生及诱导抗炎因子IL-10的产生[11-14]。抗炎因子IL-10调节树突状细胞的功能,主要表现在下调MHC Ⅱ和B7-2的表达[15]。相关研究表明脂联素亦可调节树突状细胞功能使其MHC Ⅱ、IL-12 p40和CD80表达降低[16]。因而推测:脂联素也可抑制脂肪细胞MHC Ⅱ表达,参与糖脂代谢的调节。本实验结果显示:高脂饲料喂养的脂联素基因敲除小鼠同对照组小鼠相比脂肪细胞MHC II mRNA和蛋白表达水平、血糖、血脂、肝脂肪变性、胰岛素抵抗均明显增加。而且,在脂肪细胞中,沉默脂联素的表达可以显著升高细胞中MHC Ⅱ的蛋白水平。然而,MHC Ⅱ的蛋白表达被干扰掉后,脂肪细胞中脂联素的水平没有改变。这一结果提示脂联素可以反向调控MHC Ⅱ的蛋白表达。当细胞中MHC Ⅱ的蛋白被干扰24 h后,重新沉默脂联素的表达,能够明显导致MHC Ⅱ蛋白水平的再次升高。过表表达脂肪细胞中的脂联素后,MHC Ⅱ的水平明显降低,但过表达MHCⅡ后,脂联素的水平并没有明显改变;同时过表达脂联素和MHC Ⅱ后,脂联素过表达引起的MHC Ⅱ表达降低能在一定程度上得到逆转。这些结果均证实,脂联素能够有效抑制MHC Ⅱ的表达。
本研究提示脂联素抑制脂肪组织MHC Ⅱ表达,并改善糖脂代谢,为脂联素治疗肥胖等代谢相关的疾病提供了新的理论依据。但其作用机制还需要进一步研究。
[参考文献]
[1]Guerre-Millo M. Adiponectin: an update[J]. Diabetes Metab, 2008, 34(1): 12-18.
[2]Arita Y, Kihara S, Ouchi N, et al. Paradoxical decrease of an adipose-specific protein, adiponectin, in obesity. 1999[J]. Biochem Biophys Res Commun, 2012, 425(3):560-564.
[3]Hotta K, Funahashi T, Arita Y, et al. Plasma concentrations of a novel, adipose-specific protein, adiponectin, in type 2 diabetic patients[J]. Arterioscler Thromb Vasc Biol, 2000, 20(6):1595-1599.
[4]Deng T, Lyon CJ, Minze LJ, et al. Class II major histocompatibility complex plays an essential role in obesity-induced adipose inflammation[J]. Cell Metab, 2013, 17(3):411-422.
[5]Gualillo O, González-Juanatey JR, Lago F. The emerging role of adipokines as mediators of cardiovascular function: physiologic and clinical perspectives[J]. Trends Cardiovasc Med, 2007, 17(8):275-283.
[6]余慕雪,沈振宇,莫清萍, 等. 早期高蛋白饮食对 SGA 大鼠糖代谢的影响及脂联素-AMPK信号通路在其中的作用[J]. 中国病理生理杂志, 2012,28(10):1812-1818.
[7]Andersson J, Libby P, Hansson GK. Adaptive immunity and atherosclerosis[J]. Clin Immunol, 2010, 134(1):33-46.
[8]Cho KW, Morris DL, Delproposto JL, et al. An MHC II-dependent activation loop between adipose tissue macrophages and CD4+T cells controls obesity-induced inflammation[J]. Cell Rep, 2014, 9(2):605-617.
[9]Ziemke F, Mantzoros CS. Adiponectin in insulin resistan-ce: lessons from translational research[J]. Am J Clin Nutr, 2010, 91(1):258S-261S.
[10]Turer AT, Scherer PE. Adiponectin: mechanistic insights and clinical implications[J]. Diabetologia, 2012, 55(9):2319-2326.
[11]Wilk S, Scheibenbogen C, Bauer S, et al. Adiponectin is a negative regulator of antigen-activated T cells[J]. Eur J Immunol, 2011, 41(8):2323-2332.
[12]Ohashi K, Parker JL, Ouchi N, et al. Adiponectin promotes macrophage polarization toward an anti-inflammatory phenotype[J]. J Biol Chem, 2010, 285(9):6153-6160.
[13]Folco EJ, Rocha VZ, Lopez-Ilasaca M, et al. Adiponectin inhibits pro-inflammatory signaling in human macrophages independent of interleukin-10[J]. J Biol Chem, 2009, 284(38):25569-25575.
[14]Wolf AM, Wolf D, Rumpold H, et al. Adiponectin induces the anti-inflammatory cytokines IL-10 and IL-1RA in human leukocytes[J]. Biochem Biophys Res Commun, 2004, 323(2):630-635.
[15]Buelens C, Willems F, Delvaux A, et al. Interleukin-10 differentially regulates B7-1 (CD80) and B7-2 (CD86) expression on human peripheral blood dendritic cells[J]. Eur J Immunol, 1995, 25(9):2668-2672.
[16]Tsang JY, Li D, HO D, et al. Novel immunomodulatory effects of adiponectin on dendritic cell functions[J]. Int Immunopharmacol, 2011, 11(5):604-609.
(责任编辑: 林白霜, 罗森)

