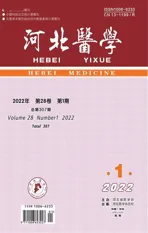
脂联素发挥生物学效应的信号传导机制
2023-01-02梁家立郑德志
任 超, 张 勇, 梁家立, 张 波, 郑德志
(解放军联勤保障部队第九六〇医院心胸外科, 山东 济南 250031)
脂肪组织主要以甘油三酯的形式储存能量。在过去的二十多年里,脂肪组织也被证实是一种重要的内分泌器官,通过分泌多种激素调节各种生理功能。脂联素因其多效性而受到人们的极大关注。研究表明,包括肥胖、糖尿病和动脉粥样硬化在内的各种疾病状态与较低的脂联素浓度相关。已经发现脂联素具有胰岛素增敏、抗炎、抗动脉粥样硬化、抗凋亡、促血管生成和促脂肪生成等生物学作用。本文系统综述脂联素发挥其生物学效应的信号传导机制,为其成为药物开发的临床治疗靶点提供科学指导和理论依据。
1 脂联素的发现及形态结构
1.1脂联素的发现:1995年Scherer等人发表了关于脂联素的初步报告。利用消减cDNA筛选技术,3T3-L1脂肪细胞分化过程中发现了的一种mRNA,其被诱导了100倍以上,进而发现了这种新编码的蛋白质,最初被命名为30kDa的脂肪细胞补体相关蛋白(Acrp30)[1]。1996年,Hu等人利用mRNA差异显示技术分离出一种新的脂肪基因,他们将其命名为AdipoQ;同样在1996年,Maeda等人对人类脂肪组织构建了一个cDNA库,并研究证实脂联素是脂肪组织最丰富的分泌物,并将其命名为apM1。Nakano等人利用明胶的亲和色谱法从人血浆中发现一种新的蛋白质,他们将其命名为28kDa的明胶结合蛋白(GBP28)。GBP28的氨基酸序列显示与Acrp30有82.7%的同源性,可以说Acrp30相当于小鼠的GBP28。
1.2脂联素的形态结构:脂联素是一种30kDa的单体糖蛋白。小鼠脂联素含有247个氨基酸,而人脂联素含由244个氨基酸,两者同源性为83%。脂联素由一个N端信号序列、一个非同源或高变区、一个含有22个胶原重复序列的胶原结构域(8个Gly-X-Pro和14个Gly-X-Y)和一个C端C1q样球状结构域组成。脂联素的N端高变区含有一个半胱氨酸残基(小鼠为Cys-39,人为Cys-36),其后是一个胶原结构域,内含多个的赖氨酸和脯氨酸残基。脂联素主要在脂肪细胞中产生,其中单体蛋白被翻译后修饰成不同的多聚体。大肠杆菌产生的重组脂联素仅由单体脂联素组成,证明脂联素多聚体的形成需要哺乳动物脂肪细胞的翻译加工。哺乳动物产生的脂联素可以利用高速离心沉淀形成多聚体。这些多聚体复合物由三种形式构成:低分子量形式(LMW,三聚体,90kDa),中等分子量形式(MMW,六聚体,180kDa),和高分子量形式(HMW,12~18个单体,360~540kDa)。多聚体的形成依赖于在N末端高变区由Cys-39介导的二硫键的形成,利于脂联素多种生物学作用的发挥[2]。
2 脂联素的表达和分泌
脂联素在血浆中的循环浓度非常高(体重指数BMI<25:男性4~26μg/mL,女性5~37μg/mL-梅奥医学文库),约占血清总蛋白的0.01%~0.05%。这大约比人类的大多数激素(包括瘦素和胰岛素)大三个数量级[3]。循环脂联素浓度存在性别差异,女性的总脂联素和HMW脂联素水平均高于男性,这主要是由于男性体内的睾酮抑制了HMW脂联素的产生。全长脂联素在血清中循环主要以三种形式:三聚体、六聚体和HMW脂联素。这些多聚体具有不同的生理特征,且在血清中不会相互转化。脂联素在血清中的半衰期相对较长(2.5~6h),其分泌存在昼夜变化,白天浓度较高。血浆脂联素浓度受许多因素的影响。大量研究表明,胰岛素可刺激3T3-L1脂肪细胞中脂联素基因表达和分泌。也有报道称在类似的脂肪细胞模型系统中,胰岛素以剂量和时间依赖的方式下调脂联素基因表达。胰岛素样生长因子(IGF-1)和生长激素(GH)可以促进鼠和人脂肪组织中脂联素基因的表达和分泌。瘦素也被证明以剂量依赖的方式增加脂联素mRNA和蛋白质的生成[4]。相反,TNF-α和白细胞介素-6(IL-6)抑制3T3-L1脂肪细胞的脂联素基因表达和分泌。
3 脂联素的生物学功能
经过科研人员20多年的不断努力,基本证实了脂联素的多种生物学功能:①胰岛素增敏作用:脂联素可以促进胰岛素敏感性并降低胰岛素抵抗;②抗炎作用:大量啮齿动物和人类研究表明,脂联素在各种疾病状态下具有抗炎特性,其主要是通过多种方式影响巨噬细胞的功能实现的;③保护血管作用:脂联素通过抑制内皮炎症反应、促使巨噬细胞向泡沫细胞转化和增加血管平滑肌的增殖,产生抗动脉粥样硬化作用;④心脏保护作用:除了通过减轻炎症,脂联素还可以减轻压力超负荷状态导致的心肌肥大,抑制心肌重塑,保护心脏;⑤肾保护作用:脂联素可以降低肾足细胞的氧化应激和白蛋白渗透性,保护肾足细胞免于细胞凋亡;⑥结肠保护作用:脂联素通过促进肠上皮层的存活和结肠的抗炎作用对结肠提供保护;⑦促进创面愈合:脂联素可以刺激角质细胞增殖,并促进伤口愈合。
4 脂联素的信号传导机制
4.1脂联素受体与信号传导:2003年,脂联素受体1和脂联素受体2(AdipoR1,AdipoR2)首次被发现并证明为脂联素受体。AdipoR1在骨骼肌中表达更高,而AdipoR2大多局限于肝脏。AdipoR1是球状脂联素的高亲和力受体,也是全长脂联素的低亲和力受体,而AdipoR2是球状和全长脂联素的中性受体。AdipoR1和R2在结构上相互关联,在蛋白质水平上有67%的同源性。与其他G蛋白偶联受体(GPCRs)相似,AdipoR1和R2都含有7个跨膜结构域。然而,它们在结构和功能上与所有已知的GPCRs相反,脂联素受体的N端位于细胞内,C端位于细胞外。脂联素受体属于孕酮和脂联素Q受体(PAQR)家族[5]。人AdipoR1和R2的结晶表明了一种新的结构类型,其中AdipoR1和R2都有一个由七个跨膜螺旋包围的大空腔[5]。配体和受体的相互作用发生在脂联素的球状结构域和受体的细胞外表面之间。
AdipoR1和R2含有锌结合的催化位点,位于质膜内表面附近[5]。脂联素与AdipoR1和R2的锌结合位点结合,引发一系列下游信号事件,包括骨骼肌、肝脏、心脏、肾脏和胰腺[6]。球状和全长脂联素激活AdipoR1和R2,增加腺苷单磷酸蛋白激酶(AMPK)和p38丝裂原活化蛋白激酶(p38MAPK)磷酸化,增加过氧化物酶体增殖物激活受体α(PPARα)配体活性,导致脂肪酸氧化和葡萄糖利用增加。在基因改造ob/ob小鼠中,腺病毒过表达AdipoR1可以激活AMPK,导致糖异生基因表达减少。腺病毒在ob/ob小鼠中过度表达AdipoR2可增加AMPK活化和PPARα活性。
4.2衔接蛋白APPL1:2006年,发现了一种含有pleckstrin同源结构域、磷酸酪氨酸结合结构域和亮氨酸拉链基序蛋白(APPL1),它可以直接结合到AdipoR1和R2的细胞内区域,被鉴定为脂联素的衔接蛋白。脂联素通过APPL1与AdipoR1和R2结合,介导并激活了AMPK的下游信号,包括葡萄糖摄取和脂质氧化的增加。APPL1通过激活蛋白磷酸酶2A(PP2A)和使蛋白激酶Cζ(PKCζ)失活,来刺激脂联素介导的AMPK激活,使肝激酶B1(LKB1)去磷酸化,这使得LKB1从细胞核转移到胞质并磷酸化AMPK[7]。脂联素还刺激APPL1和Rab5(APPL1下游的一种小GTP酶)和p38MAPK之间的相互作用,导致葡萄糖摄取增加。最近的离体和在体小鼠研究表明,APPL1可以刺激胰岛素和脂联素结合到它们各自的受体上,促进胰岛素受体底物1/2(IRS1/2)与胰岛素受体的相互作用。APPL1基因敲除会损害脂联素信号并导致胰岛素靶组织产生胰岛素抵抗[8]。因此,APPL1是脂联素在全身能量稳态中作用的关键调节因子。值得注意的是,APPL1的另一种亚型APPL2对鼠骨骼肌细胞中的脂联素信号产生负调节作用。其原因是APPL2通过其结构域直接与AdipoR1和R2结合,从而竞争性地阻止APPL1与脂联素的相互作用并阻断脂联素信号传导[9]。APPL1和APPL2也会结合形成损害脂联素作用的异二聚体。脂联素可以刺激APPL1/APPL2异二聚体解离,释放APPL1并结合AdipoR1和R2[9]。这种方式也提示脂联素信号具有自身调节功能。
4.3钙调节机制:脂联素也可以独立于APPL1激活AMPK。脂联素主要通过诱导细胞内储存的钙释放,增加细胞外钙进入细胞内,从而增加细胞内钙的浓度,来激活AMPK。脂联素激活磷脂酶C,随后产生肌醇3-磷酸(IP3),导致钙从内质网释放。从内质网释放的钙刺激Ca2+/钙调蛋白依赖性蛋白激酶激酶(CaMKK-β),以非APPL1依赖方式激活AMPK。脂联素也可以通过激活AdipoR1来促进细胞外钙内流,其确切机制尚不清楚。钙通过两种途径,钙调蛋白依赖性蛋白激酶(CaMK)途径和AMPK途径,刺激过氧化物酶体增殖物激活受体γ辅激活因子-1α(PGC1-α)来激活SIRT1。钙调节主要发生在骨骼肌,可以增加线粒体生物活性和氧化能力。
4.4神经酰胺的作用:神经酰胺是一种与胰岛素抵抗、细胞死亡、炎症和动脉粥样硬化有关的鞘脂。脂联素可以激活AdipoR1和R2降低细胞神经酰胺的表达[10]。糖尿病患者神经酰胺水平升高;而使用成纤维细胞生长因子21(FGF21)和TZDs来增加脂联素,可以降低神经酰胺的水平[10]。具体而言,给予外源性脂联素降低了肝脏和其他组织中的神经酰胺水平,导致肝脏胰岛素敏感性增加。神经酰胺酶将神经酰胺水解为鞘氨醇,鞘氨醇被磷酸化为1-磷酸鞘氨醇(S1P)。S1P是促进细胞存活和增殖的有益因子[11]。基因敲除小鼠胚胎成纤维细胞(MEFs)中的AdipoR1和R2,降低了脂联素诱导的神经酰胺酶活性,导致S1P浓度降低[6]。相反,肝脏中AdipoR1和AdipoR2的过度表达可以增加神经酰胺酶的活性,降低神经酰胺的含量并改善胰岛素敏感性。脂联素与AdipoR1和R2的结合,和/或脂联素受体本身,可以诱导催化神经酰胺酶活性[6]。最近的结构研究表明,AdipoR2有一个内部隧道,允许神经酰胺在受体激活后从细胞内侧进入[12]。一旦神经酰胺进入受体通道就被水解成鞘氨醇,鞘氨醇被释放到细胞中并被磷酸化成S1P。AdipoR1没有类似的内部隧道,但具有脂联素依赖的神经酰胺酶活性[12]。
4.5T-钙黏蛋白的作用:2004年,人们发现在C2C12小鼠成肌细胞中,T-钙黏蛋白受体与脂联素结合。T-钙黏蛋白是一种非典型的糖基磷脂酰肌醇(GPI)锚定的钙粘蛋白细胞表面糖蛋白,参与钙介导的细胞间接触,在结构上不同于AdipoR1和R2。T-钙黏蛋白受体没有跨膜或胞内结构域,但在内皮细胞和平滑肌细胞中起结合脂联素和促进脂联素信号传导的作用,内皮细胞和平滑肌细胞也是T-钙黏蛋白表达的主要部位。T-钙黏蛋白受体结合HMW和六聚体形式的脂联素,但不结合三聚体、球状或细菌产生的脂联素多聚体,证明真核翻译后修饰是脂联素结合T-钙黏蛋白受体并发挥正常生物学功能所必需的。在T-钙黏蛋白基因敲除小鼠中,脂联素循环水平,特别是HMW型脂联素均升高。脂联素通过抑制GPI磷脂酶介导的T-钙黏蛋白从细胞表面的释放,来调节组织T-钙黏蛋白水平[13]。T-钙黏蛋白通过促进细胞迁移和增殖,在脂联素介导的慢性缺血后血管重建中起重要作用[13]。心肌细胞上的T-钙黏蛋白还通过结合脂联素,激活AMPK信号通路,发挥心脏抗肥厚保护功能。
4.6病理环境对信号传导的影响:在糖尿病或肥胖等不同的病理生理状态下,AdipoR1和R2表达发生变化。在链脲佐菌素(STZ)糖尿病小鼠(1型糖尿病模型)中,骨骼肌AdipoR1和R2的表达增加。胰岛素治疗可以降低两种受体的高表达。与对照组相比,STZ糖尿病小鼠肝脏表达AdipoR1和R2并无显著差异。然而,胰岛素降低了STZ糖尿病小鼠肝脏中两种受体的表达。在胰岛素抵抗的ob/ob小鼠中(瘦素产生减少),肌肉和脂肪组织中AdipoR1和R2的表达均减少,但肝脏中没有减少。在Lepr-/-小鼠(瘦素受体突变,db/db)(肥胖和糖尿病的遗传动物模型)中,肝脏中AdipoR1和R2表达均降低,并导致脂联素敏感性降低及全身代谢受损相关。在Lepr-/-小鼠肝脏中,腺病毒介导的AdipoR1和R2的过表达分别增加了AMPK活化和PPARα信号通路,减少了糖异生和新生脂肪的形成,增加了脂肪酸氧化,从而改善了Lepr-/-小鼠的糖尿病病情。在人类2型糖尿病家族史患者中,骨骼肌AdipoR1和R2表达较低,两种受体的表达与胰岛素敏感性呈正相关。相反,Debard等人没有观察到2型糖尿病胰岛素抵抗的肥胖患者中,骨骼肌AdipoR1或R2表达的任何显著差异。肥胖患者皮下和内脏脂肪组织中AdipoR1和R2表达减少,且肥胖患者的体重减轻可增加AdipoR1基因的表达,而与AdipoR2无关。罗格列酮(一种TZD)可以增加脂肪组织中AdipoR1的表达,但降低骨骼肌中AdipoR1的表达,对AdipoR2没有影响。相反,另一种TZD吡格列酮可以增加2型糖尿病患者骨骼肌中AdipoR1和R2的表达[14]。
5 小结与展望
在过去的20多年中,脂联素因为其独有的特性获得了相当大的关注。本文综述了脂联素作为一种调节多种生理功能的多效性脂肪因子功能的传导机制,使我们更充分的了解脂联素如何发挥其生理作用的途径,进一步为临床寻找疾病的治疗策略提供了合理的方向。
尽管如此,我们对脂联素的研究在某些方面仍然有所欠缺。例如在心血管疾病方面,流行病学研究将脂联素作为临床标志物显示出自相矛盾的结果:尽管脂联素具有已经证实的心脏保护作用,高浓度的脂联素与心血管事件数量的减少无关,而是与心血管死亡风险的增加有关。导致脂联素与死亡率之间这种矛盾关系的基本生理机制很复杂,仍有待探讨。
目前,我们还远远没有弄清楚脂联素发挥生理功能的确切方式。但毫无疑问,在不久的未来,临床会应用大量的脂联素制剂来预防和治疗各种疾病。