快速老化小鼠P8海马神经元突触结构与功能可塑性
2015-12-25封敏,张晓抒,张英俊等
快速老化小鼠P8海马神经元突触结构与功能可塑性
封敏张晓抒1张英俊2熊殷艺3鲁娟3卢圣锋4余曙光3
(湖南医药学院针灸推拿教研室,湖南怀化418000)
摘要〔〕目的从海马神经元突触结构与功能可塑性角度探讨阿尔茨海默病(AD)认知功能缺损的可能原因。方法以10月龄快速老化小鼠(SAMP)8为AD模型,同月龄抗快速老化小鼠(SAMR)1为正常对照,采用Morris水迷宫实验评价动物学习记忆能力,透射电镜观察海马CA1区神经元突触超微结构,在体长时程增强(LTP)记录观察海马前穿通纤维-齿状回(PP-DG)通路神经元突触传递效能。结果与SAMR1比较,SAMP8逃避潜伏期延长(P=0.000),穿越有效区次数减少(P=0.046);海马CA1区神经元突触后致密带变薄(P=0.000),突触间隙增宽(P=0.024),突触界面曲率下降(P=0.000);海马PP-DG通路LTP诱发率(P=0.362)、群峰电位(P=0.900)及潜伏期(P=0.394)差异无统计学意义。结论海马CA1区突触超微结构受损可能是导致SAMP8学习记忆能力下降的原因,CA1区与DG区在AD病理上可能扮演不同角色。
关键词〔〕阿尔茨海默病;快速老化小鼠P8;突触可塑性;长时程增强
中图分类号〔〕R741.02〔文献标识码〕A〔
基金项目:国家自然科学基金资助项目(81072866,81202743);湖南省科技厅科研项目(2014FJ3018);湖南省中医药管理局科研项目(201479)
通讯作者:余曙光(1965-),男,研究员,博士生导师,主要从事针灸作用机制研究。
1华侨大学校医院2湖南医药学院医学影像系
3成都中医药大学针灸推拿学院4南京中医药大学第二临床医学院
第一作者:封敏(1982-),女,博士,讲师,主治医师,主要从事针灸促神经康复机制研究。
Synaptic structure and function in the hippocampus of senescence accelerated mouse prone 8
FENG Min,ZHANG Xiao-Shu,ZHANG Ying-Jun,etal.
Department of Acupuncture and Moxibustion,Hunan University of Medicine,Huaihua 410008,Hunan,China
Abstract【】ObjectiveTo explore the pathogenesis of Alzheimer's disease (AD) in aspect of synaptic structure and function in hippocampus.Methods10-month old male SAMP8 and SAMR1 were taken as AD and control groups respectively.Morris water maze was performed to observe learning and memory abilities.Transmission electron microscope was used to observe the synaptic ultrastructure in CA1 subregion of hippocampus.In vivo,electrophysiology recording were used to detect the synaptic efficacy of perforantpath-dentategyms (PP-DG) pathway.ResultsCompared to those of control group,escaping latency was prolonged(P=0.000) and target annulus crossings was decreased(P=0.046) in model group.The thickness of post synaptic density was decreased(P=0.000),the width of synaptic cleft was increased(P=0.024)and the curvature of the synaptic interface was decreased(P=0.000)in hippocampal CA1 subregion of model group.There were no significant differences in the induction of long-term potentiation(P=0.362),the population spike(PS) amplitudes(P=0.900) and the reduction in the latency of the PS(P=0.394) in PP-DG pathway between two groups.ConclusionsThe impairment of synaptic structure in hippocampal CA1 subregion maybe one of the probable pathogenesis underlying AD.The CA1 and DG subregions of the hippocampus might play different roles in AD pathology.
【Key words】Alzheimer's Disease;SAMP8;Synaptic plasticity;Long-term potentiation
海马是学习与记忆的关键脑区,也是阿尔茨海默病(AD)易感区域,海马神经元突触可塑性异常被认为是导致AD认知障碍的重要因素〔1〕。增龄性快速老化特征,学习记忆能力减退及AD特征性病理改变使快速老化小鼠(SAMP)8成为较理想的动物模型,近年来被逐渐应用于AD研究〔2〕。但目前对SAMP8海马神经元突触效能的了解尚少。本研究拟从突触结构和功能两方面观察SAMP8海马神经元突触可塑性变化及其与学习记忆的关系,探讨AD认知功能缺损的可能原因,同时补充SAMP8的病理变化情况。
1材料与方法
1.1实验动物与分组雄性10月龄SAMP8 13只,体重26~32 g。雄性10月龄抗快速老化小鼠(SAM)R115只,体重28~33 g。由天津中医药大学第一附属医院老年脑病研究室动物中心提供,清洁级,合格证号:SCXK(津)2008-0001。适应性喂养1 w,单笼饲养,自由进食,饮灭菌水,节律光照(LD=12/12),动物房温度、湿度分别为26℃、70%左右。每周更换一次垫料及饮水瓶。实验中对动物的处置严格遵照科技部发布的《关于善待实验动物的指导性意见》规定。
1.2主要实验仪器Morris水迷宫视频追踪系统(成都泰盟),透射电子显微镜H-600IV(日本日立),刺激器MSE-3(日本Nihon kohden),隔离器SS-102J(日本Nihon kohden),脑立体定位仪SR-6N(日本Narishie Ins),颅骨钻(日本Minimo),数模转换器Digidata1322A(美国Axon Ins),微电极放大器(美国Axon Ins),WinLTP软件(英国布里托尔大学)。
1.3Morris水迷宫实验〔3〕直径80 cm的圆形水池,分为N、E、S、W 4个方向,圆形平台直径10 cm,水温(19±1)℃,水中放入脱脂奶粉,使之浑浊。依次进行可视平台实验(VPT)2 d,定位航行实验(PNT)5 d及空间探索实验(SPT)1 d。记录PNT中小鼠找到水下平台所需的逃避潜伏期时间和SPT中小鼠穿越原平台位置有效区的次数,分别评估小鼠海马依赖的空间参考学习与记忆能力。
1.4透射电镜检测采用随机数字表法选取两组小鼠各3只。依次进行腹腔注射麻醉(1%戊巴比妥钠0.4 ml/100 g),开胸,灌注(4%多聚甲醛+2%戊二醛混合固定液),断头剥离脑组织,分离海马。依照小鼠大脑脑立体定位图谱取海马水平部背内侧CA1区组织一块约1 mm3。电镜制样后,每只小鼠用透射电镜观察1张铜网,随机拍摄5张照片,底片放大2.5万倍印相。本研究遵循的兴奋性突触确认标准参照文献〔4〕。采用Image-Pro Plus 6.0图像分析系统,对突触界面超微结构进行测量:(1)突触后致密带(PSD)厚度、突触间隙宽度的测量:参照体视学方法,测量正方测试格的测试线与PSD或突触间隙相交所截截线的截距,计算其平均值L,根据体视学计算公式,PSD的平均厚度或突触间隙宽度= L/2 。(2)突触界面曲率(R)以突触界面弧长a与弦长b之比表示,即R=a/b〔5〕。
1.5在体长时程增强(LTP)记录小鼠进行腹腔注射麻醉(20%乌拉坦,0.01 ml/g)后,将头部水平固定于脑立体定位仪上,剪开头皮暴露颅骨,钻孔,将刺激电极插入至前穿通纤维(PP),记录电极插至齿状回(DG)颗粒细胞层,参比电极夹于头皮。
群峰电位(PS)记录:将刺激器参数调至波宽100 μs,电流0.3 mA,诱发PS,调节刺激电极与记录电极获得最佳PS后稳定60 min,继而调整刺激强度使PS为最大值的1/3~1/2,记录30 min作为基线。此后给予强直刺激(TS)(频率150 Hz,波宽150 μs,每串由5个脉冲方波组成,共8串,串间隔10 s)诱发LTP,重复3次TS。记录TS后60 min内的PS。信号通过微电极放大器(低通滤波1 kHz,增益10)、数模转换器,应用WinLTP进行采样分析。
观测指标:LTP诱发率,LTP诱发后PS及潜伏期改变幅值。以基线期PS和潜伏期的均数为基础值(100%),TS后每个单脉冲检验刺激(参数同基线期)所诱发的PS及潜伏期与之相比为PS及潜伏期改变幅值。LTP成功诱导标准:TS后PS平均幅值≥基础PS值120%,并持续30 min以上。
2结果
2.1学习记忆能力在Morris水迷宫实验的VPT中未观察到小鼠游泳姿态异常或无法找到平台的情况,说明所有小鼠无运动或感觉缺陷,具备完成水迷宫实验的能力。在PNT中,与SAMR1比较,SAMP8逃避潜伏期延长(P<0.05)(表1),说明SAMP8海马依赖的空间参考学习能力减退;在SPT中,穿越有效区次数减少(P<0.05)(表1),说明SAMP8记忆能力减退。

表1 两组小鼠Morris水迷宫实验结果比较( ± s)
与SAMP8组比较:1)P<0.05;下表同
2.2海马神经元突触超微结构与SAMR1比较,SAMP8海马CA1区兴奋性突触PSD变薄(P<0.05)、突触间隙增宽(P<0.05)、突触界面曲率下降(P<0.05)(图1,表2),说明SAMP8突触界面超微结构受损。
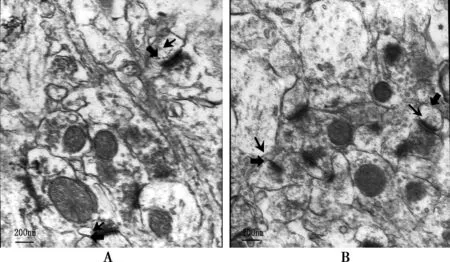
A:SAMR1;B为SAMP8; 为突触后致密带,→为突触间隙 图1 两组小鼠海马CA1区神经元突触(电镜,×25 000)

组别突触数(个)PSD(x±s,nm)R(x±s)突触间隙宽度〔M(Qn),nm〕SAMR1组SAMP8组708548.40±11.331)39.83±9.301.17±0.071)1.12±0.0517.02(3.68)1)18.86(6.36)t/P值-5.19/0.000-5.181/0.000-2.25/0.024
2.3海马神经元突触效能与SAMR1组(50%)比较,SAMP8组海马PP-DG通路LTP诱发率(50%)、PS及潜伏期幅值变化无显著差异(表3),说明与同月龄SAMR1相比,10月龄SAMP8海马PP-DG通路突触效能无明显改变。

表3 两组小鼠海马LTP参数PS及潜伏期幅值变化比较
3讨论
SAM是日本学者在繁殖自然AKR/J变异小鼠时筛选出来进行近交延代繁殖而成,常用于老化疾病研究,同源SAMR1被用做正常对照。其中SAMP8以学习记忆能力减退为主要特征。研究表明,8~10月龄SAMP8学习记忆功能明显低下,不仅具有全身老化特征,还存在Aβ、APP沉积、tau蛋白异常磷酸化、胆碱能神经功能下降等AD病理性改变〔6,7〕。因此,本研究选用10月龄SAMP8作为AD动物模型。
突触可塑性在很大程度上反映整个神经回路的修饰,是近年神经科学领域的研究热点。长时程的突触可塑性被公认为是学习与记忆的生理基础,突触异常也被认为是导致AD记忆障碍的原因〔1〕。本研究结果表明,与同月龄SAMR1相比,10月龄SAMP8海马CA1区突触超微结构受损,学习记忆能力下降,这与其他研究小组及本课题组前期研究结果一致〔8〕。突触结构可塑性与功能可塑性互为基础、相互影响,突触结构受损会引发突触传递效率的下降。然而,笔者通过在体电生理记录却观察到,与突触超微结构损伤不同,SAMP8 PP-DG通路突触传递效能并无明显变化,甚至在LTP的诱发上还有易化趋势。对于不一致的结果,笔者分析存在以下可能:(1)海马的亚区差异。海马包括CA1~4、DG和下托等亚区,亚区具有各自独特的细胞构筑,亚区间通过"三突触回路"形成海马内部神经环路:第1级突触为PP-DG,第2级为DG苔状纤维-CA3区椎体细胞,第3级为CA3区Schaffer侧支-CA1区椎体细胞。普遍的观点认为海马各亚区具有不同的理化特性〔9〕,参与学习记忆功能的程度并非完全相同,且存在AD易感性差异。AD的病理生理过程在临床诊断为痴呆多年前就开始了〔1〕,AD可累及整个海马,而受累时间最早、程度最重的为CA1区,因此有观点认为,CA1区萎缩是AD临床前阶段的重要生物标志〔10〕。一项离体脑片电生理研究观察到8-9月龄SAMP8 CA1区PS增幅明显降低〔11〕,这与笔者的CA1区电镜结果相符。而本研究在体记录的为海马第1级突触——PP-DG,其突触后反应来自DG区,这可能是导致电生理结果与行为学、突触结构结果不相匹配的重要原因。研究表明,以CA1为主的背侧海马与学习记忆密切相关〔12〕,而以DG为主的腹侧海马则与情绪应激更为相关〔13〕,是情绪记忆的关键区域之一〔14〕。文献报道,75%AD患者前驱症状中具有情绪障碍,包括抑郁、焦虑、易怒、具攻击性等〔15〕。笔者也观察到SAMP8易被激惹、具备较强攻击性,这是否与DG区神经元突触的异常活动有关〔16〕?笔者前期研究发现,SAMP8海马AMPA受体GluR2亚基含量下降,可能造成细胞内Ca2+超载,使突触反应病理性增强,介导兴奋性神经毒性〔8〕。本次电生理实验观察到SAMP8 PP-DG通路LTP诱发有易化趋势,虽然差异不具有统计学意义,但由于样本量较小,暂不能排除抽样误差导致总体差异被掩盖的可能,更明确的结论有待进一步研究。此外,由于海马三级突触之间并非简单的线性关系〔9〕,作为三突触回路中的第一级,PP-DG的电生理记录也可能无法反映下游CA1区突触效能情况。从这个角度来看,实验结果间并不矛盾。(2)炎性因子影响。与同月龄SAMR1相比,12月龄SAMP8在体海马PP-DG通路LTP无明显变化。在体实验时海马局部组织细胞因子的水平可能是造成LTP结果与行为学结果不符的原因。SAMR1较强的免疫功能可能导致脑组织在LTP实验时急性炎症反应增强,释放较多炎性因子对LTP产生抑制作用〔17〕。
本实验结果提示,CA1区突触超微结构受损可能是导致SAMP8学习记忆能力下降的原因,海马CA1区与DG区在功能上各有侧重,分别与学习记忆和情绪应激相关,二区在AD病理上也可能扮演不同角色,但迄今为止对每一区域功能的细节还不甚了解。较新的观点认为,海马亚区在AD的发病和诊断中具有重要意义〔10,16,18〕,值得进一步关注,而AD海马CA1区突触超微结构受损的机制也是深入研究的方向。
4参考文献
1Sperling RA,Aisen PS,Beckett LA,etal.美国国立老化研究所与阿尔茨海默病协会诊断指南写作组:阿尔茨海默病临床前阶段的定义〔J〕.中华神经科杂志,2012;45(5):336-44.
2Wang H,Lian K,Han B,etal.Age-related alterations in the metabolic profile in the hippocampus of the senescence-accelerated mouse prone 8:a spontaneous Alzheimer's disease mouse model〔J〕.J Alzheimers Dis,2014;39(4):841-8.
3Charles VV,Michael TW.Morris water maze:procedures for assessing spatial and related forms of learning and memory〔J〕.Nature Protocols,2006;1(2):848-58.
4Jones DG,Calverley RKS.Frequency of occurrence of perforated synapses in developing rat neocortex〔J〕.Neurosci Lett,1991;129(2):189-92.
5Jones DG,Devon RM.An ultrastructural study into the effect of pentobarbition on synaptic organization〔J〕.Brain Res,1978;147(1):47-63.
6薛小燕,吴君伟,郭小华,等.阿尔茨海默病动物模型的研究进展〔J〕.中国老年学杂志,2014;34(20):5914-7.
7马芹颖,强静,王铭维.快速老化小鼠SAMP8脑内神经病理学变化的研究进展〔J〕.中国老年学杂志,2011;31(19):3858-60.
8封敏,张英俊,鲁娟,等.快速老化小鼠P8海马神经元突触可塑性相关的AMPA受体表达异常〔J〕.解剖学报,2014;45(1):15-9.
9Scullin CS,Partridge LD.Modulation by pregnenolone sulfate of filtering properties in the hippocampal trisynaptic circuit〔J〕.Hippocampus,2012;22(11):2184-98.
10Apostolova LG,Mosconi L,Thompson PM,etal.Subregional hippocampal atrophy predicts Alzheimer's dementia in the cognitively normal〔J〕.Neurobiol Aging,2010;31(7):1077-88.
11胡增峣.当归芍药散活性部位JD-30对Alzheimer病模型动物学习记忆功能的影响及机制研究〔D〕.北京:军事医学科学院毒物药物研究所博士学位论文,2010:6.
12Yiu AP,Rashid AJ,Josselyn SA.Increasing CREB function in the CA1 region of dorsal hippocampus rescues the spatial memory deficits in a mouse model of Alzheimer's disease〔J〕.Neuropsychopharmacology,2011;36(11):2169-86.
13Tanti A,Belzung C.Neurogenesis along the septo-temporal axis of the hippocampus:are depression and the action of antidepressants region-specific〔J〕?Neuroscience,2013;252:234-52.
14Redondo RL,Kim J,Arons AL,etal.Bidirectional switch of the valence associated with a hippocampal contextual memory engram〔J〕.Nature,2014;513(7518):426-30.
15Sturm VE,Yokoyama JS,Seeley WW,etal.Heightened emotional contagion in mild cognitive impairment and Alzheimer's disease is associated with temporal lobe degeneration〔J〕.Proc Natl Acad Sci USA,2013;110(24):9944-9.
16Maruszak A,Thuret S.Why looking at the whole hippocampus is not enough-a critical role for anteroposterior axis,subfield and activation analyses to enhance predictive value of hippocampal changes for Alzheimer's disease diagnosis〔J〕.Front Cell Neurosci,2014;8:1-11.
17黄晏.免疫功能状态与LTP的关系和六味地黄汤及其活性成分CA4-3益智作用机制的初步研究〔D〕.北京:军事医学科学院毒物药物研究所博士学位论文,2009:5.
18La Joie R,Perrotin A,de La Sayette V,etal.Hippocampal subfield volumetry in mild cognitive impairment,Alzheimer's disease and semantic dementia〔J〕.Neuroimage Clin,2013;3:155-62.
〔2014-12-29修回〕
(编辑曲莉)
