中枢nesfatin-1表达下调对SD大鼠胰岛素信号通路的影响
2015-12-25瞿文娟,曾梦,李志勇等
中枢nesfatin-1表达下调对SD大鼠胰岛素信号通路的影响
瞿文娟曾梦1李志勇程昌琴杨若梅蒋先淑杨刚毅1李伶2
(重庆医科大学附属永川医院内分泌科,重庆402160)
摘要〔〕目的探讨中枢nesfatin-1表达下调对SD大鼠肝胰岛素信号通路的影响。方法将雄性SD大鼠随机分为普食喂养+人工脑脊液(aCSF)输注组(NCA组,n=10),普食喂养+ Ad-shGFP输注组(NCG 组,n=10),普食喂养+ Ad-shNUCB2输注组(NCN组,n=10),高脂喂养+人工脑脊液(aCSF)输注组(HFA组,n=10),高脂喂养+Ad-shGFP输注组(HFG组,n=10),高脂喂养+ Ad-shNUCB2 输注组(HFN组,n=10)。构建第三脑室微量输注系统进行第三脑室干预,留取普食组大鼠下丘脑、肝脏、脂肪和肌肉组织采用Western印迹测定 nesfatin-1表达。采用Western印迹法测定各组大鼠G6Pase及PEPCK的表达水平以和IR、IRS-1、AKT、STAT3及mTOR的蛋白磷酸化水平变化。结果和NCA或NCG组分别相比,NCN组下丘脑nesfatin-1表达显著降低(P<0.05),而外周组织(肝、脂肪及肌肉)nesfatin-1表达无显著差异。和NCA组相比,HFA组的G6Pase、PEPCK表达水平均显著增高,而 IR、IRS-1、AKT、STAT3、mTOR的蛋白磷酸化水平均显著降低(P<0.05)。和NCA或NCG 组相比,NCN组的G6Pase、PEPCK表达水平均显著增高,而IR、IRS-1、AKT、 STAT3、mTOR的蛋白磷酸化水平均显著降低(P<0.05)。和HFA或HFG 组相比,HFN组的G6Pase、PEPCK表达水平均显著增高,而IR、IRS-1、AKT、STAT3、mTOR的蛋白磷酸化水平均显著降低(P<0.05)。结论中枢Ad-shNUCB2输注可下调SD大鼠下丘脑 nesfatin-1表达,同时下调机体肝胰岛素信号通路级联反应蛋白水平,可能通过抑制mTOR/STAT3信号通路从而降低机体肝脏糖异生。
关键词〔〕Nesfatin-1;脑室内输注;胰岛素信号通路;肝糖异生
中图分类号〔〕R589.1〔文献标识码〕A〔
基金项目:国家自然科学
通讯作者:李志勇(1968-),男,主任医师,硕士生导师,主要从事胰岛素抵抗、糖脂代谢研究。
1重庆医科大学附属第二医院内分泌科
2重庆医科大学检验系临床生化教研室和教育部实验诊断重点实验室
第一作者:瞿文娟(1982-),女,在读硕士,医师,主要从事糖尿病方面的研究。
Effects of central nesfatin-1 knockdown on hepatic insulin signaling pathway
QU Wen-Juan, ZENG Meng, LI Zhi-Yong,etal.
Department of Endocrinology, Yongchuan Hospital, Chongqing Medical University, Chongqing 402160, China
Abstract【】ObjectiveTo investigate the effects of central nesfatin-1 knockdown on hepatic insulin signaling pathway.MethodsMale Sprague-Dawley(SD) rats were randomly divided into normal-chow die (NCD) + aCSF (NCA, n=10), NCD + Ad-shGFP(NCG, n=10), NCD + Ad-shNUCB2 (NCN, n=10), high-fat diet (HFD) + aCSF(HFA, n=10), HFD + Ad-shGFP(HFG, n=10), HFD + Ad-shNUCB2 groups (HFN, n=10). After central intervention, NCD-fed rats were sacrificed and the expressions of nesfatin-1 in hypothalamic and peripheral tissues were examined. Other rats were sacrificed and the tissues were quickly taken away. The phosphorylated protein levels of IR, IRS-1, AKT, STAT3 and mTOR, and the protein levels of G6Pase, PEPCK were evaluated by Western blot.ResultsAfter central Ad-shNUCB2 intervention, hypothalamic nesfatin-1 protein levels was significantly decreased by 66% compared with rats that were given ACF or Ad-shGFP(P<0.05). However, no significant differences were found in nesfatin-1 expression in liver, muscle and adipose tissues. Compared with those of NCA group, the protein levels of G6Pase and PEPCK in HFA group were increased significantly (P<0.05). However, the phosphorylated protein levels of IR, IRS-1, AKT, STAT3 and mTOR inHFA group were decreased obviously(P<0.05). Compared with those of NCA or NCG groups, the protein levels of G6Pase and PEPCK in NCN group were increased significantly (P<0.05). However, the phosphorylated protein levels of IR, IRS-1, AKT, STAT3 and mTOR in NCN group were markedly decreased (P<0.05). Compared with HFA or HFG groups, the levels of G6Pase and PEPCK in HFN group were increased significantly (P<0.05). However, the phosphorylated protein levels of IR, IRS-1, AKT, STAT3 and mTOR in HFN group were decreased significantly (P<0.05).ConclusionsCentral Ad-shNUCB2 intervention could decrease hypothalamic nesfatin-1 protein levels significantly. Knockdown of central nesfatin-1 could decrease the phosphorylation of several proteins in insulin signaling cascade. Moreover, central nesfatin-1 knockdown could lighten insulin sensitivity through inhibition of mTOR-STAT3 signaling pathway.
【Key words】Nesfatin-1;Intracerebroventricular infusion;Insulin signaling pathway;Hepatic gluconeogenesis
Nesfatin-1是一种新发现的下丘脑抑制摄食因子〔1〕,广泛表达于下丘脑各核团,在机体其他组织如胰腺组织、脑垂体、睾丸中均有表达〔2〕。越来越多的研究显示,nesfatin-1不但在能量代谢方面起到重要的作用,其与胰岛素抵抗和糖尿病的发生发展也有着密切的关系〔3〕。然而,中枢nesfatin-1 调节胰岛素信号及糖代谢的具体作用机制目前尚不完全清楚。因此,本研究采用RNAi技术构建的nesfatin-1小干扰分子表达腺病毒Ad-shNUCB2,探索中枢nesfatin-1表达下调对胰岛素信号通路、肝脏糖异生关键基因的调控及可能的分子作用机制。
1材料和方法
1.1材料及试剂大鼠源性nesfatin-1干扰重组腺病毒载体Ad-shNUCB2由本课题组前期构建;重组绿色荧光蛋白腺病毒载体(Ad-shGFP)为空载对照病毒,由重庆医科大学检验医学院提供;人工脑脊液(aCSF)由BioPanda公司提供;组织蛋白提取试剂RIPA、PMSF及BCA蛋白测定试剂购自碧云天公司;兔抗小鼠葡萄糖-6-磷酸酶(G6Pase)一抗、兔抗小鼠磷酸烯醇式丙酮酸羧激酶(PEPCK)一抗均购自美国Santa Cruz公司,兔抗小鼠nesfatin-1一抗购自英国ABCAM公司,兔源p-IR、IR、p-IRS-1、IRS-1、p-AKT、AKT、p-STAT3、STAT3、p-mTOR及mTOR一抗均购自美国Cell Signaling公司;兔抗小鼠β-actin一抗、HRP标记的羊抗兔IgG二抗购自北京中杉金桥公司。
1.2方法
1.2.1动物模型健康雄性四周龄SD大鼠60只,体重约100~120 g,适应性喂养1 w后,随机分为普食喂养+人工脑脊液(aCSF)输注组(NCA组),普食喂养+Ad-shGFP输注组(NCG组),普食喂养+Ad-shNUCB2输注组(NCN组),高脂喂养+人工脑脊液(aCSF)输注组(HFA组),高脂喂养+Ad-shGFP输注组(HFG组),高脂喂养+Ad-shNUCB2输注组(HFN组),每组10只。各组大鼠均喂养10 w,普通饲料(热卡百分比:脂肪7.39%,蛋白质18.81%,碳水化合物51.96%,其他21.94%)和高脂饲料(热卡百分比:脂肪26.8%,蛋白质14.83%,碳水化合物40.97%,其他17.5%)均由第三军医大学大坪医院的野战外科研究所实验动物中心提供。大鼠禁食5 h后,测量其体重并用氯胺酮腹腔麻醉(87 mg/kg),备皮后,取俯卧位,头部固定于大鼠脑立体定位仪,常规皮肤消毒,沿颅顶中线皮肤切开,暴颅骨及前囟,参照脑立体定位图谱(Paxinos和Watson的大鼠脑立体定位图谱)定位第三脑室〔4〕,利用螺丝钉及玻璃离子水门汀固定套管并缝合皮肤,术后单笼喂养并预防性使用青霉素。第三脑室置管术后第5天,套管内输注血管紧张素Ⅱ10 ng(10 ng 稀释到10 μl生理盐水中),监测大鼠饮水量,15 min饮水量<5 ml者予以剔除。恢复7 d后,空白对照组(NCA和HFA组)第三脑室内输注人工脑脊液10 μl,阴性对照组(NCG和HFG组)输注Ad-shGFP(109PFU),干预组(NCN 和HFN组)输注Ad-shNUCB2(109PFU)。输注7 d后,低温分离大鼠肝脏及其他组织并迅速置于液氮中保存备用。
1.2.2Western印迹法检测组织蛋白表达分别取肝脏、脂肪、肌肉等组织约100 mg,加入蛋白裂解液RIPA、蛋白酶抑制剂PMSF、磷酸酶抑制剂氟化钠、正钒酸钠等进行匀浆,冰上裂解30 min,低温高速离心30 min,取上清用BCA法测定蛋白浓度。每条泳道约加100 μg蛋白进行SDS-PAGE电泳,湿转于PVDF膜,4℃封闭4 h后,依次加入稀释的一抗、二抗反应,孵育过夜。经洗脱后加入化学发光试剂并置化学发光成像系统中成像,用Quantity-One软件进行图像分析,计算各条带灰度比。
1.3统计学处理使用SPSS19.0软件,组间比较采用单因素ANOVA分析及独立样本t检验。
2结果
2.1中枢Ad-shNUCB2输注对下丘脑及外周组织 nesfatin-1表达的影响与对照组比较,中枢Ad-shNUCB2 输注后大鼠下丘脑 nesfatin-1表达明显降低(P<0.05),而外周组织(如肝、脂肪及肌肉)nesfatin-1表达无显著变化(图1,表1)。
2.2nesfatin-1表达下调对糖异生相关基因表达的影响和NCA相比,HFA组PEPCK和G6Pase蛋白的表达水平均明显升高(P<0.05);NCN组PEPCK和G6Pase的表达较NCA或NCG组均显著升高(P<0.05)。同样,HFN组在第三脑室输注Ad-shNUCB2后,PEPCK和G6Pase蛋白的表达水平较HFA或HFG组也明显升高(P<0.05)(图2,表2)。
2.3nesfatin-1表达下调对IR、IRS-1及AKT蛋白活性的影响见图3,表3。与NCA相比,HFA组IR、IRS-1及AKT磷酸化水平明显下降(P<0.05);NCN组在第三脑室输注Ad-shNUCB2后IR、IRS-1及AKT磷酸化水平较NCA或NCG组均明显下降(P<0.05);HFN组在第三脑室输注Ad-shNUCB2后IR、IRS-1及AKT磷酸化水平较HFA或HFG组均明显降低(P<0.05)。

图1 中枢 Ad-shNUCB2 对下丘脑及外周组织 nesfatin-1 表达的影响
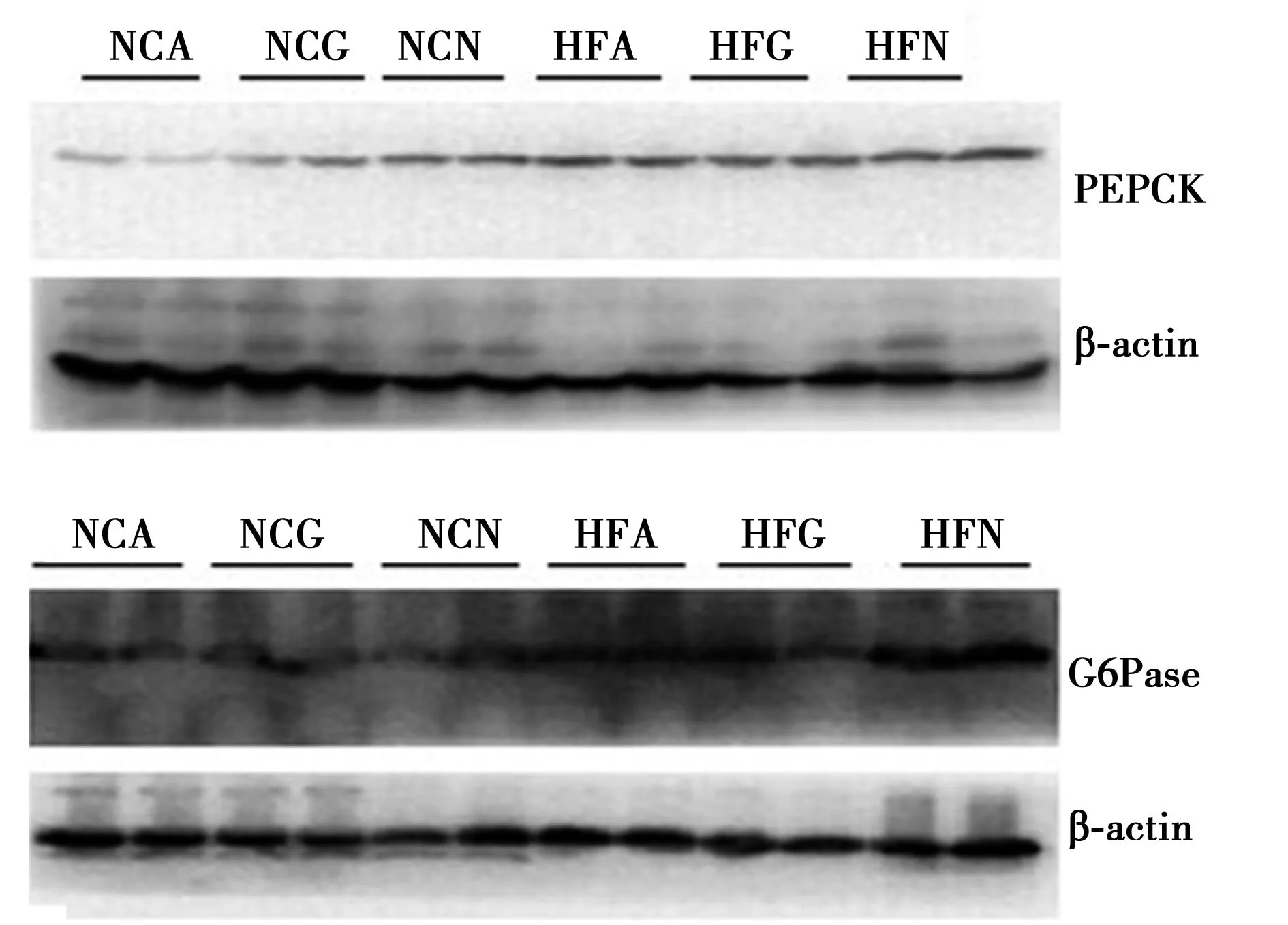
图2 中枢Ad-shNUCB2输注对肝脏PEPCK及 G6Pase表达的影响

图3 中枢 Ad-shNUCB2输注对肝脏胰岛素信号通路的影响
2.4nesfatin-1表达下调对肝脏 mTORC2及STAT3蛋白表达或活性的影响和NCA相比,HFA组mTOR、STAT3Tyr705及STAT3Ser727位点磷酸化水平明显下降(P<0.05);NCN组mTOR、STAT3Tyr705及STAT3Ser727位点磷酸化水平与NCA或NCG组比较均明显下降(P<0.05);HFN 组mTOR、STAT3Tyr705及STAT3Ser727位点磷酸化水平较HFA或HFG
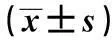
表1 中枢 Ad-shNUCB2 对下丘脑及外周组织
与NCA组比较:1)P<0.05;与NCG组比较:2)P<0.05组表达水平也明显降低(P<0.05)(图4,表4)。

图4 中枢Ad-shNUCB2输注对肝脏STAT3及 mTOR活性的影响

指标NCANCGNCNHFAHFGHFNPEPCK0.390±0.0430.530±0.0451)0.910±0.0741)2)1.146±0.061)2)3)1.280±0.0221)2)3)4)1.920±0.0981)2)3)4)5)G6Pase1.010±0.1001.020±0.1301)1.750±0.2301)2)1.880±0.2101)2)3)1.810±0.1801)2)3)4)3.000±0.3901)2)3)4)5)
与NCA组比较:1)P<0.05;与NCG组比较:2)P<0.05;与NCN组比较:3)P<0.05;与HFA组比较:4)P<0.05;与HFG组比较:5)P<0.05;下表同
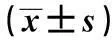
表3 中枢Ad-shNUCB2输注对肝脏IR,IRS-1,AKT蛋白活性的影响
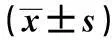
表4 中枢Ad-shNUCB2输注对肝脏STAT3 Tyr705,STAT3 Ser727,mTOR位点磷酸化水平的影响
3讨论
在第三脑室Ad-shNUCB2输注后,我们对大鼠下丘脑和外周组织的nesfatin-1表达进行了检测,结果显示第三脑室Ad-shNUCB2输注可降低下丘脑nesfatin-1的表达,血肌肉及脂肪外周组织 nesfatin-1表达没有发生变化,验证了模型的效力,为后续研究提供了良好的实验基础。
肝糖异生是维护机体血糖处于稳态的主要糖代谢途径,肝糖异生增加是引起血糖升高及胰岛素抵抗的最主要原因之一。PEPCK和G6Pase是调节机体糖异生的关键酶,大量研究表明,胰岛素通过激活IR/IRS-1/AKT信号通路抑制PEPCK和G6Pase的表达,从而抑制肝脏糖异生〔5〕。本研究发现,无论普食喂养还是高脂喂养组,中枢Ad-shNUCB2输注后,PEPCK和G6Pase表达量均显著增高;中枢nesfatin-1表达下调能够明显抑制普食喂养或高脂喂养的大鼠肝脏IR、IRS-1及AKT磷酸化水平。课题组前期研究表明,中枢nesfatin-1表达下调能够通过促进肝糖异生,加重高脂喂养诱导的大鼠胰岛素抵抗程度。因此,结合前期研究结果,我们推测中枢nesfatin-1表达抑制可能通过抑制IR/IRS-1/AKT胰岛素信号作用通路,进而上调PEPCK和G6Pase的表达,导致肝糖异生增加,促进机体胰岛素抵抗的发生发展。
mTOR作为磷脂酰肌醇肌酶家族一员,可调控多种细胞的生长和分化〔6〕。近来,mTOR参与胰岛素信号通路的调节引起众多研究者的关注。目前已证实,mTOR存在两种复合物,包括雷帕霉素敏感复合物mTORC1和雷帕霉素不敏感复合物mTORC2。mTORC1作用于S6K1,可增加IRS-1丝氨酸磷酸化从而降低胰岛素敏感性〔7〕,而mTORC2主要通过作用于AKT丝氨酸磷酸化位点从而增加胰岛素敏感性〔8〕。本研究显示,中枢nesfatin-1表达下调能够抑制mTOR 磷酸化水平,特别是在高脂喂养动物中。因此,我们推测中枢nesfatin-1可能主要通过下调mTORC2表达,抑制AKT磷酸化,进而干扰胰岛素信号通路,对于具体的分子机制还有待于进一步研究证实。
STAT3信号通路影响机体摄食、肝糖循环和生殖功能,参与下丘脑leptin对能量和葡萄糖稳态的调节〔9〕。当受到外界刺激后,STAT3被一系列细胞因子和生长因子激活〔10〕,两两聚合转位进入细胞核并激活目标基因。本研究显示,高脂喂养能够下调STAT3磷酸化水平,而中枢nesfatin-1能在此基础上进一步抑制STAT3丝氨酸727(Ser727)和酪氨酸705(Tyr705)位点磷酸化水平。因此,nesfatin-1作为一种神经信号肽,可能通过激活mTOR/STAT3信号通路,抑制糖异生关键酶PEPCK和G6Pase的表达,从而调节机体的肝糖异生,最终引起机体对胰岛素敏感性的变化。
4参考文献
1Oh-I S,Shimizu H,Satoh T,etal.Identification of nesfatin-1 as a satiety molecule in the hypothalamus〔J〕.Nature,2006;443:709-12.
2Stengel A,Goebel M,Yakubov I,etal.Identification and characterization of nesfatin-1 immunoreactivity in endocrine cell types of the rat gastric oxyntic mucosa〔J〕.Endocrinology,2009;150:232-8.
3Yang M,Zhang Z,Wang C,etal.Nesfatin-1 action in the brain increases insulin sensitivity through Akt kinase/AMP-dependent protein kinase/target of rapamycin complex 2 pathways in diet-induced insulin resistance〔J〕.Diabetes,2012;61:1959-68.
4Paxinos G,Watson C.The rat brain in stereotaxic coordinates〔M〕.New York:Academic Press,2007:45-6.
5Steinberg GR,Watt MJ,Ernst M,etal.Ciliary neurotrophic factor stimulates muscle glucose uptake by a PI3-kinase-dependent pathway that is impaired with obesity〔J〕.Diabetes,2009;58:830-9.
6Hay N,Sonenberg N.Upstream and downstream of mTOR〔J〕.Genes Dev,2004;18:1926-45.
7Hara K,Maruki Y,Long X,etal.Raptor,a binding partner of target of rapamycin(TOR),mediates TOR action〔J〕.Cell,2002;110:177-89.
8Sarbassov DD,Guertin DA,Ali SM,etal.Phosphorylation and regulation of Akt/ PKB by the rictor-mTOR complex〔J〕.Science,2005;307:1098-101.
9Kim JH,Yoon MS,Chen J.Signal transducer and activator of transcription 3 (STAT3) mediates amino acid inhibition of insulin signaling through Serine 727 Phosphorylation〔J〕.J Biol Chem,2009;284:35425-32.
10Senn JJ,Klover PJ,Nowak IA,etal.Suppressor of cytokine signaling-3 (SOCS-3),a potential mediator of interleukin-6-dependent insulin resistance in hepatocytes〔J〕.J Biol Chem,2003;278:13740-6.
〔2014-09-25修回〕
(编辑郭菁)
