玻璃化冻融后胚胎卵裂球的损伤与生长融合对移植结局的影响
2015-12-24李伟施文浩李明昭师娟子
李伟,施文浩,李明昭,师娟子
(西北妇女儿童医院,西安 710061)
1983年,世界首例冻融胚胎移植(FET)后成功妊娠[1],在随后的时间里,这项技术在世界范围内取得了飞速发展,现在已成为辅助生殖技术的重要组成部分。FET 不仅能够增加促排周期的妊娠机会,避免胚胎浪费,降低患者的治疗费用[2];还能减少胚胎移植的数量,降低多胎妊娠的风险[3]。现在也有文献报道FET 的临床妊娠率和种植率与新鲜周期相比并无明显差异[4],但FET 比新鲜胚胎移植的异位妊娠率低[5]。影响FET 成功的因素很多,其中复苏后胚胎的质量,及其进一步发育的潜能尤为重要。本文通过对大样本临床资料的回顾性分析,探讨玻璃化冷冻胚胎复苏后卵裂球是否损伤,以及过夜培养后能否恢复分裂生长对移植结局的影响。
资料与方法
一、研究对象
本研究回顾性分析2010年1月至2012年2月的1 679个玻璃化冷冻复苏胚胎移植周期。所有周期均为受精后72h玻璃化冷冻胚胎,所有胚胎解冻后均经过夜培养。本研究实验设计得到医院伦理道德委员会批准。
二、研究方法
1.分组:根据胚胎复苏后是否有卵裂球损伤分为两组:A 组(无损伤组,n=1 357)、B 组(有损伤组,n=322)。根据过夜培养后胚胎卵裂球是否分裂生长将A 组分为两个亚组:AⅠ组(有生长组,n=1 170)、AⅡ组(无生长组,n=187)。根据胚胎卵裂球是否有融合将AⅠ组再分为:AⅠ-1 组(有融合组,n=316)、AⅠ-2组(无融合组,n=854)。当胚胎卵裂球细胞形成致密连接,细胞边界不明显时为胚胎卵裂球融合。
2.胚胎质量分级及冷冻胚胎选择:按Peter卵裂期胚胎评分系统评估第3天胚胎质量[6],选择评级为Ⅰ-Ⅲ的胚胎进行玻璃化冷冻。
3.胚胎玻璃化冷冻方法:采用Vitrification试剂盒(Kitazato,日本)进行玻璃化冷冻,冷冻液分为ES液和VS液,4℃保存。使用前在室温(25℃)条件下平衡30min。将胚胎吸入ES液,室温下放置约5min。胚胎卵裂球出现皱缩时再扩张,待胚胎卵裂球扩张至原体积的80%以上,将其放入VS液。然后胚胎放置于有患者信息的无菌载杆上,迅速投入液氮中。
4.FET 周期内膜准备:内膜准备分自然周期与人工周期两种。自然周期:对于月经规律、有自然排卵者在月经第6~8 天开始B 超监测卵泡发育,确认排卵时间。排卵后第2天下午进行胚胎解冻,第3天上午进行移植。人工周期:对于月经不规律、排卵障碍的患者,在月经第3~5天开始口服戊酸雌二醇(补佳乐,先灵,德国)2~4mg/d,5d后监测子宫内膜生长情况,并根据内膜情况调整药物剂量,可增量至6~8mg/d;当子宫内膜厚度≥8mm 时,加用黄体酮(浙江仙琚)肌肉注射20~60 mg/d,第4天下午进行胚胎解冻,第5天上午行胚胎移植。
5.胚胎解冻:胚胎解冻于移植前1天的下午进行。使用Vitrification试剂盒,解冻液分为TS液、DS液、WS1液和WS2液,4℃保存。使用前,TS液在37℃平衡30min,其他解冻液在室温(25℃)条件下平衡30min。将冷冻载杆从液氮中取出,迅速将前端叶片浸入TS液,待胚胎脱落到TS液中(一般1min内),将胚胎依次移入DS、WS1和WS2液,分别放置3min、5 min、5min后,转入预平衡好的培养液中观察,有≥50%细胞数目存活的胚胎记为复苏,其余的丢弃。复苏成功的胚胎随后放入37℃、6%CO2培养箱中培养过夜(18~20h)。
6.胚胎移植:采用B超引导下移植。移植时若移植内管或外管出现肉眼可见的血液为移植出血。
三、统计学分析
采用SPSS 16.0统计软件分析,计量资料以均数±标准差(±s)表示,组间均数的比较采用t检验,计数资料以率(%)表示,组间比较采用卡方(χ2)检验,以P<0.05为差异有统计学意义。
结 果
一、基本情况
本研究纳入的1 679个FET周期,均为胚胎解冻后、经过夜培养后进行移植。其中解冻后胚胎无卵裂球损伤组(A 组)1 357个周期,有卵裂球损伤组(B组)322个周期。A、B两组患者的促排卵年龄、基础FSH 值、原发性不孕比例、移植时子宫内膜厚度、移植出血发生率、移植胚胎数等比较,均无显著性差异(P>0.05)。A、B两组的胚胎冻存时间比较,B组为7个月,高于A 组的6.1个月,差异有统计学意义(P<0.05)(表1)。
二、复苏后胚胎卵裂球是否损伤对妊娠结局的影响
A 组的种植率和临床妊娠率分别为32.33%、54.09%,均明显高于B 组(23.07%、40.37%),差异有统计学意义(P<0.01)(表2)。
三、复苏后胚胎能否恢复分裂生长对妊娠结局的影响
AⅠ、AⅡ两组比较,AⅠ组的种植率(33.87%)和临床妊娠率(56.50%)均显著高于AⅡ组(分别为22.08%和39.04%),差异有统计学意义(P<0.01)(表3)。
四、卵裂球是否融合对妊娠结局的影响
AⅠ-1 组的种植率和临床妊娠率分别为40.93%、64.87%,明显高于AⅠ-2 组的31.31%、53.40%,差异有统计学意义(P<0.01)(表4)。
表1 A、B两组患者的基本情况[(±s),%]
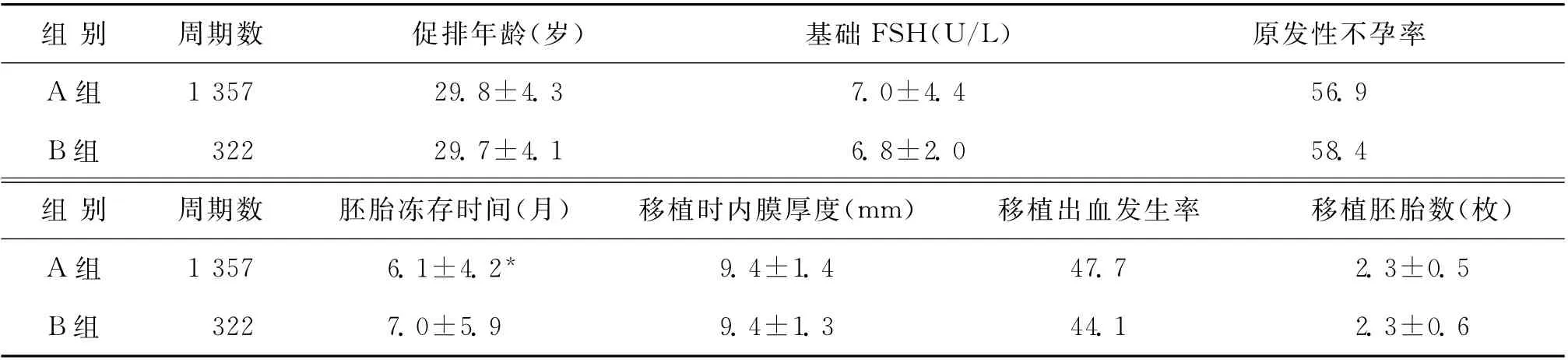
表1 A、B两组患者的基本情况[(±s),%]
注:与B组比较,*P<0.05
组 别 周期数 促排年龄(岁) 基础FSH(U/L)原发性不孕率A 组1 357 29.8±4.3 7.0±4.4 56.9 B组 322 29.7±4.1 6.8±2.0 58.4组 别 周期数 胚胎冻存时间(月) 移植时内膜厚度(mm) 移植出血发生率 移植胚胎数(枚)A 组 1 357 6.1±4.2*9.4±1.4 47.7 2.3±0.5 B组322 7.0±5.9 9.4±1.3 44.1 2.3±0.6

表2 复苏后卵裂球是否损伤对妊娠结局的影响[n(%)]

表3 卵裂球生长情况对妊娠结局的影响[n(%)]

表4 卵裂球融合对妊娠结局的影响[n(%)]
讨 论
胚胎冷冻过程中,会形成冰晶损伤、冷休克、渗透性休克等冷冻损伤,这些损伤可能导致胚胎卵裂球的破坏,从而影响随后的胚胎发育及着床。Houghton等[7]认为损伤的卵裂球释放的胞质能够影响细胞间的信号传导,从而降低胚胎活力。杜丹等[8]研究表明对于玻璃化冻融胚胎移植,卵裂球完整胚胎数小于2枚时其临床妊娠率和胚胎种植率显著降低。El-Toukhy等[9]研究发现解冻后无卵裂球损伤的胚胎和有卵裂球损伤的胚胎相比,移植后的临床妊娠率(22.8%vs 13.5%)和种植率(17.3%vs 8.1%)差异显著。也有研究表明胚胎冻融后,随着卵裂球损伤的增多,临床妊娠率显著下降[10-11]。本研究中,冻融后无卵裂球损伤组(A 组)的种植率和临床妊娠率分别为32.33%、54.09%,均高于有卵裂 球 损 伤 组(B 组)的23.07%、40.37%(P <0.01)。与上述文献报道结果一致,表明胚胎冻融后如果发生卵裂球损伤,会影响后续的胚胎种植与妊娠。此外Nagy等[12]研究发现,将冻融后损伤的卵裂球移除能够显著提高胚胎的种植率。但也有研究表明,解冻后卵裂球损伤率低于25%的胚胎与没有卵裂球损伤的胚胎相比,其种植率并没有显著性差异。
本研究中无卵裂球损伤组(A 组)与有卵裂球损伤组(B组)的胚胎冻存时间有差异,B 组高于A组,其余基本参数没有显著性差异,提示随着胚胎冻存时间的延长,可能会增加复苏后胚胎卵裂球损伤的发生,进一步影响胚胎种植与妊娠。但最近也有研究认为不管是卵裂期胚胎还是囊胚,冻存时间对其存活率、种植率都没有影响[13-14]。这可能与胚胎冷冻保存所用的方法不同有关,Wirleitner等[13]及Liu等[14]使用封闭的保存方法,胚胎不直接接触液氮,而本研究使用的是开放的保存系统,胚胎直接与液氮接触。开放系统冷冻保存的胚胎,其冻存时间是否影响解冻复苏后胚胎卵裂球的状态有待于我们进一步的研究探讨。
对复苏后无卵裂球损伤组(A 组)进一步研究发现,有卵裂球分裂生长组(AⅠ组)的种植率和临床妊娠率均高于无卵裂球分裂生长组(AⅡ组),差异有统计学意义。与Joshi等[15]研究发现的解冻后卵裂球恢复分裂的胚胎有更高的临床妊娠率结果一致,表明胚胎解冻后经过夜培养,可通过胚胎的卵裂球能否恢复分裂生长预测胚胎继续发育的潜能。Laverge等[16]的研究发现,复苏后培养24h而无卵裂球分裂生长的胚胎,染色体异常率很高,只有20%的胚胎具有完全正常的二倍体,这可能就是其种植率低的原因。Sole等[11]研究认为解冻后有两个以上卵裂球恢复分裂或胚胎发生融合,是移植成功一个很好的预测指标。本研究中AⅠ组的胚胎,根据有没有卵裂球融合分为有融合组(AⅠ-1组)和无融合组(AⅠ-2组),发现有融合组的种植率和妊娠率分别为40.93%、64.87%,显著高于无融合组的31.31%、53.40%,表明解冻复苏后的胚胎,经培养后若达到融合状态可以预测较高的种植率和妊娠率,提示冻融后出现融合的胚胎临床上是否可以考虑行单胚胎移植。
综上所述,胚胎冻融后如果有卵裂球损伤会影响后续的胚胎种植和妊娠。冻融后的胚胎经过培养,是否能恢复分裂生长甚至达到融合状态,可用于评价胚胎的发育潜能,对冻融周期胚胎的选择有一定的指导作用。对于培养后卵裂球有融合的胚胎,是否可以考虑行单胚胎移植需要进一步的研究探讨。
[1] Trounson A, Mohr L. Human pregnancy following cryopreservation,thawing and transfer of an eight-cell embryo[J].Nature,1983,305:707-709.
[2] Lundin K,Bergh C.Cumulative impact of adding frozenthawed cycles to single versus double fresh embryo transfers[J/OL].Reprod Biomed Online,2007,15:76-82.
[3] Tiitinen A,Halttunen M,Härkki P,et al.Elective single embryo transfer:the value of cryopreservation[J].Hum Reprod,2001,16:1140-1144.
[4] 余宏,董乃俊,孙艳,等.卵裂期胚胎解冻移植结局的影响因素探讨[J].生殖医学杂志,2011,20:412-415.
[5] 柯雪,孙林,王磊,等.冻融胚胎移植异位妊娠低发生率的原因分析[J].生殖医学杂志,2014,23:233-237.
[6] Brinsden PR.A textbook of in vitro fertilization and assisted reproduction[M].New York:The Parthenon Publishing Group Inc,1999:1996.
[7] Houghton FD,Barr KJ,Walter G,et al.Functional significance of gap junctional coupling in preimplantation development[J].Biol Reprod,2002,66:1403-1412.
[8] 杜丹,刘海鹏,彭姝明,等.卵裂球损伤对不同冻融方法胚胎移植后临床结局的影响[J].生殖医学杂志,2014,23:866-871.
[9] El-Toukhy T,Khalaf Y,Al-Darazi K,et al.Effect of blastomere loss on the outcome of frozen embryo replacement cycles[J].Fertil Steril,2003,79:1106-1111.
[10] Zhang S,Lu C,Lin G,et al.The number of blastomeres in post-thawing embryos affects the rates of pregnancy and delivery in freeze-embryo-transfer cycles[J].J Assist Reprod Genet,2009,26:569-573.
[11] Sole M,Santalo J,Rodriguez I,et al.Correlation between embryological factors and pregnancy rate:development of an embryo score in a cryopreservation programme[J].J Assist Reprod Genet,2011,28:129-136.
[12] Nagy ZP,Taylor T,Elliott T,et al.Removal of lysed blastomeres from frozen-thawed embryos improves implantation and pregnancy rates in frozen embryo transfer cycles[J].Fertil Steril,2005,84:1606-1612.
[13] Wirleitner B,Vanderzwalmen P,Bach M,et al.The time aspect in storing vitrified blastocysts:its impact on survival rate,implantation potential and babies born[J]. Hum Reprod,2013,28:2950-2957.
[14] Liu Q,Lian Y,Huang J,et al.The safety of long-term cryopreservation on slow-frozen early cleavage human embryos[J].J Assist Reprod Genet,2014,31:471-475.
[15] Joshi BV,Banker MR,Patel PM,et al.Transfer of human frozen-thawed embryos with further cleavage during culture increases pregnancy rates[J].J Hum Reprod Sci,2010,3:76-79.
[16] Laverge H,Van der Elst J,De Sutter P,et al.Fluorescent insitu hybridization on human embryos showing cleavage arrest after freezing and thawing[J].Hum Reprod,1998,13:425-429.
