ICSI助孕患者滤泡液中T、B淋巴细胞亚群对获卵率的影响
2015-12-24徐进张翠莲李航生张静常琼张耀张合龙
徐进,张翠莲,李航生,张静,常琼,张耀,张合龙
(河南省人民医院生殖医学中心,郑州 450003)
早在几十年前人们就认识到免疫因素对不孕的影响[1]。自此以后人们开始研究免疫系统对生殖系统各个方面的影响,临床上把由免疫因素引起的不孕症称为免疫性不孕[2]。研究发现,习惯性流产及多次体外受精-胚胎移植(IVF-ET)失败的患者,多存在外周血淋巴细胞比例异常[3-6]。T 细胞是重要的淋巴细胞,介导细胞免疫应答,主要行使CD4+T细胞的迟发型超敏反应(DTH)和CD8+T 细胞的毒性杀伤(CTL)作用。血液中的T 淋巴细胞比例失调往往预示着妊娠失败或者流产[3-6]。
滤泡液为卵母细胞提供生存的微环境,滤泡液中富含卵母细胞发育成熟所必须的激素、蛋白、糖类、活性氧、抗凋亡因子、细胞因子、生长因子等化学物质[7],滤泡液中还含有丰富的淋巴细胞,这些物质的紊乱或比例失调直接影响到卵母细胞的质量、获卵率及受精率甚至患者的妊娠结局。
本实验通过测定ICSI助孕治疗患者取卵日滤泡液中T、B 淋巴细胞比例,以探讨滤泡液中T、B淋巴细胞对卵母细胞及胚胎的可能影响。
材料与方法
一、材料
1.患者选择及处理:选自首次接受ICSI助孕治疗的患者。
纳入标准:年龄<35岁,身体健康,无免疫性疾病史,平素月经规律,基础内分泌水平正常,不育因素为单纯男方严重少弱精子症或梗阻性无精子症。
患者于黄体中期开始给予达必佳(辉凌,德国)0.1mg,ih,qd,连续用药18d后改为0.05mg,ih,qd,同时加用促排卵药(果纳芬,默克雪兰诺,德国,或普丽康,默沙东,荷兰)150~225U,ih,qd。当有60%的卵泡平均直径超过18mm 时,给予HCG(珠海丽珠)7 000~10 000U 肌肉注射,36.5~37h手术取卵。
2.滤泡液收集及分组:手术日经阴道超声引导下滤泡液抽吸取卵,收集取卵后清亮滤泡液待测。根据获卵情况分为两组:获卵率(获卵数/穿刺卵泡数)>80%为A 组(20例),获卵率<50%为B组(20例)。
3.主要仪器:流式细胞仪(NAVIOS)(Becton-Dickinson,美国)、台式离心机、涡旋震荡器、微量移液器(1 000μl、100μl、10μl)、流式细胞专用试管。
4.检测试剂:Mouse IgG1-FITC、Mouse IgG1-PE、Mouse IgG1-APC、CD3-FITC、CD8-PE、CD45-PerCP、CD4-APC、CD19-APC,PBS,BD FACS Lysing Solution红细胞裂解液(10×)(Becton-Dickinson,美国)。
二、方法
1.实验步骤:取7支流式试管,分别标记①对照管、②FITC、③PE、④PerCP、⑤APC、⑥3-8-4-45、⑦3-16/56-19-45。对照管分别加入20μl Mouse IgG1-FITC、Mouse IgG1-PE、Mouse IgG1-APC、CD45-PerCP荧光抗体;②~⑤管依次加入20μl CD3-FITC、CD8-PE、CD45-PerCP、CD4-APC 荧 光 抗体;⑥管分别加入20μl CD3-FITC、CD8-PE、CD45-PerCP、CD4-APC荧光抗体;⑦管分别加入20μl CD3-FITC、CD45-PerCP、CD19-APC荧光抗体。
分别取100μl处理后的滤泡液细胞悬液加入每支试管中。依次用1×FACS Lysing Solution及PBS处理后,4℃避光1h内上机检测。标本用NAVIOS 流式细胞仪获取数据。每个样本收集10 000个细胞。
2.软件分析:用Kaluza软件进行结果分析,在CD45/SSC散点图设门(R1)为淋巴细胞,其余散点图显示均为R1 门细胞,以①管为标尺,分别得出CD3和CD4 双 阳 细 胞、CD3 和CD8 双 阳 细 胞、CD19阳性细胞。
三、统计学方法
应用SPSS 17.0统计软件,对相关数据进行统计学分析,计量资料采用t检验,计数资料(%)采用χ2检验;P<0.05为差异有统计学意义。
结 果
一、两组患者基本特征
两组患者的平均年龄、不育年限、基础卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)、孕酮(P)水平、平均用药天数、平均用药量相比较,均无统计学差异(P>0.05)(表1)。
表1 两组患者基本情况比较(±s)
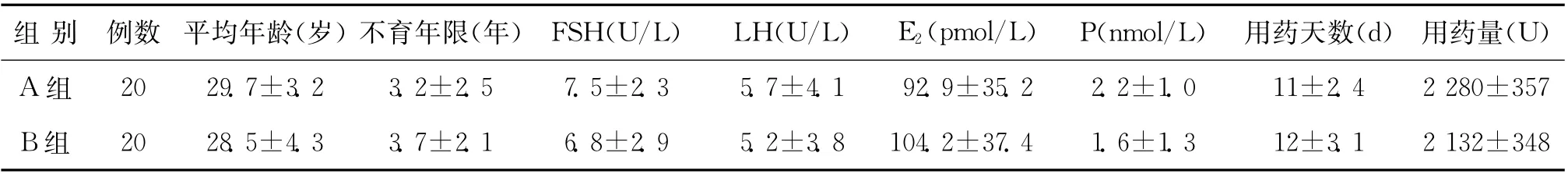
表1 两组患者基本情况比较(±s)
组 别 例数 平均年龄(岁)不育年限(年) FSH(U/L) LH(U/L) E2(pmol/L) P(nmol/L) 用药天数(d) 用药量(U)A组 20 29.7±3.2 3.2±2.5 7.5±2.3 5.7±4.1 92.9±35.2 2.2±1.0 11±2.4 2 280±357 B组 20 28.5±4.3 3.7±2.1 6.8±2.9 5.2±3.8 104.2±37.4 1.6±1.3 12±3.1 2 132±348
二、两组获卵及胚胎形成情况比较
A 组的平均获卵数、MⅡ卵数、受精卵数及可利用胚胎数均显著高于B组(P<0.05);两组间获卵率(获卵数/穿刺卵泡数)比较有统计学差异(P<0.05),但受精率(受精卵数/成熟卵数)及可利用胚胎率(可利用胚胎数/受精卵数)均无统计学差异(P>0.05)(表2)。
三、两组滤泡液中淋巴细胞亚群的比较
两组间CD4+T 淋巴细胞及B淋巴细胞均无统计学差异(P>0.05);A 组CD8+T 淋巴细胞显著低于B组(P<0.05)(表3,图1)。
表2 两组获卵及胚胎形成情况结果比较[(±s),%]

表2 两组获卵及胚胎形成情况结果比较[(±s),%]
注:与A 组比较,*P<0.05
组别 例数 穿刺卵泡数(个)获卵数(枚)MⅡ卵数(枚) 获卵率 受精卵数(枚) 受精率 可利用胚胎数(枚)可利用胚胎率A 组 20 14.1±4.2 12.8±4.3 9.3±6.2 90.8 7.7±3.4 82.8 5.2±3.4 67.5 B组 20 13.5±3.1 6.6±3.7* 5.1±2.7* 48.9* 4.2±2.6* 82.4 2.8±1.6*66.7

表3 两组滤泡液中淋巴细胞亚群的比较(%)

图1 滤泡液中淋巴细胞亚群流式细胞分析
讨 论
滤泡液作为卵母细胞生存的微环境,含有丰富的卵母细胞发育成熟所必需的化学物质,包括激素、蛋白、活性氧、细胞因子、生长因子等。滤泡液微环境的改变直接影响到母体的生育能力,代谢紊乱和能量失衡可以引起卵巢功能的紊乱,影响到生长发育中卵母细胞的质量[8]。滤泡液中的皮质醇可能对卵丘细胞脂质分解起一定作用,其含量与卵丘细胞脂质含量成负相关[9]。研究表明滤泡液中过氧化物含量和抗氧化状态影响不育患者的妊娠结局。卵巢的氧化应激反应明显高于血浆的氧化应激反应,升高的氧化应激水平有利于促排卵过程中获得较多的成熟卵[10]。卵巢储备功能降低或高龄患者能够改变卵泡细胞、滤泡液的代谢物质,这些改变能够影响卵母细胞的发育潜能及胚胎的发育潜能[11]。滤泡液中还含有淋巴细胞,特发性不育患者的滤泡液中细胞毒性CD16+、CD56-、NK 细胞亚群数量增加,并且这种增加能够降低受精率[12]。
T 细胞作为免疫效应细胞,主要行使CD4+T细胞的DTH 和CD8+T 细胞的CTL 作用。CD8+细胞毒性T 细胞在细胞免疫、抗病毒感染、抗肿瘤及器官移植排斥中发挥重要作用。其主要作用是直接特异性杀伤带有MHC-Ⅰ类分子的靶细胞。成熟B细胞可在识别抗原后进一步分化为能分泌特异性免疫球蛋白的浆细胞和携带抗原信息的记忆性B细胞。B细胞能产生抗体发挥抗体的中和作用、调理作用及抗体依赖的细胞介导的细胞毒作用。另外活化的B 细胞可产生多种细胞因子,参与免疫调节、炎症反应和造血过程。
在月经各期和早孕的子宫内膜中T 细胞数量相对稳定,和外周血中T 细胞不同,子宫内膜间质中超过2/3 的T 细胞为CD8+T 细胞(外周血中CD4+T 细胞占65%,CD8+占35%)。在围着床期,子宫内膜局部分泌一些化学因子,能使T 细胞(主要是Th2细胞)迁移进入子宫,使胚胎成功着床[13]。通过比较妊娠过程中外周血和蜕膜中T 细胞情况,发现子宫蜕膜主要为Th2和Tc2,其数量远远大于外周血。所以,子宫内膜或蜕膜的Th2和Tc2细胞可能通过其产生的细胞因子来调节围着床期子宫内膜对胚胎的适应性反应,有利于胚胎的成功种植和妊娠的维持[14-15]。T 细胞在卵巢功能早衰中起着至关重要的作用,其中Th1细胞占优势。Th1细胞分泌白介素-2(IL-2)、干扰素-γ(IFN-γ)等诱导颗粒细胞及黄体细胞MHC-Ⅱ类抗原的表达,诱发自身免疫应答,使颗粒细胞和卵泡受到破坏,从而发生卵巢功能早衰。这类患者外周血CD8+T 细胞明显升高,CD4+/CD8+T 细胞的比值下降,与血清E2水平下降相关。卵巢功能早衰患者的卵巢内还能检测到细胞毒性杀伤细胞。T 细胞在滤泡液中的研究表明,滤泡液中T 细胞数量的变化并不能预示妊娠的结局[16]。CD27是记忆性B细胞的表面抗原。不孕患者及有不良孕史的患者外周血CD27+B 细胞明显低于正常怀孕组。外周血CD27+B 细胞的表达降低或不正常表达,均提示免疫功能的紊乱[17-20]。但不孕患者外周血总的B 细胞数与正常患者相比并没有显著性增加。不孕患者和多次IVF 助孕失败的患者滤泡液中CD27+B 细胞明显高于流产组和宫外孕组[21]。无论是不孕患者还是助孕后成功受孕的患者卵泡液中B 细胞的百分率都小于外周血浓度[21]。
我们的研究显示,滤泡液中T 淋巴细胞亚群的变化并不影响患者的受精率及可利用胚胎率,但却影响获卵率。两组患者滤泡液中成熟B 淋巴细胞数并没有显著不同,提示B 淋巴细胞参与的体液免疫调节在滤泡液中的影响可能很小。免疫系统中免疫细胞之间相互影响,所分泌的细胞因子之间存在网格状交互作用。免疫细胞对卵母细胞及获卵率的影响也绝不是单一的作用,其具体机制还需进一步深入研究。
[1] Medawarp B.Some immunological and endocrinological problems raised by the evolution of viviparity in vertebrates[J].Symp Soc Exp Biol,1953,7:320-338.
[2] Kaider AS,Kaider BD,Janowic PB,et al.Immunodiagnostic evaluation of women with reproductive failure[J].Am J Reprod Immunol,1999,42:335-346.
[3] Gleicher N,Liu HC,Dudkiewitcz A,et al.Autoantibody profiles and immunoglobulin levels a predictors of in vitro fertilization[J].Am J Obstet Gynecol,1994,170:1145-1149.
[4] Ng SC,Gilman-Sachs A,Thaker P,et al.Expression of intracellular Th1and Th2cytokines in women with recurrent spontaneous abortion,implantation failures after IVF/ET or normal pregnancy[J].Am J Reprod Immunol,2002,48:77-86.
[5] Nip MM,Taylor PV,Rutheford AJ,et al.Autoantibodies and antisperm antibodies in sera and follicular fluids of infertile patients;relation to reproductive outcome after in-vitro fertilization[J].Hum Reprod,1995,10:2564-2569.
[6] Kwak-Kim JY,Chung-Bang HS,Ng SC,et al.Increased T helper 1cytokine responses by circulating T cells are present in women with recurrent pregnancy losses and in infertile women with multiple implantation failures after IVF[J].Hum Reprod,2003,18:767-773.
[7] Revelli A,Delle Piane L,Casano S,et al.Follicular fluid content and oocyte quality:from single biochemical markers to metabolomics[J].Reprod Biol Endocrinol,2009,7:40.
[8] Leroy JL,Rizos D,Sturmey R,et al.Intrafollicular conditions as a major link between maternal metabolism and oocyte quality:a focus on dairy cow fertility[J].Reprod Fertil,2011,24:1-12.
[9] Simerman AA,Hill DL,Grogan TR,et al.Intrafollicular cortisol levels inversely correlate with cumulus cell lipid content as a possible energy source during oocyte meiotic resumption in women undergoing ovarian stimulation for in vitro fertilization[J].Fertil Steril,2015,103:249-257.
[10] Velthut A,Zilmer M,Zilmer K,et al.Elevated blood plasma antioxidant status is favourable for achieving IVF/ICSI pregnancy[J/OL] .Reprod Biomed Online,2013,26:345-352.
[11] Pacella L,Zander-Fox DL,Armstrong DT,et al.Women with reduced ovarian reserve or advanced maternal age have an altered follicular environment[J].Fertil Steril,2012,98:986-994.
[12] Wold AS,Arici A.Natural killer cells and reproductive failure[J].Curr Opin Obstet Gynecol,2005,17:237-241.
[13] Ingman WV,Jones RL.Cytokine knockouts in reproduction:the use of gene ablation to dissect roles of cytokines in reproductive biology[J].Hum Reprod Update,2008,14:179-192.
[14] Kalu E,Bhaskaran S,Thum MY,et al.Serial estimation of Th1:Th2 cytokines profile in women undergoing in vitro fertilization-embryo transfer[J].Am J Reprod Immunol,2008,59:206-211.
[15] Saito S,Nakashima A,Shima T,et al.Th1/Th2/Th17and regulatory T-cell paradigm in pregnancy[J].Am J Reprod Immunol,2010,63:601-610.
[16] Gaafar TM,Hanna MO,Hammady MR,et al.Evaluation of cytokines in follicular fluid and their effect on fertilization and pregnancy outcome[J].Immunol Invest,2014,43:572-584.
[17] Agematsu K,Futatani T,Hokibara S.Absence of memory B cells in patients with common variable immunodeficiency[J].Clin Immunol,2002,103:34-42.
[18] Warnatz K,Denz A,Dräger R,et al.Severe deficiency of switched memory B cells(CD27(+)IgM (-)IgD(-))in subgroups of patients with common variable immunodeficiency:a new approach to classify a heterogenous disease[J].Blood,2002,99:1544-1551.
[19] Bohnhorst JO,Thoen JE,Natvig JB,et al.Significantly depressed percentage of CD27+(memory)B cells among peripheral blood B cells in patients with primary Sjögren’s syndrome[J].Scand J Immunol,2001,54:421-427.
[20] Bohnhorst JO,Bjorgan MB,Thoen JE.Abnormal B cell differentiation in primary sjogren’s syndrome results in a depressed percentage of circulating memory B cells and elevated levels of soluble CD27that correlate with serum IgG concentrations[J].Clin Immunol,2002,103:79-88.
[21] Vujisic S,Zidovec Lepej S,Aksamija A,et al.B-and T-cells in the follicular fiuid and peripheral blood of patients undergoing IVF/ET procedures[J].AJRI,2004,52:379-385.
