短波紫外线照射对苹果采后灰霉病抗性诱导作用
2015-12-10张晓晓周会玲周晓婉
张晓晓,周会玲*,田 蓉,周晓婉,樊 胜
(西北农林科技大学园艺学院,陕西 杨凌 712100)
短波紫外线照射对苹果采后灰霉病抗性诱导作用
张晓晓,周会玲*,田 蓉,周晓婉,樊 胜
(西北农林科技大学园艺学院,陕西 杨凌 712100)
为探究短波紫外线(ultraviolet C,UV-C)照射对苹果采后灰霉病的防治效果与抗性诱导机理,以红富士苹果为材料,采用剂量分别为3.5、7.0、10.5 kJ/m2的UV-C(280 nm)进行照射,常温条件下放置2 d 后接种灰葡萄孢菌,以不经UV-C照射直接接种灰葡萄孢菌的果实作为对照。结果表明:照射剂量为3.5 kJ/m2和7.0 kJ/m2的UV-C照射可显著降低果实灰霉病的发生率,抑制病斑直径的扩展(P<0.01),其中照射剂量为7.0 kJ/m2UV-C处理的效果更好;而照射剂量为10.5 kJ/m2的UV-C照射处理在接种后贮藏前期对病害有抑制作用,后期却加快病害发展。3.5 kJ/m2和7.0 kJ/m2UV-C处理能诱导苹果果实几丁质酶、β-1,3-葡聚糖酶、过氧化物酶(POD)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)等抵御酶活性的提高,诱导酚类物质的合成,进而增强果实的抗病性,其中7.0 kJ/m2UV-C处理诱导效果更明显,与对照差异显著(P<0.01)。10.5 kJ/m2UV-C照射仅在接种后前期诱导POD、PPO、PAL和几丁质酶的活性迅速上升,提高总酚和类黄酮含量,但对β-1,3-葡聚糖酶活性没有诱导作用。
苹果;灰霉;UV-C照射;防治效果;诱导机理;防御酶活性
由病原菌引起的腐烂是造成苹果采后损失的主要原因。灰霉病作为苹果采后主要侵染性病害,其致病途径通常有两种:首先是伤口侵染;其次是花期侵染,潜伏到贮藏4~5 个月后发病[1]。苹果在采摘、运输和贮藏过程中易遭受机械损伤,这为病原菌的侵入提供了便利条件。致病菌灰葡萄孢(Botrytis cinerea Pers)具有很强的耐低温能力,即使在冷藏条件下也可导致苹果腐烂。而且果实一旦发病,病斑会很快扩及全果,造成严重损失。因此,探究安全有效的防治措施意义重大。目前对苹果采后侵染性病害的防治多以化学防腐为主,但是因其高残留、毒性大、环境污染及病原菌产生抗药性等诸多弊端而被限制使用。
近年来,短波紫外线(ultraviolet C,UV-C)照射作为一种物理防治手段在控制果蔬腐烂[2-3]、诱导抗病性[4-7]、延缓成熟[8-10]方面表现出较好的效果,又因其具有技术操作简单、能源消耗少[11]、无残留、不产生有害物质[12]等优点,已作为一种潜在的环保型果蔬贮藏手段受到人们的关注[13-14]。目前,人们已在番茄[15-17]、甜瓜[18]、蓝莓[19-20]、香菇[21]、酸橙[22]、香蕉[23]、草莓[24]、桃[25]、辣椒[26]、芦柑[27]等多种果蔬上进行了UV-C防腐保鲜研究,并取得了一系列成果。
在苹果上,利用UV-C照射控制采后腐烂与病害防治的研究也已见报道。Stevens等[28]早在1996年指出,UV-C照射能够有效控制苹果果实黑斑病和苦痘病的发生。Wilson等[29]用UV-C照射‘Empire’(帝国)苹果发现,UV-C照射大大降低了果实腐烂率,贮藏28 d处理组腐烂率较对照降低了52%。de Capdeville等[30]对比了UV-C照射、酵母菌生防、壳聚糖处理对苹果青霉的防治效果,结果显示3 种处理均能有效控制病害发生,且紫外线照射的防治效果最显著,但处理间不存在协同作用。吴芳芳等[31]研究认为,UV-C照射结合低温处理能够明显降低苹果采后炭疽病发病率,减轻发病指数。目前,UV-C在苹果采后灰霉病防治方面未见报道,对其防治效果和机理有待深入研究。
本实验旨在采用不同剂量UV-C照射苹果果实,接种灰葡萄孢子悬浮液后观察灰霉病发病情况,研究UV-C处理对苹果采后灰霉病的防治效果;并通过分析抗性相关酶活性及抗性物质含量变化,探讨UV-C照射对苹果采后灰霉病的诱导抗性机理,为UV-C在苹果采后灰霉病防治方面的应用提供参考。
1 材料与方法
1.1 材料
红富士苹果(Malus domestica cv.‘Fuji’)采于管理规范的陕西省杨凌果园,当天运回实验室。预冷一晚后选择大小均匀一致,色泽相近,果形端正,无机械损伤和病虫害的生理成熟期果实作为实验用果。
灰葡萄孢(Botrytis cinerea Pers)来源于西北农林科技大学植物保护学院,在马铃薯葡萄糖琼脂培养基上继代培养。
1.2 仪器与设备
SW-CJ-LB型无菌操作台 苏净集团安泰公司;ULTRAVIOLET-C 30W/G30 T8紫外灯 荷兰Philips公司;ZQJ-254型紫外线强度计 上海宝山顾村电光仪器厂;BCD-236DT型冰箱 青岛海尔股份有限公司;AUY220分析天平 日本岛津公司;3K15型高速冷冻离心机 美国Sigma公司;HHS 21-4电热恒温水浴锅北京长安科学仪器厂;UV-1800型紫外-可见分光光度计科大中佳公司。
1.3 方法
1.3.1 病原菌孢子悬浮液的制备
将灰葡萄孢接种于PDA培养基上,23 ℃条件下恒温避光培养5 d。然后用体积分数为0.05%的Tween 80无菌水冲洗平板,采用血球计数板法制成浓度约为1×107个/mL的孢子悬浮液。
1.3.2 样品处理
用清水冲洗供试苹果,晾干后分别进行3.5、7.0、10.5 kJ/m2的UV-C照射处理。紫外灯管平行放置,间距为10 cm,与台面的垂直距离为40 cm,用紫外线强度计测得苹果放置处的照射强度为1.2 W/m2。依据照射剂量的不同确定各处理的照射时间,以不经UV-C照射处理的果实作为对照。为确保果实均匀受光,照射前在台面上铺一层锡箔纸,照射半程时上下翻转果实。
处理组与对照组均于室温(20±1)℃条件下放置2 d后进行接种实验。接种前用75%的酒精对果实进行表面消毒,晾干后用直径3 mm已灭菌的不锈钢钉子在苹果赤道部位均匀刺入3 个伤口(深4 mm,宽3 mm),待伤口表面晾干后分别接种20 μL 1×107个/mL 灰霉孢子悬浮液。菌液充分吸收后装入聚乙烯袋中平铺于桌面上(果蒂向上,果实间留有2 cm左右缝隙),果实在20 ℃恒温放置(袋内相对空气湿度为80%~85%)。接种后每天统计果实发病率,测量病斑直径,取病斑周围健康带皮果肉组织(直径1.5 cm、厚度2.0 cm),液氮速冻后放于超低温冰箱中用于测定相关活性指标。每处理设60 个果实,重复3 次。
1.3.3 指标测定
1.3.3.1 发病统计
发病率为发病伤口数与总伤口数的比值;病斑直径:用游标卡尺进行十字交叉法测定,3 次测量取平均值作为每个病斑直径的测量值,以发病伤口处病斑直径的平均值作为各处理的病斑直径值。
1.3.3.2 几丁质酶活性测定
参考袁仲玉等[32]方法,称取1 g左右果肉,加入5 mL、pH 5.0、0.1 mol/L的醋酸缓冲液(含1 mmol/L乙二胺四乙酸二钠和5 mmol/L β-巯基乙醇)冰浴研磨呈匀浆后,在4 ℃、12 000×g离心30 min,取上清液提取液来测定酶活性。取0.5 mL粗酶提取液与0.3 mL 10 g/L的胶状几丁质悬浮液混合,在37 ℃保温1 h后加入0.1 mL质量分数为3%的脱盐蜗牛酶,继续在37 ℃保温1 h,使生成N-乙酰葡萄糖胺(Glc-NAc)单体。然后加入0.2 mL 0.6 mol/L的四硼酸钾溶液,沸水浴5 min迅速冷却。再加入2 mL质量分数2%二甲基胺硼烷溶液,在37 ℃温水中保温10 min 显色,最后在585 nm波长处测定反应液的吸光度。用煮沸5 min的酶液作对照,计算Glc-NAc的生成量。以每分钟每克蛋白分解胶状几丁质产生的1×10—9mol Glc-NAc为1个酶活力单位,即U/(min·g)。重复3 次。
1.3.3.3 β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)活性测定
粗酶提取液制备方法同1.3.3.2节,采用蒽酮法测定620 nm波长处的OD值,计算糖的生成量。以单位时间单位质量果肉催化底物产生1 nmol的葡萄糖为1个酶活单位(U/g)。重复3 次。
1.3.3.4 过氧化物酶(peroxldase,POD)和多酚氧化酶(polyphenoloxldase,PPO)活性测定
POD活性测定参考文献[33]的方法,酶活性单位(U)为质量为1 g的鲜样果肉每分钟吸光度的变化值,即U/(min·g)。
PPO活性测定参照文献[34]的方法,称取1.0 g左右果肉置于研钵中,加入5.0 mL pH值为6.0 的磷酸缓冲液,冰浴研磨成匀浆后于4 ℃、12 000×g离心30 min。然后取2 mL乙酸-乙酸钠缓冲液(pH 5.0),先加1 mL 0.05 mol/L邻苯二酚,再加入0.5 mL粗酶提取液。反应体系混匀后立即在420 nm波长处测定OD 值。以1 g的鲜样果肉每分钟吸光度的变化值作为1个酶活单位。即PPO 活性/(U/(min·g))=ΣΔA/t,ΔA代表吸光度的变化;t代表反应的时间/min。3 次重复。
1.3.3.5 苯丙氨酸解氨酶(phenylalane ammonlalyase,PAL)活性测定
取1 g左右的果肉样品,加入5 mL 4 ℃预冷后的0.1 mol/L、pH值为8.8的硼酸缓冲液(含有质量分数为4%聚乙烯吡咯烷酮,2 mmol/L乙二胺四乙酸二钠和5 mmol/L β-巯基乙醇)冰浴研磨,呈浆状后离心30 min(4 ℃、12 000×g)。参考Assis等[35]方法,取0.5 mL粗酶提取液加入3 mL 50 mmol/L、pH值为8.8 硼酸缓冲液和0.5 mL 20 mmol/L L-苯丙氨酸混匀,于37 ℃温水中保温60 min使反应生成反式肉桂酸。290 nm波长处测定混合液在保温前后的吸光度。PAL活性(U)用每分钟每克蛋白生成反式肉桂酸的量来表示。重复3 次。
1.3.3.6 总酚、类黄酮含量测定
称取1g左右果肉样品,加入5 mL的体积分数为1% HCl-甲醇溶液,冰浴研磨匀浆,4℃提取1 h 后离心30 min(4 ℃、12 000×g)。参考文献[36-37]方法,以没食子酸计算总酚含量,以芦丁计算类黄酮含量。重复3 次。
1.4 数据处理
采用Excel软件和SAS 8.2软件进行数据处理与分析。
2 结果与分析
2.1 UV-C照射对接种苹果采后灰霉病的防制效果
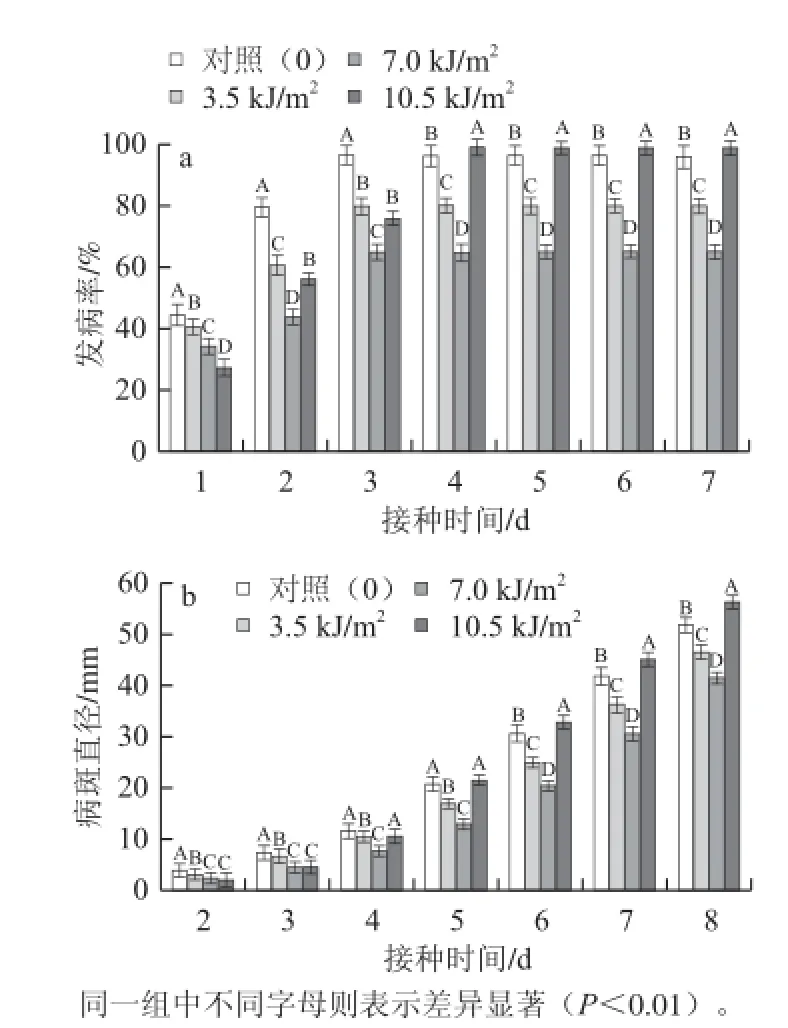
图 1 UV-C照射对苹果采后灰霉病发病率(a)和病斑直径(b)的影响Fig.1 Effects of UV-C treatments on the infection rate and diameter of disease spot of Botrytis cinerea of apple fruit
接种灰葡萄孢后,果实发病率迅速增加,1 d后对照组发病率达到44.36%,2 d后近80%伤口发病,第3 天发病率高达95%以上并趋于稳定。UV-C照射可以明显影响果实发病率,不同照射剂量对灰霉病作用效果不同。如图1a所示,3.5 kJ/m2与7.0 kJ/m2UV-C照射能够显著降低苹果发病率(P<0.01),且7.0 kJ/m2UV-C照射对发病率的抑制效果更好。接种灰葡萄孢后,3.5 kJ/m2与7.0 kJ/m2UV-C处理发病率均始终低于对照,最后分别有79.5%和64.4% 的伤口发病,较对照降低了16.9%和32.7%。而10.5 kJ/m2UV-C照射在接种后2 d 内抑制发病作用效果最明显,此后发病率迅速上升,接种5 d后甚至超过对照,最终却加重灰霉病的发生。
随着贮藏时间的延长,灰霉病斑不断扩大,但适宜剂量UV-C照射能够有效抑制病斑的扩展。如图1b所示,3.5 kJ/m2和7.0 kJ/m2UV-C处理组的病斑直径始终小于对照,且差异达到显著水平(P<0.01),其中7.0 kJ/m2剂量UV-C处理对灰霉病斑的抑制作用最好。接种5 d 后对照组病斑直径即扩展到20.66 mm,而3.5 kJ/m2和7.0 kJ/m2UV-C处理的仅为16.84 mm和12.98 mm,两种剂量UV-C照射大大降低了灰霉病斑的扩展速度。10.5 kJ/m2UV-C处理在贮藏前4 d对灰霉病斑具有一定的抑制作用,但此后病斑扩展迅速,5 d后高于对照,接种后期反而加快病斑扩大。
因此,适宜剂量UV-C照射能够有效抑制苹果采后灰霉病,其中照射剂量为7.0 kJ/m2的UV-C照射处理效果最好,3.5 kJ/m2UV-C照射次之。照射剂量为10.5 kJ/m2UV-C处理仅在接种后贮藏前期对灰霉病有一定的抑制作用,后期反而加快灰霉的发生。
2.2 UV-C照射对接种苹果几丁质酶和GLU活性的影响

图 2 不同剂量UV-C照射处理对苹果果实几丁质酶活性的影响Fig.2 Effects of different doses of UV-C treatment on CHI activity of‘Red Fuji’ apple fruit
接种灰葡萄孢后,几丁质酶活性均呈现先升高后下降的趋势,UV-C照射能诱导苹果果实几丁质酶活性的提高,但不同剂量的诱导效果不同。如图2所示,照射剂量为3.5 kJ/m2和7.0 kJ/m2UV-C处理果实的几丁质酶活性在整个观察期均高于对照,且差异达到极显著水平(P<0.01),其中照射剂量为7.0 kJ/m2UV-C照射处理的诱导效果更明显。10.5 kJ/m2UV-C照射处理果实的几丁质酶活性在接种后3 d内显著高于其他组,到第3天即达到峰值,较对照提前2 d,随后活性持续降低,接种6 d后低于对照。而7.0 kJ/m2UV-C处理果实的几丁质酶的活性在接种后期仍保持较高水平。因此,照射剂量为7.0 kJ/m2UV-C处理对接种苹果几丁质酶活性的诱导效果最好。
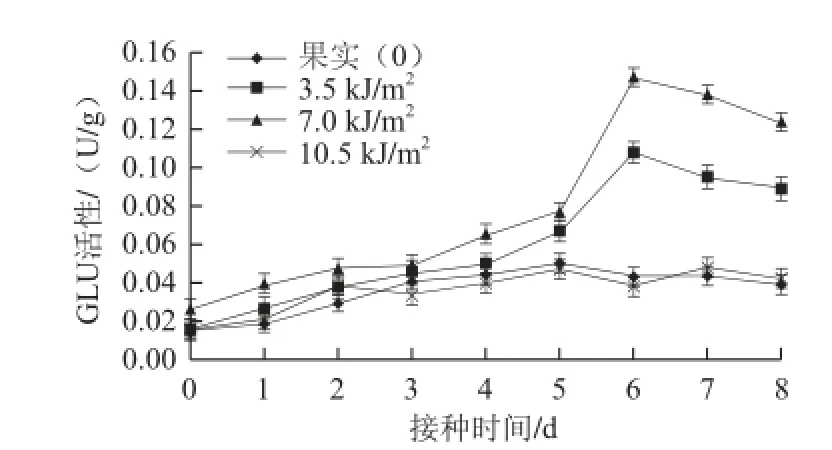
图 3 不同剂量UV-C照射处理对苹果果实GLU活性的影响Fig.3 Effects of different doses of UV-C treatment on β-1,3-glucanase activity of ‘Red Fuji’ apple fruit
不同剂量UV-C照射处理在接种后贮藏前期对苹果果实GLU活性的诱导作用均不显著,而照射剂量为3.5 kJ/m2和7.0 kJ/m2UV-C处理却能诱导该GLU活性在接种后期大幅度升高。如图3所示,在接菌后的前4 d GLU活性略有上升,且各组间无显著差异,但4 d以后照射剂量为3.5 kJ/m2和7.0 kJ/m2UV-C处理组GLU活性开始迅速升高,到第6天达到最大值,较对照最大值分别增加了151.2% 和241.9%,此后活性略有下降,但仍显著高于照(P<0.01)。而10.5 kJ/m2UV-C处理组GLU活性仅在接种后前2 d略高于对照,此后与对照组保持基本一致,无显著差异(P<0.01)。
2.3 UV-C照射处理对接种苹果POD、PPO和PAL活性的影响

图 4 UV-CUV-C照射对接种苹果果实POD活性的影响Fig.4 Effects of UV-C treatments on POD activity of inoculated apple fruit
不同处理对POD的活性变化测定结果表明,POD活性整体上均呈现先升高后下降的趋势,且UV-C照射处理对接种苹果的POD活性具有一定的诱导作用。如图4所示,处理组POD活性的初始值均显著高于对照组(P<0.01),照射剂量为3.5 kJ/m2和7.0 kJ/m2UV-C处理的POD活性在整个观察期均高于对照,且高峰出现时间与对照一致,都在接种后第5天达到最大值,较对照分别提高了30.6%和95.9%。照射剂量为10.5 kJ/m2UV-C处理的POD活性在接种后前2 d高于其他组,活性高峰提前1 d出现,此后活性迅速下降,6 d后低于对照。所以,7.0 kJ/m2UV-C照射处理能够诱导苹果果实POD活性在接种后始终保持较高的水平,3.5 kJ/m2UV-C处理的诱导效果次之,而照射剂量为10.5 kJ/m2UV-C处理仅能在接种后贮藏前期诱导POD活性提高。

图 5 UV-CUV-C照射对接种苹果果实PPO活性的影响Fig.5 Effects of UV-C treatments on PPO activity of inoculated apple fruit
PPO的活性变化结果表明,适宜剂量UV-C照射处理能提高果实PPO活性。如图5所示,处理组与对照组PPO活性的变化趋势均为先上升后下降,照射剂量为3.5 kJ/m2和7.0 kJ/m2UV-C处理的POD活性始终高于对照,且差异显著(P<0.01),其中7.0 kJ/m2UV-C处理的POD 活性高于3.5 kJ/m2UV-C处理的。照射剂量为10.5 kJ/m2UV-C处理组PPO活性的初始值显著高于其他组(P<0.01),并在接种后1 d活性急剧上升,此后活性略有下降,到第4天再次出现高峰,之后活性迅速下降,6 d后低于对照。所以,3.5 kJ/m2和7.0 kJ/m2UV-C照射能够诱导苹果果实的POD活性显著提高,并能在接种后一直保持较高水平,且7.0 kJ/m2照射剂量UV-C照射的诱导效果更为显著(P<0.01)。
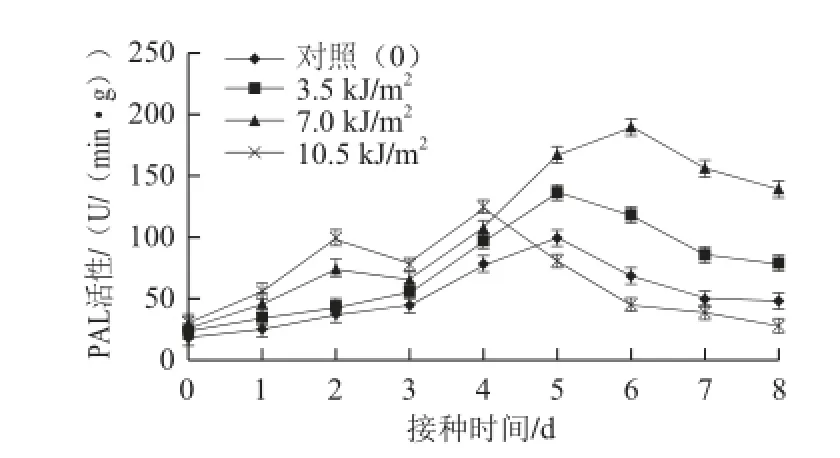
图 6 UV-CUV-C照射对接种苹果果实PAL活性的影响Fig.6 Effects of UV-C treatments on PAL activity of inoculated apple fruit
苹果果实PAL的活性可被适宜剂量的UV-C照射诱导增大。如图6所示,各处理组与对照组的PAL活性随着病害的发展总体上均呈先上升随后下降的趋势。经照射剂量为3.5 kJ/m2和7.0 kJ/m2UV-C照射处理的果实其PAL活性在接种后始终高于对照,并与对照达到极显著差异水平(P<0.01),其中7.0 kJ/m2UV-C处理果实的PAL活性高于3.5 kJ/m2UV-C处理。照射剂量为3.5 kJ/m2UV-C处理与对照的PAL活性均在第5天达到最大值。而照射剂量为7.0 kJ/m2和10.5 kJ/m2UV-C处理果实的PAL活性均在接种后前2 d迅速上升,此后略有下降再升高,分别到第4天和6天达到最大值,较对照分别提前1 d和推迟1 d。由图6可以看出,照射剂量为3.5 kJ/m2和7.0 kJ/m2UV-C处理组的PAL活性在接种后期仍保持较高水平,但照射剂量为10.5 kJ/m2UV-C处理的PAL活性在5 d以后显著低于对照(P<0.05)。因此,3.5 kJ/m2和7.0 kJ/m2UV-C照射能够诱导果实中PAL活性显著提高,并使其始终保持在较高水平,且7.0 kJ/m2UV-C照射的诱导效果更好。
2.4 UV-C 照射处理对接种苹果总酚含量和类黄酮含量的影响
如图7a所示,接种后处理组和对照组的总酚含量都开始上升,且前2 d增加迅速,随后3.5 kJ/m2和7.0 kJ/m2UV-C处理组的总酚含量继续缓慢增加,且在接种后一直显著高于对照(P<0.01),其中7.0 kJ/m2UV-C 处理组的总酚含量最高。对照组和3.5 kJ/m2UV-C处理组的总酚含量均在第6天达到最大值,而照射剂量为7.0 kJ/m2UV-C处理组提前1 d达到最大值。照射剂量为10.5 kJ/m2UV-C处理组的总酚含量在接种2 d 内显著高于其他组(P<0.01),此后含量迅速降低,5 d时总酚含量略微增加后又持续下降,接种6 d后低于对照。因此,3.5 kJ/m2和7.0 kJ/m2剂量UV-C照射处理能够提高诱导苹果果实酚类物质的合成,且7.0 kJ/m2剂量UV-C处理的诱导效果更显著;而10.5 kJ/m2UV-C处理仅在接种后贮藏前期诱导酚类物质的合成,后期总酚含量甚至低于对照。
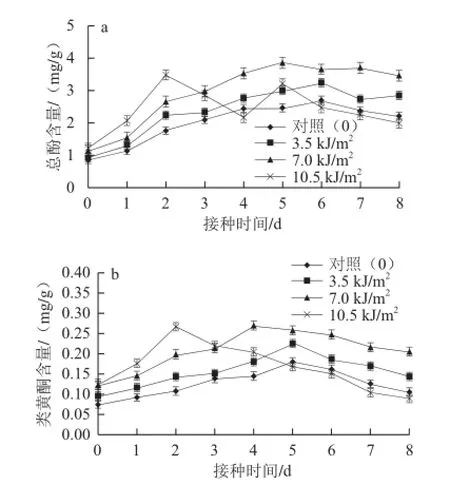
图 7 UV-CUV-C照射对接种苹果果实总酚(a)和类黄酮(b)含量的影响Fig.7 Effects of UV-C treatments on total phenols content and fl avonoid content of inoculated apple fruit
苹果果实接种后类黄酮含量均呈先增加后减少的趋势,适宜剂量UV-C照射对类黄酮的合成具有显著的促进作用。如图7b所示,3.5 kJ/m2和7.0 kJ/m2UV-C处理组的类黄酮含量在接种后均始终高于对照,且与对照差异显著(P<0.01),其中照射剂量为7.0 kJ/m2UV-C处理组的类黄酮含量最高。照射剂量为10.5 kJ/m2UV-C处理的类黄酮含量在接种后2 d内显著高于其他(P<0.01),达到最此后持续下降,接种5 d 后低于对照,但差异不显著(P<0.05)。所以,剂量为3.5 kJ/m2和7.0 kJ/m2的UV-C处理对苹果果实中类黄酮的合成具有明显的促进作用,能够诱导类黄酮含量处于较高水平,且7.0 kJ/m2UV-C照射的诱导作用强于3.5 kJ/m2UV-C处理。
3 讨 论
3.1 UV-C照射处理对苹果采后灰霉病的防治效果
低剂量的UV-C照射对果蔬采后病害的发生具有一定的防治作用,能有效抑制采后腐烂。Romanazzi等[38]的研究表明,用3.6 kJ/m2UV-C照射处理‘Autumn Black’和‘B36-55’两个葡萄品种,贮藏1周后发病率较对照分别降低了36.4%和28.3%左右,与对照差异显著。Vicente等[2]发现,辣椒在冷藏10 d后,7 kJ/m2UV-C处理组无真菌侵染,而对照组的发病率却高达40%。此外,低剂量UV-C照射在番茄、桃、梨、香蕉、韭菜等多种果蔬的延长保鲜,提高贮藏品质上也表现出较好的效果。
本研究结果显示,3.5 kJ/m2和7.0 kJ/m2剂量UV-C照射处理均能有效抑制苹果采后灰霉病,且与对照差异显著(P<0.01),其中7.0 kJ/m2剂量UV-C照射效果最为理想;10.5 kJ/m2剂量UV-C照射处理的苹果在接菌后前3 d发病率与病斑直径均低于对照,但之后发病率急剧上升,病斑迅速扩展,到第5天时发病率与病斑直径均高于对照。因此,低剂量UV-C照射可以有效抑制苹果采后灰霉病的发生与扩展,并且在适宜照射剂量范围内,剂量越高,防治效果越好,这与前人研究[31]一致。吴芳芳等[31]的研究显示,适宜剂量的UV-C照射可抑制苹果采后炭疽病的发生,但抑制效果并不随着照射剂量的增加而增强,当使用大于10.5 kJ/m2照射剂量UV-C 照射时苹果果实表面出现褐斑腐烂,对果实造成伤害。本研究中,经10.5 kJ/m2UV-C照射的苹果在接种灰葡萄孢后前期发病较轻,这可能是UV-C照射诱导果实产生抗性引起的;后期发病严重发病率与病斑直径甚至高于对照,可能因为高剂量UV-C照射对果实造成了伤害,且前期产生的抗性不能消除这种伤害。
3.2 UV-C照射诱导果实抗病性
低剂量的UV-C照射不仅可以直接杀死果蔬表面的病菌,更重要的是可诱导产生抗病机制,增强果蔬的抗病性。Shama等[39]提出,兴奋效应即用低剂量的潜在有害因素去诱导生命体产生胁迫反应。UV-C照射作为一种果蔬贮藏保鲜方法,其根本原理就是利用兴奋剂量的UV-C去诱导新鲜果蔬产生有益反应[40]。UV-C照射对果蔬的有益作用主要表现在诱导产生抗菌物质来抵抗采后病害[41]和延迟成熟衰老保持品质[42-44]两个方面。
UV-C照射能够提高果实抗病性,其机制主要是诱导抗性酶活性的提高,产生抗菌物质,从而抑制病菌的侵染,控制病害发展。几丁质酶和GLU能破坏病原菌的细胞壁结构,与植物们抵抗病源入侵的防御机制密切相关。二者作为病程相关蛋白,受病原菌侵染、机械损伤、环境胁迫等条件的诱导。El Ghaouth等[45]研究显示,UV-C照射处理能够诱导桃果实中这两种酶活性的提高。在本研究中,低剂量UV-C处理能诱导果实中几丁质酶和GLU活性的上升,但对两种酶的影响模式不同:经3.5 kJ/m2和7.0 kJ/m2剂量UV-C处理后苹果果实的几丁质酶活性始终高于对照,且与对照差异显著(P<0.01),而GLU活性在贮藏前期与对照差异不显著,但是在贮藏后期显著高于对照,该结果与陈丽等[46]的一致。
酚类物质是植物次生代谢产物,与果蔬的成熟衰老和抗病性密切相关。苯丙烷类代谢途径是酚类物质的主要合成途径,PAL是此途径的关键酶。POD、PPO不仅参与苯丙烷类代谢途径,与酚类物质合成有关,还参与活性氧代谢。而果实最初的防御反应就是活性氧的产生,活性氧的积累不仅可以作为毒素杀死真菌,而且可以诱发果实的防御体系[47]。大量研究表明,UV-C照射可诱导果蔬中PAL、POD、PPO等防御酶活性的提高。荣瑞芬等[48]报道,UV-C照射诱导绿熟番茄果皮中防御酶活性升高,POD和PPO活性在处理后第2天分别提高了1.3 倍和1.13 倍,PAL活性在第4天提高了1.69 倍。草莓经UV-C照射处理24 h后,PAL和POD的活性显著上升[49]。本研究表明,低剂量的UV-C能够诱导苹果果实中PAL、POD、PPO三种酶活性的提高,7.0 kJ/m2剂量UV-C处理的效果最为显著;10.5 kJ/m2UV-C照射可诱导这3 种酶活性急剧上升,高峰提前,但之后活性急剧下降,甚至低于对照。
随着PAL、POD、PPO三种酶活性的提高,总酚和类黄酮含量也持续增加,7.0 kJ/m2剂量UV-C处理的总酚和类黄酮含量分别在接种后第5天和第4天达到最大值,较对照均提前1 d。在整个观察期3.5 kJ/m2和7.0 kJ/m2剂量UV-C处理组的总酚和类黄酮含量都始终高于对照,发病率与病斑直径也较对照低;10.5 kJ/m2剂量UV-C处理的总酚和类黄酮含量在接种后迅速上升,到第2天达到高峰,而该处理在感病前期的发病率与病斑直径都低于对照,但是后期随着病斑的不断扩大,果实迅速衰败,抗性降低,总酚和类黄酮含量也呈现下降的趋势,甚至低于对照。以上结果表明总酚和类黄酮含量与果实的抗病性呈正相关,且低剂量(3.5 kJ/m2和7.0 kJ/m2)UV-C照射能够诱导果实的抗病性。
本实验结果显示,3.5 kJ/m2和7.0 kJ/m2剂量UV-C照射能够显著降低苹果果实灰霉发病率,抑制病斑扩展,诱导多种防御酶活性及抗性物质含量的提高,且7.0 kJ/m2UV-C照射的效果显著好于3.5 kJ/m2UV-C照射(P<0.01);而10.5 kJ/m2剂量UV-C照射仅在感病初期对灰霉病具有抑制作用,诱导防御酶活性及酚类物质含量的提高,后期却加重灰霉病的发生,防御酶活性和酚类物质含量也随之降低。这表明低剂量短波UV-C照射能够诱导果实产生抗病机制,提高苹果采后抗病性,并且随着照射剂量的增加诱导效果增强;而高剂量的UV-C照射能够诱导果实迅速作出防御反应,抑制灰霉发生,但是这种防御作用不能消除高剂量UV-C照射对果实造成的伤害,最终加速病害的发生与发展。接种灰葡萄孢后,果实发病迅速,病斑很快扩及全果,这推进了果肉组织的衰老和防御功能的衰退,进而导致防御酶活性与酚类物质含量在感病后期下降,并且这种变化滞后于病斑的迅速扩展。
本实验仅就几种抵御酶活性及酚类物质含量方面对UV-C照射的诱导作用进行了初步探索,未能从分子水平和显微结构方面展开研究。UV-C照射诱导抗病性可能涉及到更为复杂的生理生化过程,其机理还需进行深入研究。
4 结 论
不同剂量UV-C照射处理对苹果采后灰霉病的抑制效果不同:低剂量(3.5 kJ/m2和7.0 kJ/m2)UV-C照射处理可有效抑制苹果采后灰霉病的发生与发展,能够较好地降低发病率,减小病斑直径,并且随着照射剂量的增加抑制效果增强;高剂量(10.5 kJ/m2)UV-C照射处理仅在接种灰葡萄孢初期抑制灰霉病的发生,随后却加重病害发展。
UV-C处理可诱导苹果果实中几丁质酶、GLU、POD、PPO以及PAL活性的提高,增加总酚和类黄酮含量。不同剂量UV-C照射处理的诱导模式不尽相同。3.5 kJ/m2和7.0 kJ/m2剂量UV-C照射处理对几丁质酶、POD、PPO以及PAL活性的诱导作用在整个观察期内均显著,对GLU的诱导作用仅在发病显著。10.5 kJ/m2剂量UV-C照射能诱导几丁质酶、POD、PPO以及PAL活性迅速上升,但在发病后期诱导效果不明显。
[1] BERRIE A M, XU Xiangming, JOHNSON D. Lower temperatures more effective than atmosphere modification in controlling Botrytis and Nectria rots in stored apples[J]. Journal of Phytopathology, 2011, 159(2): 73-79.
[2] VICENTE A R, PINED C, LEMOIN L, et al. UV-C treatments reduce decay, retain quality and alleviate chilling injury in pepper[J]. Postharvest Biology and Technology, 2005, 35(1): 69-78.
[3] XU Lingfei, DU Yanmin. Effects of yeast antagonist in combination with UV-C treatment on postharvest diseases of pear fruit[J]. BioControl, 2012, 57(3): 451-461.
[4] ERKAN M, WANG S Y, WANG C Y. Effect of UV treatment on antioxidant capacity, antioxidant enzyme activity and decay in strawberry fruit[J]. Postharvest Biology and Technology, 2008, 48(2): 163-171.
[5] 荣瑞芬, 于涛. 短波紫外线辐照对草莓贮藏保鲜效果的影响[J]. 食品科学, 2003, 24(1): 146-149.
[6] JAGADEESH S L, CHARLES M T, GARIEPY Y, et al. Infl uence of postharvest UV-C hormesis on the bioactive components of tomato during post-treatment handling[J]. Food and Bioprocess Technology, 2011, 4(8): 1463-1472.
[7] 刘长虹, 陆仙英, 蔡路昀, 等. 短波紫外线处理对采后番茄抗氧化活性的影响[J]. 农业机械学, 2011, 42(4): 116-126.
[8] 陆仙英, 刘长虹, 蒋振晖. 采后UV-C处理对延缓香梨软化及相关酶活性的影响[J]. 中国食品学报, 2012, 12(7): 134-139.
[9] 荣瑞芬, 冯双庆. 不同剂量短波紫外线照射对采后番茄后熟和发病的影响[J]. 中国农业大学学报, 2001, 6(1): 68-73.
[10] LI Dongdong, LUO Zisheng, MOU Wangshu, et al. ABA and UV-C effects on quality, antioxidant capacity and anthocyanin contents of strawberry fruit (Fragaria ananassa Duch)[J]. Postharvest Biology and Technology, 2014, 90: 56-62.
[11] BINTSIS T, LITOPOULOU-TZANETALI E, ROBINSON R K. Existing and potential applications of ultraviolet light in food industry: a critical review[J]. Journal of the Science of Food and Agriculture, 2000, 80(6): 637-645.
[12] KEYSER M, MŰLLER I A, CILLIERS F B, et al. Ultraviolet radiation as a non-thermal treatment for the inactivation of microorganisms in fruit juice[J]. Innovative Food Science and Emerging Technologies, 2008, 9(3): 348-354.
[13] BEN-YEHOSHUA S, MERCIER J. Environmentally friendly technologies for agricultural produce quality: UV irradiation, biological agents, and natural compounds for controlling postharvest decay in fresh fruits and vegetables[M]. CRC Press, 2005: 265-299.
[14] SCHENK M, GUERRERO S, ALZAMORA M S. Response of some microorganisms to ultraviolet treatment on fresh-cut pear[J]. Food and Bioprocess Technology, 2008, 1(4): 384-392.
[15] MAHARAJ R, ARULJ, NADEAU P. UV-C irradiation effects on levels of enzymic and non-enzymic phytochemicals in tomato[J]. Innovative Food Science and Emerging Technologies, 2014, 21: 99-106.
[16] CHARLES M T, BENHAMOU N, ARUL J. Physiological basis of UV-C induced resistance to Botrytis cinema in tomato fruit.Ultrastructural modifications and their impact on fungal colonization[J]. Postharvest Biology and Technology, 2008, 47(1): 27-40.
[17] CHARLES M T, TANO K, ASSELIN A, et al. Physiological basis of UV-C induced resistance to Botrytis cinerea in tomato fruit. V. Constitutive defence enzymes and inducible pathogenesisrelated proteins[J]. Postharvest Biology and Technology, 2009, 51(3): 414-424.
[18] CHISARI M, BARBAGALLO R N, SPAGNAQ A F. Improving the quality of fresh-cut melon through inactivation of degradative oxidase and pectinase enzymatic activities by UV-C treatment[J]. International Journal of Food Science and Technology, 2011, 46(3): 463-468.
[19] EICHHOLZ I, HUYSKENS KEIL S, KELLER A, et al. UV-B induced changes of volatile metabolites and phenolic compounds in blueberries (Vaccinium corymbosum L.)[J]. Food Chemistry, 2011, 126(1): 60-64.
[20] PERKINS-VEAZIE P, COLLINS J K, HOWARD L. Blueberry fruit response to postharvest application of ultraviolet radiation[J]. Postharvest Biology and Technology, 2008, 47(3): 280-285.
[21] JIANG T, JAHANGIR M M, JIANG Z, et al. Influence of UV-C treatment on antioxidant capacity, antioxidant enzyme activity and texture of postharvest shiitake (Lentinus edodes) mushrooms during storage[J]. Postharvest Biology and Technology, 2010, 56(3): 209-215.
[22] KAEWSUKSAENG S, URANO Y, AIAMLA-OR S, et al. Effect of UV-B irradiation on chlorophyll-degrading enzyme activities and postharvest quality in stored lime (Citrus latifolia Tan.) fruit[J]. Postharvest Biology and Technology, 2011, 61(2): 124-130.
[23] PONGPRASERT N, SEKOZAWA Y, SUGAYA S, et al. A novel postharvest UV-C treatment to reduce chilling injury (membrane damage, browning and chlorophyll degradation) in banana peel[J]. Scientia Horticulturae, 2011, 130(1): 3-77.
[24] POMBO M A, DOAO M C, MARTINEZ G A, et al. UV-C irradiation delays strawberry fruit softening and modifies the expression ofgenes involved in cell wall degradation[J]. Postharvest Biology and Technology, 2009, 51(2): 141-148.
[25] SYAMALADEVI R M, LUPIEN S L, BHUNIA K, et al. UV-C light inactivation kinetics of Penicillium expansum on pear surfaces: infl uence on physicochemical and sensory quality during storage[J]. Postharvest Biology and Technology, 2014, 87: 27-32.
[26] CUCI M J A, VICENTE A R, CONCELLON A, et al. Changes in red pepper antioxidants as affected by UV-C treatments and storage at chilling temperatures[J]. LWT-Food Science and Technology, 2011, 44(7): 1666-1671.
[27] 韩晓旭, 刘长虹, 蔡路昀, 等. 采后UV-C 照射对芦柑抗病性和品质的影响[J]. 中国食品学报, 2012, 12(7): 128-133.
[28] STEVENS C, WILSON C L, LU J Y, et al. Plant hormesis induced by ultraviolet light-C for controlling postharvest diseases of tree fruits[J]. Crop Protection, 1996, 2(15): 129-134.
[29] WISON C L, UPCHURCH B, El GHAOUTH A, et al. Using an online UV-C apparatus to treat harvested fruit for controlling postharvest decay[J]. HortTechnology, 1997, 7(3): 278-282.
[30] de CAPDEVILLE G, WILSON C L, BEER S V, et al. Alternative disease control agents induce resistance to blue mold in harvested ‘Red Delicious’ apple fruit[J]. Phytopathology, 2002, 92(8): 900-908.
[31] 吴芳芳, 郑有飞, 檀根甲, 等. UV-C 对苹果采后炭疽病的控制[J]. 农业环境科学学报, 2006, 25(4): 1081-1083.
[32] 袁仲玉, 周会玲, 田蓉, 等. 芦荟粗提物对苹果采后灰霉病的防治效果与机理[J]. 农业工程学报, 2014, 30(4): 255-163.
[33] de RODRÍGUEZ D J, GARCÍA R R, CASTILLOA F D H, et al. In vitro antifungal activity of extracts of Mexican Chihuahua Desert plants against postharvest fruit fungi[J]. Industrial Crops and Products, 2011, 34(1): 960-966.
[34] ZHU S J, MA B C. Benzothiadiazole or methyl jasmonate induced resistance to Colletotrichum musae in harvested banana fruit is related to elevated defense enzyme activities[J]. Journal of Horticultural Science and Biotechnology, 2007, 82(4): 500-506.
[35] ASSIS J S, MALDONADO R, MUNOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biology and Technology, 2001, 23(1): 33-39.
[36] TOOR R K, SAVAGE G P. Antioxidant activity in different fractions of tomatoes[J]. Food Research International, 2005, 38(5): 487-494.
[37] GONZÁLEZ-AGUILAR G A, VILLEGAS-OCHOA M A, MARTÍNEZ-TÉLLEZ M A, et al. Improving antioxidant capacity of fresh-cut mangoes treated with UV-C[J]. Journal of Food Science, 2007, 72(3): 197-202.
[38] ROMANAZZI G, GABLER F M, SMILANICK J L. Preharvest chitosan and postharvest UV irradiation treatments suppress gray mold of table grapes[J]. The American Phytopathological Society, 2006, 90(4): 445-450.
[39] SHAMA G, ALDERSON P. UV hormesis in fruit: a concept ripe for commercialization[J]. Trends in Food Science and Technology, 2005, 16(4): 128-136.
[40] ARUL J, MERCIER J, CHARLES M T, et al. Physical control methods in plant protection: phytochemical treatment for control of post-harvest diseases in horticulture crops[M]. Paris: Jointly Published with INRA, 2001: 146-161.
[41] JAGADEESH S L, CHARLES M T, GARIEPY Y, et al. Infl uence of postharvest UV-C hormesis on the bioactive components of tomato during post-treatment handling[J]. Food and Bioprocess Technology, 2011, 4(8): 1463-1472.
[42] PONGPRASERT N, SEKOZAWA Y, SUGAYA S, et al. The role and mode of action of UV-C hormesis in reducing cellular oxidative stress and the consequential chilling injury of banana fruit peel[J]. International Food Research Journal, 2011, 18(2): 741-749.
[43] GONZÁLEZ-AGUILAR G A, ZAVALETA-GATICA R, TIZNADOHERNÁNDEZ M E. Improving postharvest quality of mango ‘Haden’by UV-C treatment[J]. Postharvest Biology Technology, 2011, 45(1): 108-116.
[44] CHERUBINI A, VIGNA G B, ZULIANI G, et al. Role of antioxidants in atherosclerosis: epidemiological and clinical update[J]. Current Pharmaceutical Design, 2005, 11(16): 2017-2032.
[45] El GHAOUTH A, WILSON C L, CALLAHAN A M. Induction of chitinase, β-1,3-glucanase, and phenylalanine ammonia lyase in peach fruit by UV-C treatment[J]. Phytopathology, 2003, 93(3): 349-355.
[46] 陈丽, 朱世江, 朱虹. 热水处理减轻采后香蕉病害的效果及其机理探讨[J]. 农业工程学报, 2006, 22(8): 224-229.
[47] SHAO Xingfeng, TU Kang, TU Sicong, et al. Effects of heat treatment on wound healing in Gala and Red Fuji apple fruits[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4303-4309.
[48] 荣瑞芬, 冯双庆. 不同剂量短波紫外线照射对采后番茄后熟和发病的影响[J]. 中国农业大学学报, 2001, 6(1): 68-73.
[49] POMOBO M A, ROSLI H G, MARTINEZ G A, et al. UV-C treatment affects the expression and activity of defense genes in strawberry fruit (Fragaria×ananassa Duch.)[J]. Postharvest Biology and Technology, 2011, 59(1): 94-102.
Effects and Mechanism of UV-C Treatments on Control of Botrytis cinerea in Postharvest Apples
ZHANG Xiaoxiao, ZHOU Huiling*, TIAN Rong, ZHOU Xiaowan, FAN Sheng
(College of Horticulture, Northwest A&F University, Yangling 712100, China)
This study aimed to investigate the effects and mechanism of UV-C treatments on control of botrytis in postharvest apples. Red Fuji apple fruits were treated by UV-C at different doses (3.5, 7.0, and 10.5 kJ/m2) and, two days later at normal temperature (20 ± 1) ℃, inoculated with conidial suspension of Botrytis cinerea, and inoculated samples without UV-C treatment were used as control. The results showed that UV-C treatments at 3.5 and 7.0 kJ/m2signifi cantly decreased the incidence of gray mold rot, and effectively suppressed the expansion of lesions caused by B. cinerea, and the suppression effect of UV-C treatment at 7.0 kJ/m2UV-C on gray mold was better than at 3.5 kJ/m2. However, UV-C treatment at 10.5 kJ/m2had an adverse effect on gray mold of apple fruits only after inoculation for the earlier days while at the later stage after inoculation, and even increased morbidity of fruits and promoted the expansion of lesions. In addition, the activities of chitinase (CHT), β-1,3-glucanase (GLU), peroxidase (POD), polyphenol oxidase (PPO) and phenylalanine ammonia-lyase (PAL) of apple fruits were promoted remarkably by UV-C treatments at 3.5 and 7.0 kJ/m2, and phenolics content was also increased signifi cantly. The promoting effects of UVC-treatment at 10.5 kJ/m2on those defense enzymes activities and phenolics content was found only in the fi rst several days after inoculation.
apple; gray mold; UV-C; disease control; mechanisms; defense enzyme activity
S184
A
1002-6630(2015)02-0242-08
10.7506/spkx1002-6630-201502047
2014-06-25
国家现代苹果产业技术体系建设专项(nycylx-08-05-02);西北农林科技大学基本科研业务专项(Z109021201)
张晓晓(1989—),女,硕士,研究方向为园艺产品采后生理及贮藏保鲜。E-mail:1049873144@qq.com
*通信作者:周会玲(1969—),女,副教授,博士,研究方向为园艺产品采后处理及贮藏保鲜。E-mail:zhouhuiling@nwsuf.edu.cn
