产几丁质酶的无色杆菌ZWW8的发酵产酶及酶学性质研究
2021-05-14张瑶心王亮节郑文徐汉琴郑恋钟静
张瑶心 王亮节 郑文 徐汉琴 郑恋 钟静
(湖北第二师范学院化学与生命科学学院 植物抗癌活性物质提纯与应用湖北省重点实验室,武汉 430205)
几丁质(Chitin)是由N-乙酰-D-葡萄糖胺以β-1,4糖苷键连接而成的多聚物,是虾蟹等甲壳动物的壳、昆虫的外骨骼和许多真菌的细胞壁的重要组成成分,在自然界中的含量仅次于纤维素[1]。植物、动物及微生物都能产生几丁质酶切割β-1,4糖苷键来降解几丁质,以实现各自的生理功能。根据作用方式的差异,几丁质酶可以被分为内切几丁质酶和外切几丁质酶。内切几丁质酶随机地降解几丁质链内部的β-1,4糖苷键,产生各种不同大小的低聚糖。而外切几丁质酶从几丁质的非还原端逐个切割,释放几丁二糖[2]。许多微生物会产生几个不同切割方式的几丁质酶,协同作用完成对几丁质的降解。
近年来,几丁质酶因在制备几丁寡糖、处理海洋废弃物以及农业生物防治等方面具有大的应用潜力而备受关注[3-5]。几丁质酶通过降解昆虫的外骨骼及其围食膜中的几丁质,使其丧失生命活动能力,从而杀死害虫;几丁质酶通过降解真菌细胞壁中的几丁质,破坏真菌细胞结构,从而抑制真菌的生长。此外,将几丁质酶基因导入植物细胞中以构建转基因植株,能抵抗真菌和害虫的侵害[6-9]。利用微生物产生的几丁质酶处理虾蟹壳废弃物,不仅可以大大缓解环境污染的压力,还可以变废为宝、创造几丁寡糖等高附加值产品,作为药物输送载体、抗氧化剂和食品保存中的抗菌材料,可用于止血、伤口愈合、癌症预防和治疗等方面[10]。但目前的研究还存在几丁质酶产生菌发酵产酶水平低、产酶周期长等问题,限制了其应用。此外,工业生产时常会涉及如高温、强酸性、强碱性和低水活度环境等不利条件,常规酶容易聚集沉淀并丧失活性及稳定性,需要开发高效、稳定的新型几丁质酶。
无色杆菌属于肠杆菌科Enterobacteriaceae,能通过寄生在线虫肠道内,侵入各种昆虫体内,对线虫和各种鳞翅目昆虫有杀伤作用。近些年来,已经有一些关于无色杆菌属的细菌产几丁质酶的报道。1976年,Chigaleĭchik等[11]分离得到一株在几丁质中生长并产生胞外几丁质酶的液化无色杆菌(Achromobacter liquefaciens)。1993 年,Takashi等[12]分离得到了一株能够降解几丁质的无色杆菌,该菌株具有抗菌、抗线虫及活化植物细胞的能力。2015年,Bholay等[13]从印度渔业固体废物中分离得到的反硝化无色杆菌Achromobacter denitrificans,在以几丁质为唯一碳源的培养基中能产生外切几丁质酶。本实验室从中国湖北省武汉市的虾壳堆积处的土壤中筛选得到一株能产生几丁质酶的细菌ZWW8,并发现其几丁质酶能在高盐条件下降解几丁质,通过16S rDNA鉴定其属于Achromobacter属。目前,国内外还没有关于Achromobacter属细菌产耐盐几丁质酶的研究报道。本文系统研究了产几丁质酶的无色杆菌的鉴定,产几丁质酶发酵条件优化及几丁质酶的酶学性质检测,旨在发掘新的产耐盐几丁质酶的菌株,提高几丁质酶产量和酶活力,为筛选适用于工业生产的高效稳定的几丁质酶提供理论依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 主要仪器与试剂 几丁质粉末购自Sigma公司;胰蛋白胨和酵母提取物购自Oxoid公司;水溶性壳聚糖购自山东奥康生物科技有限公司;壳聚糖粉末购自上海如吉生物科技发展有限公司;N-乙酰-D-氨基葡萄糖购自阿拉丁公司;Pfu DNA聚合酶和DNA marker购自全式金生物技术有限公司;DNA胶回收试剂盒购自OMEGA公司;低分子量蛋白质 Marker购自中国科学院上海生命科学研究院;K2HPO4、KH2PO4、MgSO4、FeSO4·7H2O、NaCl、NH4Cl、HCl、NaOH、琼脂粉、乙酸、生理盐水、3,5-二硝基水杨酸、尿素、葡萄糖、NH4NO3、NaNO3、(NH4)2SO4等化学试剂为国产分析纯。
恒温金属浴(TU-10):上海一恒科技有限公司;气浴恒温振荡器(THZ-92B):上海博讯医疗生物仪器有限公司;紫外可见分光光度计(UV-5200PC):上海元析仪器有限公司;梯度热循环PCR仪(C1000 Touch):Bio-Rad公司;化学发光凝胶成像系统(Chemi Doc XRS+):Bio-Rad公司;连续光谱光吸收酶标仪(Spectra Max Plus 384):Molecular Devices公司
1.1.2 培养基及溶液 种子培养基:NaCl 10 g,酵母粉 5 g,蛋白胨 10 g,蒸馏水1 L,pH 自然。
初始发酵培养基:NaCl 10 g,MgSO4·7H2O 0.5 g,CaCl20.53 g,KH2PO40.3 g,K2HPO40.7 g,酵母粉 1 g,粉末几丁质 5 g,蒸馏水1 L,pH自然。
摇瓶发酵培养基:NaCl 10 g,MgSO4·7H2O 0.5 g,CaCl20.53 g,KH2PO40.3 g,K2HPO40.7 g,酵母粉 1 g,胶体几丁质 5 g,NH4Cl 3 g,蒸馏水1 L,pH 7.0。
胶体几丁质:10 g几丁质粉末溶解0.4 L 浓盐酸中,离心后将上清加入4 L去离子水,静置过夜后离心弃去上清,将沉淀用去离子水重悬,并加入NaOH溶液调节pH至7.0,并去离子水洗涤3次。取4 mL胶体几丁质离心弃上清,将沉淀在60℃烘箱烘干至恒重,计算胶体几丁质浓度。
胶体壳聚糖:10 g壳聚糖粉末溶解于0.4 L 1%乙酸中,将上清加入4 L去离子水,静置过夜后离心弃去上清,将沉淀用去离子水洗涤3次。取4 mL胶体壳聚糖离心弃上清,将沉淀在60℃烘箱烘干至恒重,计算胶体壳聚糖浓度。
几丁质亲和层析纯化几丁质酶所用溶液:洗涤缓冲液(g/L):NaCl 150,KH2PO40.3,K2HPO40.7,pH 7.0;洗脱缓冲液(g/L):Urea 480,KH2PO40.3,K2HPO40.7,pH 7.0;透析缓冲液(g/L):NaCl 10,KH2PO40.3,K2HPO40.7,pH 7.0。
1.1.3 实验样品 本课题组从湖北某高校校园中虾壳堆积处的土壤中取样,进行富集培养之后,采用透明圈法,以胶体几丁质为唯一碳源,筛选出产几丁质酶活性高的菌株ZWW8。
1.2 方法
1.2.1 菌株的筛选与分子生物学鉴定 利用原核生物 16S rDNA 通用引物 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-TACGGTTACCTTGTTACGACTT-3′),以ZWW8的菌液为模板进行PCR,电泳后用胶回收试剂盒纯化DNA片段,并送样测序,测序结果包含V1-V8的高变区和部分V9区,可用来进行物种初步鉴定及比较亲缘关系[14-15]。在NCBI网站对测序结果进行BLAST搜索,选取与其相似性较高的16S rDNA序列进行比对,并用MEGA 6.0构建系统发育树。
1.2.2 几丁质酶活性的测定方法 取200 μL酶液加入200 μL 的1%(W/V)胶体几丁质,混合后置于45℃反应保温1 h,离心,取上清300 μL加入300 μL DNS混匀,100℃加热20 min。等样品冷却后,12 000 r/min离心10 min,取上清测定其在540 nm处的吸光值,对照组所用为经过100℃灭活后的酶液。实验组和对照组的差值反映了几丁质酶的活性。根据N-乙酰葡萄糖胺标准曲线来计算还原糖含量。酶活力单位定义:在合适条件下,每分钟产生1 μmol的N-乙酰氨基葡萄糖所需的酶量为1个酶活力单位(U)。
1.2.3 产酶条件优化 在初始发酵培养基的基础上,对培养基中的碳源、氮源、温度、初始pH 和产酶时间进行优化。在初始培养基中分别加入0.5%(W/V)的粉末几丁质、胶体几丁质、水溶性壳聚糖、粉末壳聚糖、葡萄糖或N-乙酰葡萄糖胺作为碳源,确定最佳碳源,并检测碳源添加量对产酶的影响。在碳源优化的基础上,分别加入0.3%(W/V)的(NH4)2SO4、NH4NO3、NH4Cl、NaNO3、尿素及蛋白胨作为氮源,检测发酵上清的几丁质酶活性,确定最佳氮源。在碳源和氮源优化后的培养基基础上,依次考查将发酵培养基初始pH值(5.0-9.0),发酵温度(28-45℃)和发酵时间对胞外上清几丁质酶产量的影响,确定最优的发酵产酶条件。
1.2.4 几丁质酶的酶学性质研究
1.2.4.1 温度对几丁质酶活力的影响 在pH 7.0,1%NaCl条件下,以胶体几丁质为底物,检测粗酶液在不同温度条件下的活性,以最高酶活为100%,计算其相对酶活。
1.2.4.2 pH 对几丁质酶活力的影响 在1% NaCl,45℃条件下,检测粗酶液在不同pH条件下的活性,以最高酶活为100%,计算其相对酶活。
1.2.4.3 NaCl浓度对几丁质酶活性的影响 在pH 7.0,45℃条件下,检测粗酶液在不同NaCl浓度中的活性,以最高酶活为100%,计算其相对酶活。
1.2.4.4 金属离子对几丁质酶活性的影响 向粗酶液中加入10 mmol/L EDTA,并透析除去EDTA,再向酶液中加入5 mmol/L不同金属离子,检测其活性,以不加入金属离子的酶液的酶活为100%,计算几丁质酶在不同金属离子存在时的相对酶活。
1.2.4.6 NaCl浓度对稳定性的影响 向粗酶液中加入NaCl配制成不同NaCl浓度的酶液,将各组酶液于55℃保温30 min,再检测酶活。分别以未经过热处理的各NaCl浓度的酶液的活力定义为100%,计算各NaCl浓度中几丁质酶的残余活性百分比。
1.2.4.7 NaCl浓度对几丁质酶的几丁质结合能力的影响 向粗酶液中加入NaCl配制成不同NaCl浓度的酶液,取1 mL 酶液加入0.2 mL相同NaCl浓度的1%(W/V)胶体几丁质,混合后静置30 min,然后离心检测上清的几丁质酶活性,分别以与几丁质结合前的各NaCl浓度酶液的活性定义为100%,计算几丁质酶在不同NaCl浓度中与几丁质的结合率。
1.2.5 几丁质酶的纯化及SDS-PAGE 取20 mL 含有15% NaCl的几丁质粗酶液,加入几丁质亲和层析柱,收集流出液并反复上样3次,然后依次加入10 mL 洗涤液和5 mL洗脱液,收集流出液。将洗脱液透析复性,并检测几丁质酶活性。将粗酶液、上样流出液、洗涤液和洗脱液各0.4 mL进行TCA沉淀制样并进行SDS-PAGE。SDS-PAGE所用分离胶浓度为12.5%,缩胶浓度为4.5%,电泳结束后用考马斯亮蓝R-250染色。
1.2.6 数据分析 试验数据采用Excel 软件进行分析,试验中各发酵条件的优化和酶学性质检测均为3 次平行实验,结果以3次实验的平均值±标准差的形式展现。
2 结果
2.1 产几丁质酶菌株的筛选和鉴定
在NCBI网站对ZWW8菌株的16S rDNA测序结果进行BLAST搜索和序列比对,发现其与Achromobacter属菌株的16S rDNA序列相似性达到99.9%以上。图1 表明ZWW8菌株为Achromobacter属,并与Achromobacter mucicolens的亲缘关系较近。
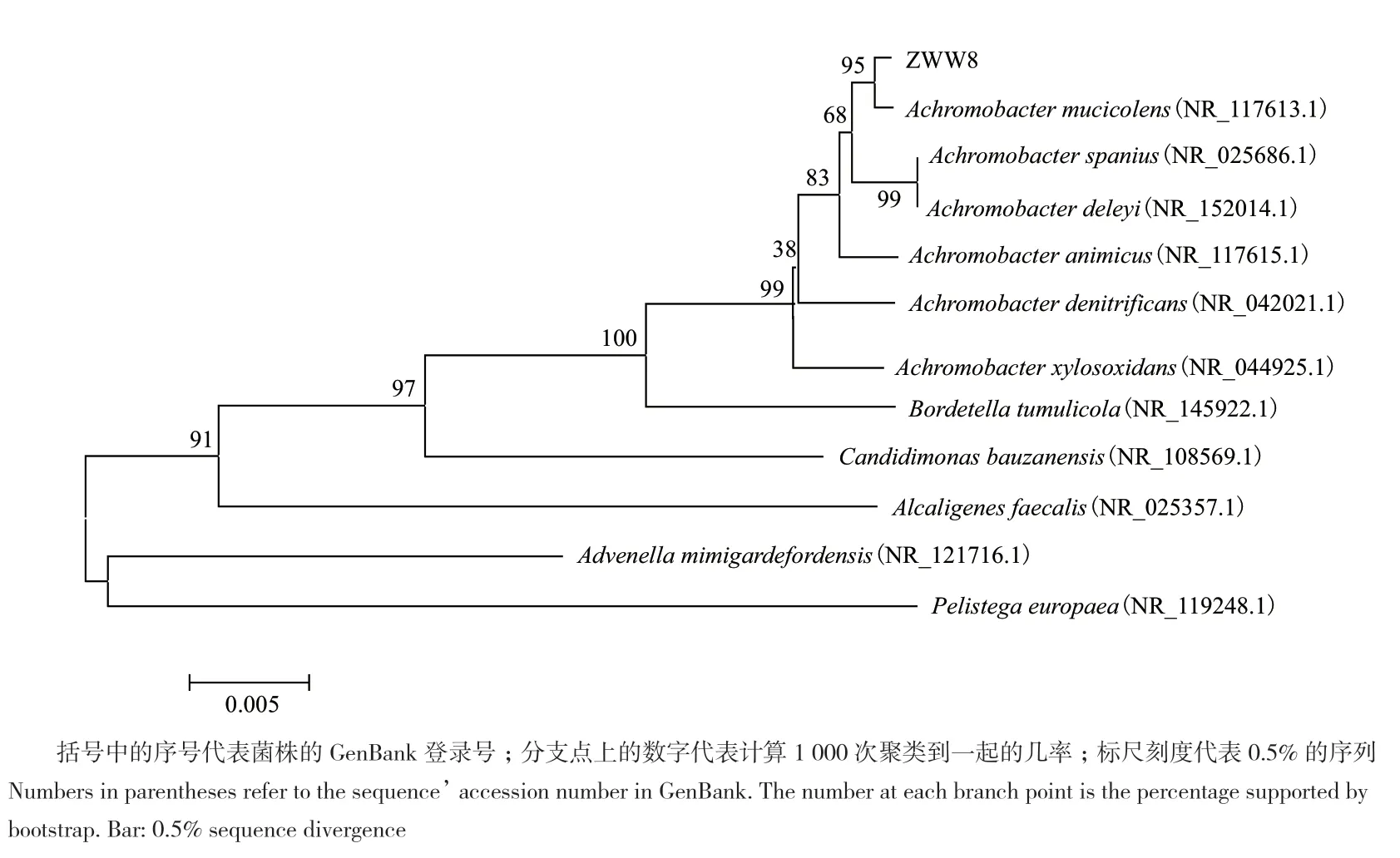
图1 基于16S rDNA序列构建的ZWW8菌株的系统进化树Figure 1 Phylogenetic tree of strain ZWW8 based on 16S rDNA sequences
2.2 ZWW8菌株产几丁质酶条件的优化
以0.5%的粉末几丁质为唯一碳源,初始产酶量为4.2 U/L。
以盾构隧道底部无溶洞的情况为例,通过计算可得到管片的极限受拉疲劳次数为1.358×107次,极限受压疲劳次数为3.147×1014次,两者之间相差7个数量级,说明管片的疲劳寿命是由极限受拉疲劳次数决定的。
2.2.1 碳源对ZWW8菌株产几丁质酶的影响 将ZWW8菌株分别在以葡萄糖、胶体几丁质、粉末几丁质、粉末壳聚糖、水溶性壳聚糖和N-乙酰葡萄糖胺为碳源的培养基中培养,检测发酵上清中的几丁质酶活性。如表1所示,以胶体几丁质为碳源时,发酵产几丁质酶量最高,能达到20.0 U/L;粉末几丁质次之,发酵产酶量达到4.2 U/L。当以胶体壳聚糖、葡萄糖、水溶性壳聚糖和N-乙酰葡萄糖胺为碳源时,ZWW8菌株均不产生几丁质酶。
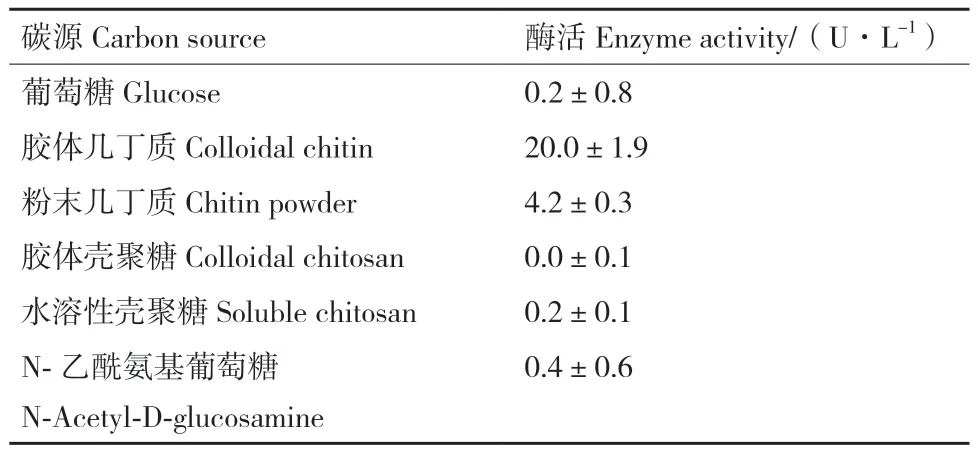
表1 不同碳源对ZWW8菌株发酵产几丁质酶的影响Table 1 Effect of different carbon sources on chitinase production by Achromobacter sp. ZWW8
2.2.2 氮源对ZWW8产几丁质酶的影响 在碳源优化的基础上,将ZWW8菌株分别在以(NH4)2SO4、NH4NO3、NH4Cl、NaNO3尿素和蛋白胨为氮源的发酵培养基中培养,检测上清中几丁质酶活性。如表2 所示,NH4NO3、NH4Cl、(NH4)2SO4和蛋白胨作为氮源时几丁质酶的表达量较高,尿素和NaNO3作为氮源时几丁质酶的表达量较低。以NH4Cl作为氮源时,发酵产酶量最高,可达到20.7 U/L。

表2 不同氮源对ZWW8菌株发酵产几丁质酶的影响Table2 Effect of different nitrogen sources on chitinase production by Achromobacter sp. ZWW8
2.2.3 初始pH对ZWW8菌株产几丁质酶的影响 在碳源和氮源优化的基础上,将ZWW8菌株分别在初始pH值为5-9的发酵培养基中培养,检测其发酵上清的活性。图2表明,ZWW8菌株在pH 5-9均能产生几丁质酶,且在pH 7时产酶量最高,能达到32 U/L。

图2 培养基初始pH对ZWW8菌株产几丁质酶的影响Fig.2 Effect of initial medium pH on chitinase production by Achromobacter sp. ZWW8
2.2.4 温度对ZWW8产几丁质酶的影响 将ZWW8菌株在优化后的培养基中分别在28-45℃培养,检测上清中几丁质酶活性。如图3所示,ZWW8菌株在不同温度的几丁质酶产量有显著差距,28℃时不产生几丁质酶,而37℃产酶量最高,可以达到33.9 U/L。

图3 温度对ZWW8菌株产几丁质酶的影响Fig.3 Effect of temperatures on chitinase production by Achromobacter sp. ZWW8
2.2.5 发酵时间对ZWW8菌株产几丁质酶的影响 在发酵培养基配方和培养温度优化的基础上,检测ZWW8菌株在不同时间的产酶量。如图4所示,ZWW8菌株培养1 d后就开始大量分泌几丁质酶,并在第2天产酶量最大,达到32 U/L。此后几丁质酶产量开始下降,第5天时几丁质酶产量仅为3 U/L。
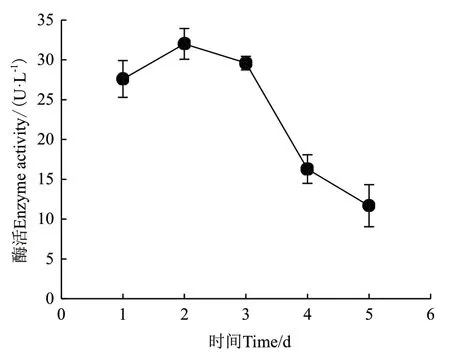
图4 发酵时间对ZWW8菌株产几丁质酶的影响Fig.4 Effect of fermentation time on chitinase production by strain ZWW8
2.3 ZWW8几丁质酶的酶学特性
2.3.1 温度对ZWW8菌株几丁质酶活性的影响 检测ZWW8菌株几丁质酶液在10-65℃条件下的活性,结果如图5。几丁质酶在50℃活性最高,且在65℃时活性维持最大活性的50%,在10℃能维持最高活性的25%左右。
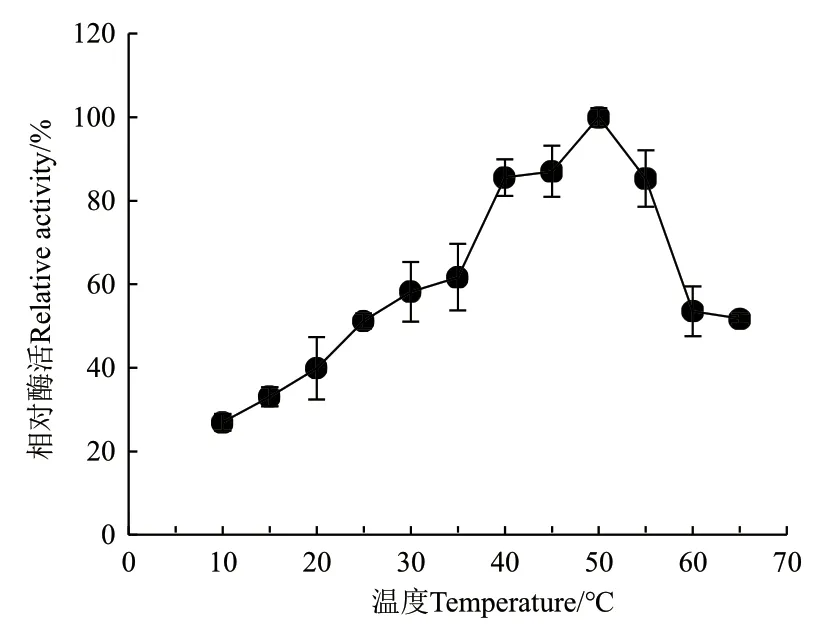
图5 温度对ZWW8菌株几丁质酶活性的影响Fig.5 Effect of temperature on chitinase activity by strain ZWW8
2.3.2 pH对ZWW8几丁质酶活性的影响 检测ZWW8菌株几丁质酶在pH 3-9条件下的活性。如图6所示,随着pH值上升,酶的活性呈现先增加后下降的趋势,pH 5.5时酶的活性达到最高,并在pH 5-7条件下具有较高的活性。

图6 pH对ZWW8菌株几丁质酶活性的影响Fig.6 Effect of pH on chitinase activity by strain ZWW8
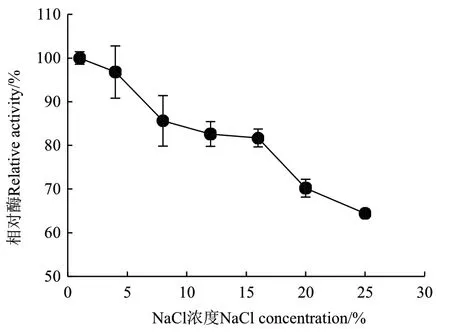
图7 NaCl浓度对ZWW8菌株几丁质酶活性的影响Fig.7 Effect of NaCl concentration on chitinase activity by strain ZWW8
2.3.3 NaCl浓度对ZWW8菌株几丁质酶活性的影响 检测ZWW8菌株几丁质酶在1%-25% NaCl条件下的活性。如图7所示,随着NaCl浓度上升,活性下降。NaCl浓度为1%时几丁质酶的活性最高,而当NaCl浓度为25%时,仍然能保持最大活性的64%。
2.3.4 金属离子对ZWW8菌株几丁质酶活性的影响 检测 5 mmol/L 的 Hg2+、Zn2+、Mg2+、Ca2+、Ag+、Cu2+和Ni2+等金属离子对ZWW8几丁质酶活性的影响,如表3所示,Cu2+和Zn2+对酶活有抑制作用,Hg2+可导致几丁质酶完全失活,Ca2+和Ni2+有一定的促进作用。
2.3.5 温度对ZWW8菌株几丁质酶热稳定的影响 检测ZWW菌株几丁质酶液分别在40-60℃保温后的残余活性,如图8所示,ZWW菌株的几丁质酶在40℃稳定性较好,经过1 h保温活性没有明显变化。随着温度升高,几丁质酶的稳定性逐渐下降,60℃保温20 min后残余活性仅有10%。
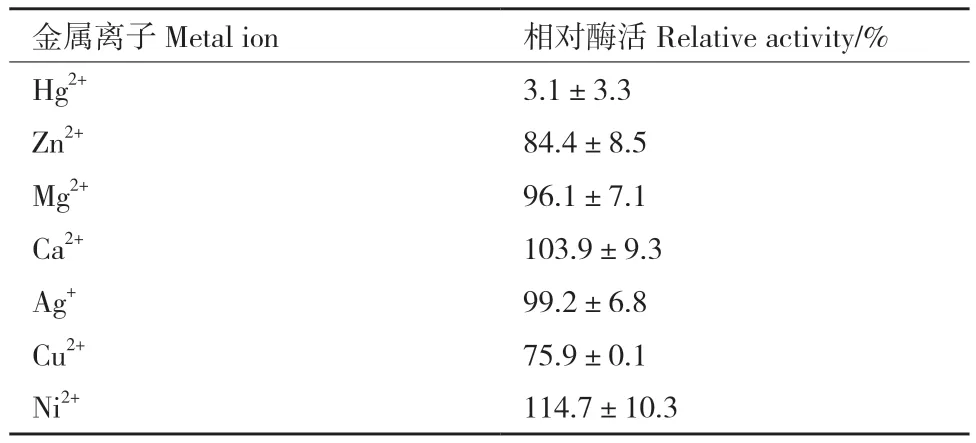
表3 金属离子对ZWW8菌株几丁质酶活性的影响Table 3 Effect of metal ions on chitinase activity by strain ZWW8
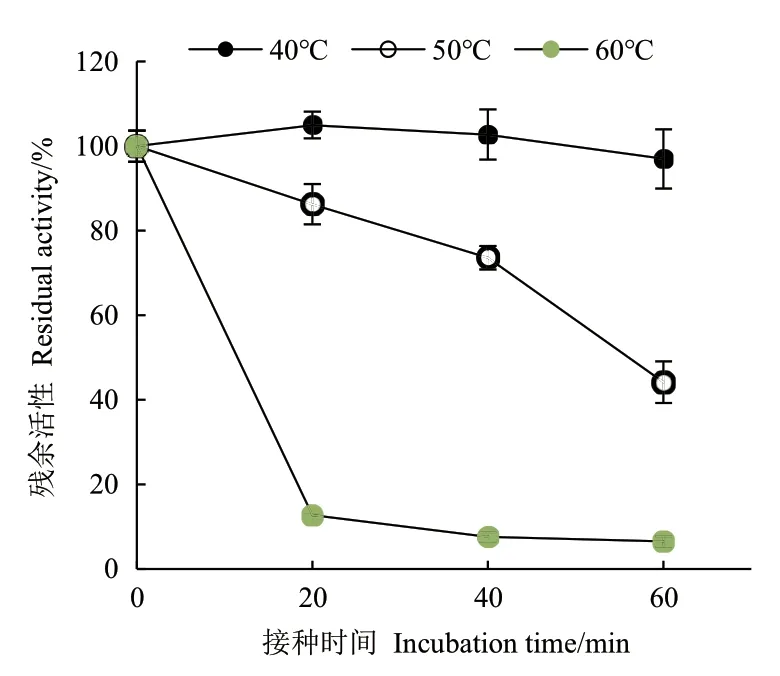
图8 ZWW8菌株几丁质酶在不同温度热处理后的残余活性Fig.8 Effect of temperature on residual activity of chitinase by strain ZWW8
2.3.6 NaCl浓度对ZWW8菌株几丁质酶热稳定的影响 将1%-20% NaCl ZWW8菌株几丁质酶液于55℃保温30 min,检测其残余活性。如图9所示,随着NaCl浓度提高,几丁质酶热稳定性明显增强。NaCl浓度为20%时,几丁质酶在55℃保温30 min后还能维持近70%的活性。
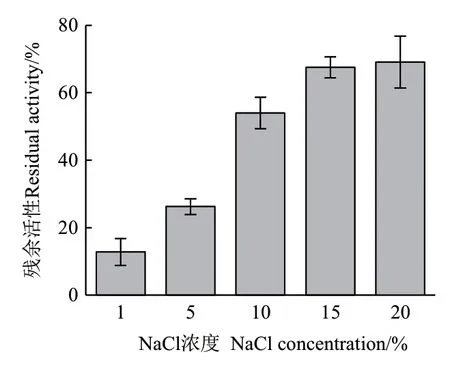
图9 几丁质酶在不同NaCl浓度热处理后的残余活性Fig.9 Effect of NaCl concentration on residual activity of chitinase
2.3.7 NaCl浓度对ZWW8菌株几丁质酶的几丁质结合能力的影响 检测ZWW8菌株几丁质酶在1%-20% NaCl条件下对几丁质的结合能力,图10表明随着NaCl浓度增加,几丁质酶与胶体几丁质的结合率明显提高。
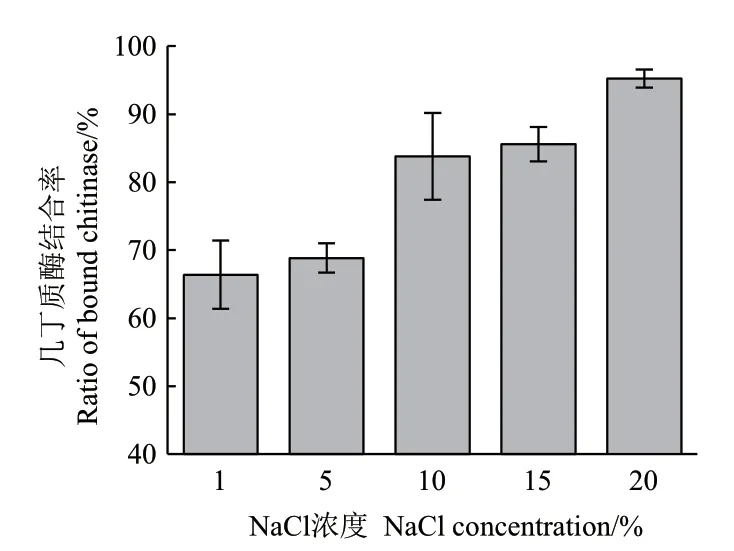
图10 NaCl浓度对ZWW8菌株几丁质酶的几丁质结合能力的影响Fig.10 Effect of NaCl concentration on chitin binding ability of chitinase by strain ZWW8
2.3.8 ZWW8菌株几丁质酶的纯化及SDS-PAGE检测 为了对ZWW8菌株的几丁质酶进行初步纯化,我们利用其几丁质酶能特异性结合几丁质这一特点,通过几丁质亲和层析柱对含有15% NaCl的粗酶液进行分离纯化。如图11所示,ZWW8菌株的粗酶液有5条主带可与几丁质特异性结合。对各组分进行几丁质酶活性检测结果表明,上样流出液和洗涤液均无活性,仅有洗脱液透析复性后具有几丁质酶活性。
3 讨论
我国虾蟹等水产品资源十分丰富,产生了巨大的经济价值,但也因此产生大量的废弃物,造成了环境的污染和资源的巨大浪费。几丁质作为虾壳蟹壳的主要成分,可通过物理、化学处理和酶降解成几丁寡糖,具有抗微生物、抗肿瘤、抗氧化、免疫调节、促进伤口愈合和组织再生、控制血压和降低胆固醇等各项生物活性[16],可作为杀虫杀菌剂、免疫增强剂、药物载体和食品添加剂等进行大规模应用[17]。研究表明,利用几丁质酶水解可得到所需长度和脱乙酰度的几丁寡糖,而且反应条件温和、专一性高、对环境污染小,是获得几丁寡糖最环保且低能耗的方法[18]。然而工业生产时常会涉及例如高温、强酸性、强碱性和低水活度环境等不利条件,目前所使用的酶在高盐、低温和有机溶剂等低水活度环境中容易聚集沉淀并丧失活性及稳定性,因此开发适用于大规模工业生产,耐受各种不利条件,在低水活度环境中具有活性和稳定性的几丁质酶,具有重大经济价值与理论价值[19-20]。
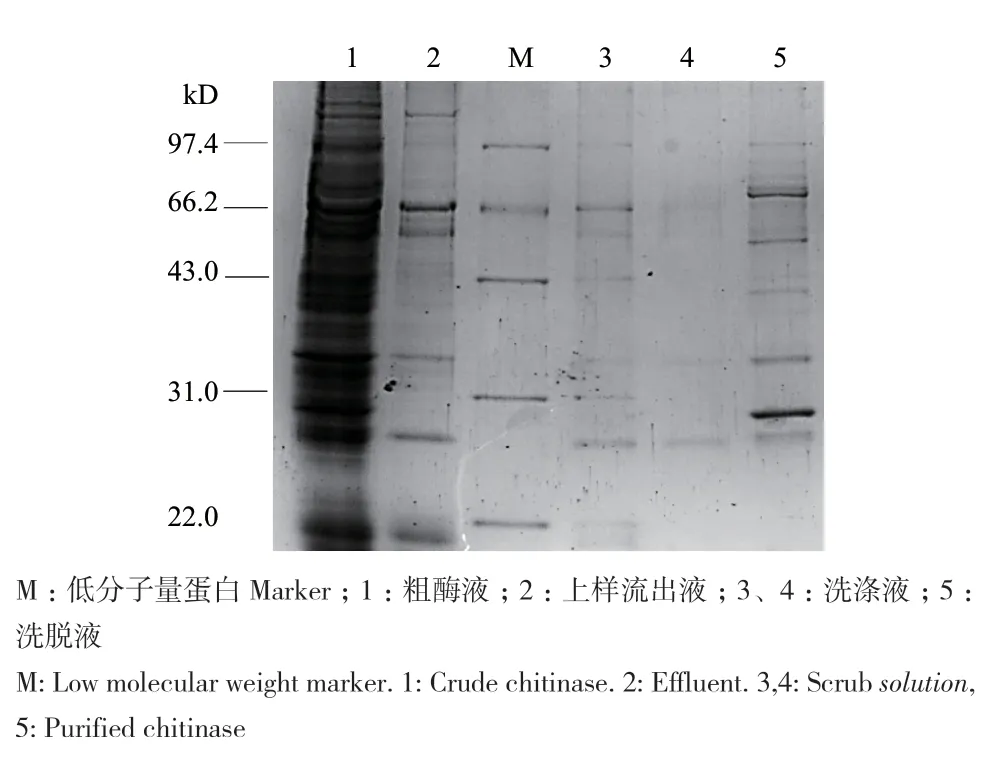
图11 几丁质亲和层析纯化ZWW8菌株几丁质酶的SDSPAGE检测图Fig.11 SDS-PAGE analysis of strain ZWW8 chitinase purified by chitin affinity chromatography
本课题组从湖北省武汉地区的土壤中筛选得到一株能产生耐盐几丁质酶的细菌ZWW8,经鉴定其属于无色杆菌属,目前国内外关于无色杆菌属发酵产几丁质酶的研究非常少,在无色杆菌属所在的产碱杆菌科(Alcaligenaceae),也仅发现氧化木糖产碱杆菌(Alcaligenes xylosoxydans)可产生几丁质酶[21-23],而该菌种现在也已经被鉴定为氧化木糖无色杆菌(Achromobacter xylosoxidans)。我们通过单因素试验优化了ZWW8菌株在液体培养基中发酵产胞外几丁质酶的的培养条件。不同碳源对该菌株分泌胞外几丁质酶的影响较大,以胶体几丁质为碳源时,发酵产几丁质酶量最高,粉末几丁质次之。这可能是因为胶体几丁质表面积较大,容易被ZWW8菌株本底表达的少量几丁质酶降解产生可溶的几丁寡糖,进一步诱导该菌株大量表达几丁质酶。当以胶体壳聚糖、葡萄糖、水溶性壳聚糖和N-乙酰氨基葡萄糖为碳源时,ZWW8菌株均不产生几丁质酶,这与付星所报道的巴伦葛兹类芽孢杆菌(Paenibacillus barengoltzii CAU904)较相似[24]。说明大部分细菌的几丁质酶主要为诱导酶,几丁质及其降解产物能诱导细菌几丁质酶的表达。氮源对ZWW8菌株产生几丁质酶也有明显影响,铵盐和蛋白胨作为氮源时几丁质酶的表达量较高,尿素和硝酸盐作为氮源时几丁质酶的表达量较低。这与疣孢漆斑菌(Myrothecium verrucaria)较相似[25],1.4 g/L 硫酸铵和 0.1 g/L-0.5 g/L尿素能使该菌株几丁质酶产量提高4倍。此外,可能因为缺乏其生长所需维生素等的生长因子,ZWW8菌株在合成培养基中生长非常缓慢。因此,在对ZWW8菌株产酶条件优化过程中,各发酵培养基中均额外添加了3 g/L的酵母粉以提供生长因子,也补充了有机氮源。Vaidya[21]也发现添加少量酵母粉或蛋白胨等有机氮源能显著提高A. xylosoxydans几丁质酶的产量。
pH对产酶的影响实验表明,无色杆菌ZWW8在比较广的pH范围(5-9)均能产生几丁质酶,在pH 7时产酶量最高,当pH>7时产酶量明显下降。大多数细菌产几丁质酶的最适pH 在中性或者略偏酸性。之前报道的液化无色杆菌A. liquefaciens在pH 6.5时几丁质酶产量最高[11]。发酵温度对胞外几丁质酶产量也有重要影响,大部分细菌的最适产酶温度在30-37℃,如唐德链霉菌(Streptomyces tendae)在37℃时几丁质酶产量最高[26]。ZWW8菌株在28℃几乎不分泌胞外几丁质酶。随着培养温度升高,几丁质酶产量逐渐增加,37℃时达到最高,这与A.liquefaciens发酵产生几丁质酶的最适温度40℃结果比较相似[11]。当温度进一步上升则胞外几丁质酶产量开始下降,这可能是由于高温条件下几丁质酶表达量和稳定性均有所下降。通过检测发酵时间对产酶量的影响,发现ZWW8菌株培养1 d后就开始大量分泌几丁质酶,在第2天达到峰值,随后产酶量开始明显下降。这与在第3天几丁质酶产量最高的A.xylosoxydans相比[21],无色杆菌ZWW8的产酶周期较短,更有利于降低生产成本。ZWW8菌株在优化后的发酵培养基中37℃发酵2 d,胞外上清的酶活力可达到33.9 U/L,比优化前(4.2 U/L)提高了约8倍。不同研究中对于酶活力单位的定义有所差别,如果将酶活力单位(U)统一为每分钟产生1 μmol的N-乙酰氨基葡萄糖所需的酶量,A. xylosoxydans经过产酶条件优化后,几丁质酶产量可达到483 U/L[22]。因此Achromobacter sp. ZWW8的产酶量处于较低水平,发酵条件还有待进一步优化。
通过对ZWW8菌株几丁质酶的酶学性质进行研究,我们发现温度对几丁质酶活性有显著影响,无色杆菌ZWW8几丁质酶在较广的温度范围(10-65℃)具有水解活性,最适反应温度为50℃。A. denitrificans几丁质酶的最佳反应温度为35℃[13],与之相比,无色杆菌ZWW8几丁质酶不仅低温活性较强,还具有良好的耐热性。pH也对几丁质酶活性有较大影响,ZWW8菌株几丁质酶在pH 5-7范围内均有较高的活性,最适反应pH为 5.5,为酸性几丁质酶,而A. denitrificans几丁质酶的最佳反应pH为7.0[13]。在金属离子对ZWW8几丁质酶活性的影响中,Ca2+和Ni2+对酶活有一定促进作用,Hg2+能完全抑制酶活。之前报道的A. denitrificans几丁质酶的活性也会被Ca2+激活,而被Hg2+抑制[13]。此外,值得注意的是ZWW8菌株几丁质酶在高盐条件下具有活性和稳定性,这对几丁质酶在低水活度条件下的应用具有重要价值。ZWW8菌株几丁质酶的活性随着NaCl浓度上升而逐渐下降。最适反应盐浓度为1%,但当NaCl浓度为25%时,仍然能保持最大活性的64%。同时,NaCl浓度还能明显增强热稳定性,ZWW8菌株几丁质酶在20%NaCl条件下55℃保温30 min后还能维持近70%的活性。与只有在1 mmol/L NaCl以下才有活性的A. denitrificans几丁质酶相比[13],ZWW8菌株的几丁质酶有很好的耐盐性,能在高盐条件下维持其活性和稳定性。高盐浓度还能促进ZWW8菌株几丁质酶对几丁质的特异性结合,这说明其几丁质酶可能含有几丁质结合区,有研究表明高盐浓度通过增强几丁质结合区中芳香族氨基酸残基与几丁质的疏水相互作用来提高结合能力[27]。通过几丁质亲和层析柱在高盐条件下对ZWW8菌株的几丁质酶进行了初步纯化,SDS-PAGE检测结果表明该菌株能分泌多种可特异性结合几丁质的蛋白质,并具有几丁质酶活性。许多微生物能同时分泌内切几丁质酶、外切几丁质酶和N-乙酰葡萄糖胺糖苷酶等多种几丁质水解酶。例如,海洋细菌(Pseudoalteromonas piscicida strain O-7)可产生5个几丁质酶和3个β-N-乙酰葡萄糖胺糖苷酶,它们协同作用降解含几丁质生物质,为微生物代谢提供营养[28]。
本研究中Achromobacter sp. ZWW8所分泌的几丁质酶具有耐热和耐盐等的优良特征,并与已报道的A. denitrificans和A. xylosoxydans的几丁质酶有明显差异。在后续研究中,我们将对ZWW8菌株进行全基因组测序,结合生物信息学分析该菌株几丁质酶基因的表达调控机制,采用代谢调控手段进一步提高几丁质酶表达量。此外,还将对ZWW8菌株的胞外几丁质酶进行蛋白质谱检测,通过与全基因组序列比对获得各几丁质酶基因,构建重组质粒并对它们进行异源表达和纯化,对它们的酶学性质及耐热耐盐的分子机制进行进一步研究,为开发在低水活度条件下具有良好活性和稳定性的生物催化剂提供新的理论依据和设计思路,对于几丁质资源的开发利用具有重要的理论意义和应用价值。
4 结论
本研究以湖北武汉地区土壤中筛选得到的能降解几丁质胶体的菌株ZWW8为研究对象,通过16S rDNA序列测定及构建系统发育树,初步鉴定该菌株为无色杆菌属。通过检测碳源、氮源、温度、培养基pH和培养时间对几丁质酶产量的影响对发酵条件进行优化,Achromobacter sp. ZWW8在添加0.5%几丁质胶体,0.5% NH4Cl,初始pH 7.0的培养基中,于37℃培养2 d后胞外上清酶活力可达到33.9 U/L,是优化前酶活力的8倍。ZWW8菌株分泌胞外几丁质酶最适反应pH为5,最适反应温度为50℃。Ca2+能提高几丁质酶活性,Hg2+、Cu2+和Zn2+等金属离子能明显抑制酶活。ZWW8菌株的胞外几丁质酶不仅在高盐条件维持活性和稳定性,还能特异性结合几丁质,并通过几丁质亲和层析对胞外几丁质酶进行了初步纯化。
