补骨脂单体成分对体外培养成骨细胞和破骨细胞分化的影响*
2015-08-26柴丽娟王少峡毛浩萍天津中医药大学天津市现代中药重点实验室天津30093天津中医药大学天津市中药药理学重点实验室天津30093
柴丽娟,樊 娜,王 虹,,张 晗,王少峡,,苗 琳,毛浩萍,周 昆(.天津中医药大学,天津市现代中药重点实验室,天津30093;.天津中医药大学,天津市中药药理学重点实验室,天津30093)
·中药研究·
补骨脂单体成分对体外培养成骨细胞和破骨细胞分化的影响*
柴丽娟1,樊娜1,王虹1,2,张晗1,王少峡1,2,苗琳1,毛浩萍2,周昆2
(1.天津中医药大学,天津市现代中药重点实验室,天津300193;2.天津中医药大学,天津市中药药理学重点实验室,天津300193)
[目的]研究补骨脂单体成分异补骨脂素、异补骨脂查尔酮对体外培养破骨细胞抗酒石酸酸性磷酸酶(TRACP)及成熟破骨细胞形成数目、体外培养成骨细胞增殖与分化的影响。[方法]体外采用巨噬细胞集落刺激因子(M-CSF)和核因子κB受体活化因子配体(RANKL)诱导培养破骨细胞前体细胞,考察异补骨脂素、异补骨脂素查尔酮对破骨细胞前体细胞在分化过程中其标志性酶TRACP的活性和成熟破骨细胞产生数目的影响。对硝基苯磷酸盐法(PNPP法)测定破骨细胞TRACP活性,TRACP细胞染色法鉴定并检测成数破骨细胞数目。酶消化法体外培养新生小鼠成骨细胞,(CCK-8)(cell counting kit-8)法检测两成分对成骨细胞增殖的影响,磷酸苯二钠法测定两成分对成骨细胞标志性酶碱性磷酸酶(ALP)的影响。[结果]体外成功培养小鼠破骨细胞和成骨细胞,两细胞强表达各自的标志性酶TRACP和ALP。异补骨脂查尔酮在0.05 μmol/L浓度下对成熟破骨细胞的形成有显著抑制作用。异补骨脂素在0.1 μmol/L浓度下对成骨细胞增殖有显著促进作用。[结论]补骨脂单体成分异补骨脂素对成骨细胞有促进作用、异补骨脂查尔酮对破骨细胞有抑制作用,提示补骨脂可能作为抗骨质疏松或骨吸收的药物。
异补骨脂素;异补骨脂查尔酮;成骨细胞;破骨细胞;增殖;分化
骨质疏松症发病率已跃居常见病、多发病的第7位[1],如何预防和治疗骨质疏松症日益受到普遍重视。无论是I型还是II型骨质疏松症,都与雌激素缺乏有直接或间接关系[2-4],临床上应用雌激素治疗骨质疏松症有效但存在引起癌症的风险,利用植物雌激素防治骨质疏松症成为目前关注的焦点。
补骨脂为豆科植物补骨脂(PsoraleacorylifoliaL.)的干燥果实,具有温肾助阳、纳气止泻的功效,临床治疗骨质疏松症有效[5-7],其有效成分具有雌激素样活性[8],课题组前期研究也证实,补骨脂的活性成分具有与雌激素受体[9]、雄激素受体[10]的结合能力。补骨脂含有多种活性成分,体外单体成分的研究是其药理研究的基础,本研究主要探讨补骨脂单体成分异补骨脂素、异补骨脂查尔酮对体外培养破骨细胞、成骨细胞的增殖与分化作用,为补骨脂的临床使用及新药研发提供依据。
1 材料与方法
1.1材料4~6周龄雌性昆明小鼠、乳鼠购自中国人民解放军军事医学科学院卫生学环境医学研究所实验动物中心[动物合格许可证:SCXK(军)2009-003],改良型α-MEM培养基(Hyclone),FBS(Invitrogen),巨噬细胞集落刺激因子(M-CSF)、核因子κβ受体活化因子配体(RANKL)(R&D),低糖型DMEM、Ⅱ型胶原酶、Acid Phosphatase Leukocyte(TRAP)Kit(Sigma),CCK-8(日本同仁化工),补骨脂素(中国食品药品检定研究所),补骨脂酚(MUST)。其它试剂均为市售分析纯产品。多功能读板机(Felex station 3,MD,美国);超声破碎仪(VCX 130,Sonics,USA),倒置荧光显微镜(TE300,Nikon,日本),CO2培养箱(Thermo,美国),酶标仪(PE,美国)。
1.2体外破骨细胞前体细胞诱导培养脱臼处死4~6周雌性昆明小鼠,75%乙醇消毒后取四肢长骨,去除骨表面软组织和骨骺,置入保持低温的α-MEM全培基(15%FBS,1%双抗)中。用1 mL注射器吸取全培基,反复冲洗骨髓腔和骨内表面,直至骨壁变白为止。骨髓悬液用200目细胞筛过滤,将过滤后的细胞悬液均匀接种至75 cm2培养瓶中,37℃,5%CO2培养箱培养24 h。24 h后将未贴壁的细胞和全培基倒入50 mL离心管中离心,弃去上清液,加入一定量全培基,混匀细胞后计数,调节细胞浓度至5×106个/mL。将细胞悬液接种到相应培养板,培养48 h后,吸去全培基去除未贴壁细胞,加入DHanks轻轻洗涤细胞两次,加入含或不含药物的含有刺激因子全培基。刺激因子浓度为M-CSF,10 ng/mL和RANKL,30 ng/mL。
1.3小鼠成骨细胞体外培养取出生2~3 d的昆明小鼠15只,75%乙醇浸泡消毒,无菌条件下取颅盖骨,去除骨膜和软组织,0.25%的胰酶37℃气浴消化15 min;取出骨片,将颅骨片剪成约1 mm×1 mm大小的骨片;加入0.1%Ⅱ型胶原酶37℃气浴摇床中振荡消化90 min;吸取上清液,丢弃骨片;放入另一个50 mL离心管中离心收集细胞,加入完全培养基(低糖型DMEM,FBS 15%,双抗1%)重悬细胞,将细胞悬液移入75 cm2培养瓶中。显微镜下可以看到许多圆形的细胞。37℃、5%CO2饱和湿度的培养箱中,每3天换液1次,待细胞长满瓶底后传代备用。改良Gomori法鉴定成骨细胞。
1.4异补骨脂素、异补骨脂查尔酮对破骨细胞TRACP表达的影响将原代取材破骨细胞前体细胞经过48 h贴壁洗涤后,加入含或不含RANKL和M-CSF的α-MEM全培基进行刺激。刺激同时加入异补骨脂素或异补骨脂查尔酮进行药效研究,培养7 d后对硝基苯磷酸盐法(PNPP)法检测破骨细胞抗抗酒石酸酸性磷酸酶(TRACP)活性。细胞加药分组如下:1)对照组:正常培养基;2)模型组:含M-CSF 10 ng/mL,RANKL 30 ng/mL的全培基(M10R30);3)异补骨脂素高中低剂量组:在模型组基础上含有0.05、0.1、0.5 μmol/L的异补骨脂素;4)异补骨脂查尔酮高中低剂量组:在模型组基础上含有0.05、0.1、0.5μmol/L的异补骨脂查尔酮。
PNPP法检测小鼠破骨细胞TRACP酶活性:吸除需检测96孔板细胞培养上清液,加入D-Hanks液清洗细胞2次,加入0.1%Triton X-100裂解10 min,加入PNPP反应液(PNPP 2 g/L,L-酒石酸钠7.6 g/L)100 μL在37℃下孵育30 min,加入100 μL 1 mol/L的NaOH终止。405 nm多功能读板机上读值。
1.5补骨脂素、补骨脂酚对TRACP阳性多核成熟破骨细胞形成数目的影响将原代取材破骨细胞前体细胞经过48 h贴壁洗涤后,加入含或不含RANKL和M-CSF的α-MEM全培基进行刺激。刺激同时加入异补骨脂素或异补骨脂查尔酮进行药效研究,培养14 d后进行破骨细胞染色计数。倒置显微镜下随机选取5个视野计数TRACP阳性并且核≥3个的视为成熟破骨细胞。分组同上。破骨细胞染色根据Acid Phosphatase Leukocyte(TRAP)Kit试剂盒说明书进行。
1.6补骨脂素、补骨脂酚对体外培养小鼠成骨细胞增殖的影响待细胞长满瓶底后传代,种入96孔板中,2×104个/mL种入,待细胞生长至50%融合时,加入含异补骨脂素或异补骨脂查尔酮的全培基(含2% FBS),培养7 d后,CCK-8法检测细胞增殖情况。细胞加药分组如下:1)对照组:正常培养基;2)异补骨脂素高中低剂量组:0.05、0.1、0.5 μmol/L;3)异补骨脂查尔酮高中低剂量组:0.05、0.1、0.5 μmol/L。
1.7补骨脂素、补骨脂酚对体外培养小鼠成骨细胞ALP表达的影响细胞长满瓶底后传代,种入96孔板中,待细胞生长至70%融合时,加入含异补骨脂素或异补骨脂查尔酮的全培基(含2%FBS),培养7 d后,磷酸苯二钠比色法测定成骨细胞ALP的表达情况。细胞加药分组同上。
成骨细胞ALP测定:磷酸苯二钠法测定成骨细胞ALP酶的表达情况,510 nm读取吸光度。
1.8统计学处理使用SPSS 18.0统计软件进行分析,计量资料均以均数±标准差(±s)表示。正态分布计量资料的组间比较采用单因素方差分析(one-way ANOVA),组间两两比较时,若方差齐采用LSD法,若方差不齐采用Dunnett’s T3检验,偏态分布计量资料的组间比较采用秩和检验。P<0.05为差异具有统计学意义。
2 结果
2.1破骨细胞、成骨细胞培养鉴定显微镜下观察诱导培养7 d的破骨细胞,细胞边缘不规则,有突起和伪足,胞浆可见大小不等的空泡,呈现吞噬样细胞形态,体积大,直径约100 μm,含有2~50个紧密堆积的核。TRACP高表达是破骨细胞主要标志性酶,研究所培养破骨细胞经TRACP染色后,可见大量多核细胞,胞浆呈现出均匀分布的紫红色或棕红色颗粒,部分胞浆内可见大小不一的空泡,说明本研究培养的破骨细胞TRACP表达强,具有破骨细胞的主要生物学特征。见如图1。
原代培养成骨细胞呈圆球状,透明,分散存在,大小均一。培养24 h后,细胞已完全贴壁展开。展开后的细胞形态多不规则,呈三角形、多角形,有较多突起,胞浆丰富、清晰。生长期细胞分裂多见,细胞多突起互相连接。汇合时细胞呈铺路石状,并可重叠生长(如图1)。在pH9.4条件下,成骨细胞标志酶ALP使孵育液中β-甘油磷酸钠水解产生磷酸根,经过一些列反应最后生成CoS棕黑色沉淀。研究所培养成骨细胞经胞质呈灰黑色、深黑颗粒或片状沉淀,说明原代培养成骨细胞ALP含量高,具有成骨细胞的主要生物学特征。
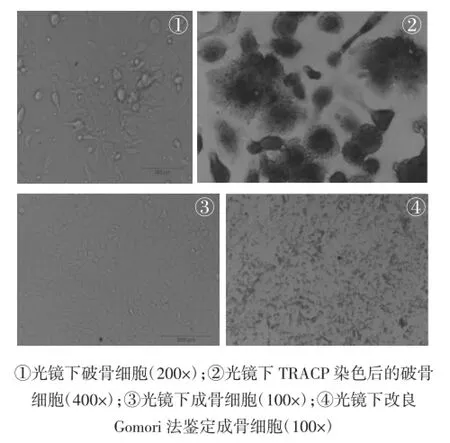
图1 小鼠破骨细胞、成骨细胞原代培养及鉴定Fig.1 Primary culture and identification of mouse osteoclast and osteoblast
2.2异补骨脂素、异补骨脂查尔酮对破骨细胞TRACP酶活性的影响M-CSF和RANKL可以显著诱导破骨细胞TRACP酶的表达,异补骨脂素、异补骨脂查尔酮有降低其表达的趋势,但没有统计学差异。见表1。
表1 异补骨脂素、异补骨脂查尔酮对M10R30诱导下破骨细胞TRACP表达的影响(±s)Tab.1 The expression of TRACP in osteoclasts induced by M10R30 treated by isopsoralen or isobavachalcone(±s)%
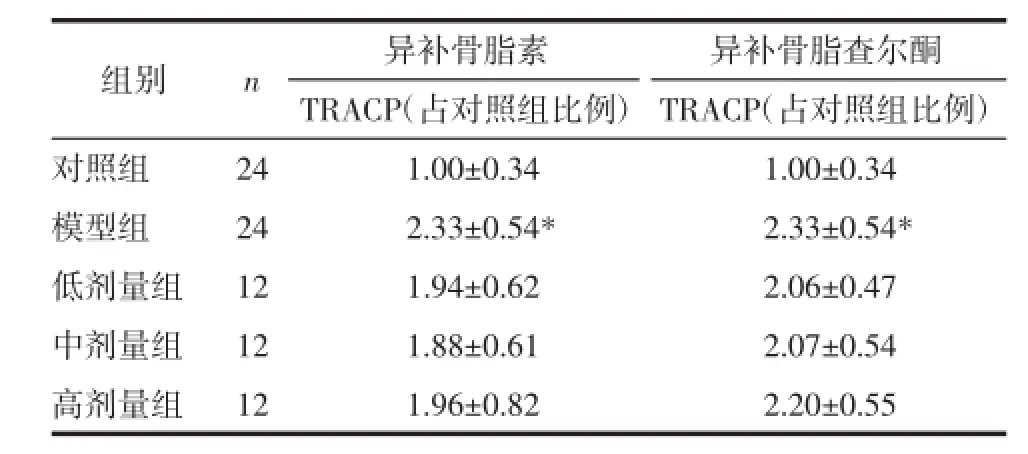
表1 异补骨脂素、异补骨脂查尔酮对M10R30诱导下破骨细胞TRACP表达的影响(±s)Tab.1 The expression of TRACP in osteoclasts induced by M10R30 treated by isopsoralen or isobavachalcone(±s)%
注:与对照组相比,*P<0.05。
组别n异补骨脂素异补骨脂查尔酮TRACP(占对照组比例)TRACP(占对照组比例)对照组241.00±0.341.00±0.34模型组242.33±0.54*2.33±0.54*低剂量组121.94±0.622.06±0.47中剂量组121.88±0.612.07±0.54高剂量组121.96±0.822.20±0.55
2.3异补骨脂素、异补骨脂查尔酮对成熟破骨细胞形成数目的影响模型组在M10R30诱导下可以提高成熟破骨细胞的形成数目,具有统计学差异(P<0.05)。异补骨脂素在不同浓度下对成熟破骨细胞形成的没有影响;异补骨脂查尔酮在0.05、0.1、0.5 μM浓度下有降低破骨细胞形成的趋势,以低亮剂量0.05μmol/L浓度下作用显著。见表2。
表2 异补骨脂素、异补骨脂查尔酮对M10R30诱导下成熟破骨细胞形成数目的影响(±s)Tab.2 The number of mature osteoclasts induced by M10R30 treated by isopsoralen or isobavachalcone(±s)个
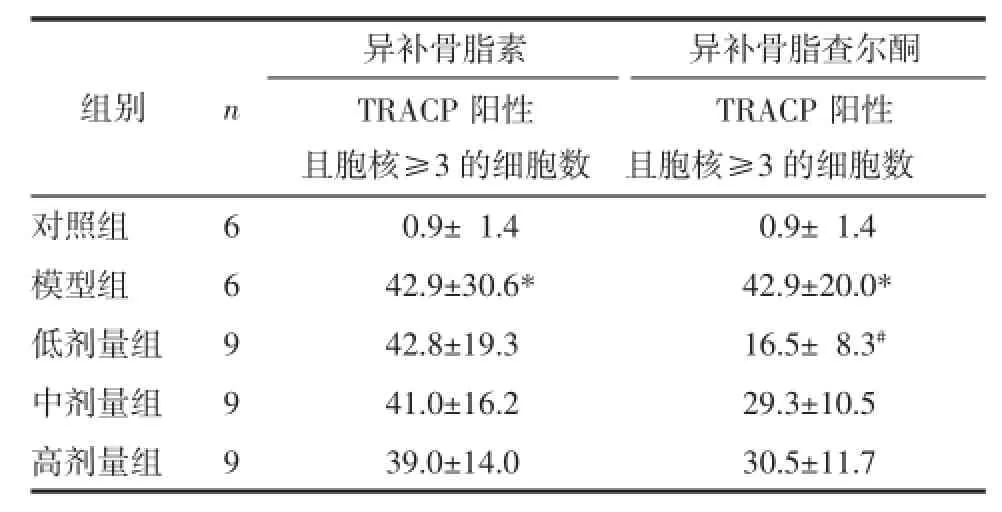
表2 异补骨脂素、异补骨脂查尔酮对M10R30诱导下成熟破骨细胞形成数目的影响(±s)Tab.2 The number of mature osteoclasts induced by M10R30 treated by isopsoralen or isobavachalcone(±s)个
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
TRACP阳性且胞核≥3的细胞数对照组600.9±01.400.9±01.4模型组642.9±30.6*42.9±20.0*低剂量组942.8±19.316.5±08.3#中剂量组941.0±16.229.3±10.5高剂量组939.0±14.030.5±11.7组别n异补骨脂素异补骨脂查尔酮TRACP阳性且胞核≥3的细胞数
2.4异补骨脂素、异补骨脂查尔酮对成骨细胞增殖、分化的影响成骨细胞增殖期,成骨细胞数目显著增加形成多层细胞,并合成、分泌Ⅰ型胶原以便最终可以矿化形成骨结节。从表3可以看出,异补骨脂素0.1 μmol/L中浓度剂量下对体外培养小鼠成骨细胞增殖有显著促进作用(P<0.05),异补骨脂查尔酮无此作用。ALP是成骨细胞合成分泌的标志性功能酶,分解有机盐、诱导钙盐沉积,促进类骨质矿化。两成分对体外培养小鼠成骨细胞ALP的表达没有影响。见表3。
表3 异补骨脂素、异补骨脂查尔酮对成骨细胞增殖与分化的影响(±s)Tab.3 The proliferation and differentiation in mouse osteoblast treated by isopsoralen or isobavachalcone(±s)%
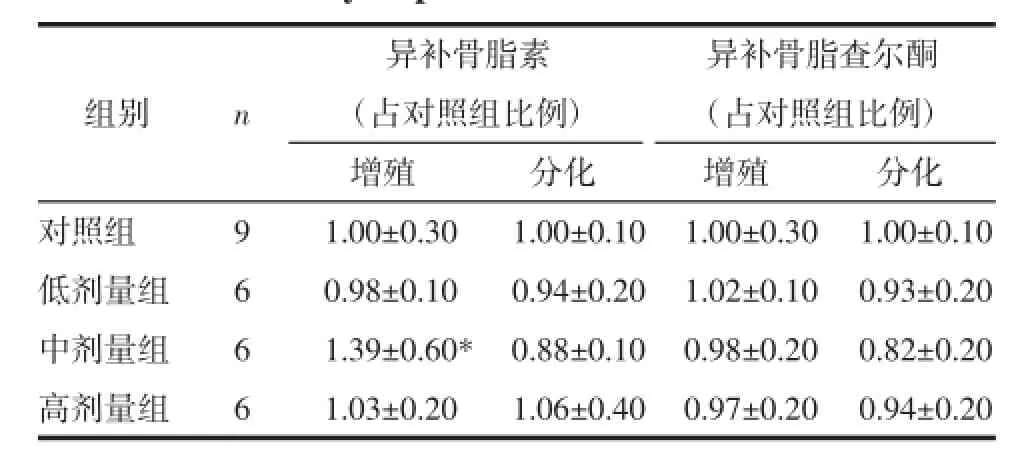
表3 异补骨脂素、异补骨脂查尔酮对成骨细胞增殖与分化的影响(±s)Tab.3 The proliferation and differentiation in mouse osteoblast treated by isopsoralen or isobavachalcone(±s)%
注:与对照组相比,*P<0.05。
异补骨脂素异补骨脂查尔酮(占对照组比例)(占对照组比例)增殖分化增殖分化对照组91.00±0.301.00±0.101.00±0.301.00±0.10低剂量组60.98±0.100.94±0.201.02±0.100.93±0.20中剂量组61.39±0.60*0.88±0.100.98±0.200.82±0.20高剂量组61.03±0.201.06±0.400.97±0.200.94±0.20组别n
3 讨论
破骨细胞是骨质疏松过程中行使骨吸收的主要功能细胞,但其培养及纯化难度较大,且为终末分化细胞,不能传代,因此破骨细胞大量培养仍难以实现。其主要来源于单核-巨噬细胞系前体细胞,破骨细胞前体细胞在骨营养激素和骨微环境因子调节下,由多个单核细胞融合变成多核巨细胞,含有2~50个紧密堆积的核,直径约100 μm左右。体外破骨细胞培养方法较多,如机械分离法、骨髓诱导培养法、脾干细胞诱导法、RAW264.7细胞诱导法、外周血单核细胞诱导法等。研究选用骨髓诱导培养法可使单核细胞定向分化为破骨细胞,获得较多的破骨细胞,是实验室较为理想的体外破骨细胞培养方法。
现普遍接受的观点是:破骨细胞,巨噬细胞,单核细胞共同来源于同一造血干细胞。巨噬细胞集落刺激因子(M-CSF)促进造血干细胞分化为单核巨噬细胞克隆形成单位(CFU-M),并维持其增殖和分化能力。这些单核前体细胞移位至骨吸收区域,在M-CSF持续作用下分化为破骨细胞前体,随后在M-CSF和RANKL等因子协同作用下,融合为多核破骨细胞,此时细胞开始呈现TRACP阳性,直至破骨细胞成熟,只有成熟的破骨细胞才具有骨吸收能力。M-CSF和RANKL是破骨细胞分化与活化所必须的两种因子。多核破骨细胞经RANKL和其它因子刺激活化,发挥骨吸收功能。TRACP及骨吸收活性等指标常被用来辨别破骨细胞分化过程中所处阶段。成熟破骨细胞内含有大量TRACP酶,破骨细胞行使骨吸收时,TRACP由破骨细胞内溶酶体样结构中分泌至骨吸收表面,将骨桥蛋白以及骨连素等非胶原骨基质蛋白去磷酸化,从而有利于破骨细胞与骨吸收处表面的黏接,它是破骨细胞的一种标志酶。
研究认为成熟的破骨细胞具有3个核以上,并且TRACP强表达。破骨细胞TRACP活性检测表明,异补骨脂素、异补骨脂查尔酮对分化过程中破骨细胞标志酶TRACP酶没有影响,但异补骨脂查尔酮在不同浓度下有降低成熟破骨细胞形成数目的趋势,尤其在0.05 μmol/L浓度下可以显著降低破骨细胞的形成。这与Park CK等[11]的研究相吻合之处,他们也报道补骨脂查尔酮(Bavachalcone)通过对ERK、Akt、c-Fos和NFATc1干预抑制破骨细胞形成,认为补骨脂查尔酮可以作为治疗关于骨吸收疾病的药物。
成骨细胞的来源主要有骨(新生动物或胚胎动物颅骨)、骨膜和骨髓间充质干细胞,成骨细胞骨形成过程中经过增殖、分化、矿化和凋亡4个阶段,一般认为,ALP是成骨细胞分化的代表性酶,在体外钙化中起关键性作用。本研究培养的成骨细胞ALP染色呈阳性,证明研究采用的成骨细胞具有强的分泌ALP的能力,符合成骨细胞的生物学特征。
关于补骨脂对体外成骨细胞作用研究的较多,如补骨脂水提液、醇提液、补骨脂有效成分对成骨细胞的增殖、分化、成骨细胞骨生成的相关指标如胶原酶的合成、骨保护素(OPG)分泌、骨钙素分泌,增加钙化结节等各项研究都已开展很多。如异黄酮和补骨脂二氢黄酮可以促进成骨细胞的增殖[12],补骨脂素10 μmol/L能促进成骨细胞增殖[13-14],与他们的研究相类似,本研究也发现异补骨脂素在0.1 μmol/L浓度时可以促进成骨细胞的增殖。两者对成骨细胞ALP表达没有促进作用。
中药成分复杂,中药有效单体成分的药理机制是中药药理研究的前提。本研究发现补骨脂的单体成分异补骨脂查尔酮能抑制破骨细胞的形成,异补骨脂素能促进成骨细胞的增殖。提示补骨脂的有效单体成分可能协同起效,有的成分促进成骨细胞功能,有的成分抑制破骨细胞功能,纠正骨质疏松过程中破骨细胞与成骨细胞之间的失衡,说明补骨脂具有进一步研发成抗骨质疏松或骨吸收新药的前景。
[1]王洪复.骨质疏松症药效研究方法与技术[M].北京:人民卫生出版社,2009:9-220
[2]Riggs BL,Khosla S,Melton LJ.A unitary model for involutional osteoporosis:estrogen deficiency causes both type I and type II osteoporosis in postmenopausal women and contributes to bone loss in aging men[J].Journal of Bone and Mineral Research,1998,13(5): 763-773.
[3]Khosla S.Update in Male Osteoporosis[J].The Journal of clinical endocrinology and metabolism,2010,95(1):3-10.
[4]LeBlanc Et,Nielson CM,Marshall LM,et al.The effects of serum testosterone,estradiol,and sex hormone binding globulin levels on fracture risk in older men[J].J Clin Endocrinol Metab,2009,94(9): 3337-3346.
[5]赵丕文,王大伟,牛建昭.红花等10种中药的植物雌激素的活性研究[J].中国中药杂志,2007,32(5):436-439.
[6]毕月玲,李晶,李平.单味中药治疗骨质疏松的研究进展[J].天津中医药,2009,26(6):524-526.
[7]王峥.补肾填精法治疗骨质疏松症[J].天津中医学院学报,1998,17(1):10.
[8]黄剑,赵陆华,邹巧根.补骨脂化学成分及药理研究进展[J].药学进展,2000,24(4):212-214.
[9]XinD,Wang H,Yang J,et al.Phytoestrogens from psoralea corylifolia revealestrogenreceptor-subtypeselectivity[J].Phytomedicine,2010,17(2):126-131.
[10]苗琳,马尚伟,樊官伟,等.补骨脂酚拮抗AR转录活性抑制雄激素诱导的前列腺癌细胞LNCaP的增殖[J].天津中医药,2013,30(5):291-293.
[11]Park CK,Lee Y,Chang EJ,et al.Bavachalcone inhibits osteoclast differentiation through suppression of NFATc1 induction by RANKL[J].Biochem Pharmacol,2008,75(11):2175-2182.
[12]Wang D,Li F,Jiang Z.Osteoblastic proliferation stimulating activity of Psoralen corylifolia extracts and two of its flavonoids[J].Planta Medica,2001,67(8):748-749.
[13]安亚兰,王建舫,许水明,等.补骨脂水提液及补骨脂素对体外培养成骨细胞的影响[J].畜牧兽医学报,2009,40(2):266-271.
[14]王建华,王艳,潘永梅.补骨脂素对大鼠成骨细胞增殖与分化的影响[J].天然产物研究与开发,2007,19(5):844-846.
(本文编辑:高杉,张震之)
The effects of psoralen components on mice osteoblast and osteoclast differention in vitro
CHAI Li-juan1,FAN Na1,WANG Hong1,2,ZHANG Han1,WANG Shao-xia1,2,MIAO Lin1,MAO Hao-ping2,ZHOU Kun2
(1.Tianjin Key Laboratory of Modern Chinese Medicine,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.Tianjin Key Laboratory of Chinese Medical Pharmacology,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
[Objective]To study the effects of psoralen components,isopsoralen and isobavachalcone on the cultured osteoclasts TRACP enzyme activity and differention.Moreover,the effect of two components on the mice osteoblasts proliferation and differentiation were also studied.[Methods]Using M-CSF and RANKL,osteoclast precursor cells were induced to differentiated into mature osteoclasts.During the differention period,isopsoralen and isobavachalcone were added to cells,therefore PNPP were used to detected osteoclasts TRACP activity.ICC staining of TRACP were performed to identify mature osteoclasts number.The neonatal mice osetoblast cells were cultured in vitro,CCK-8 methods were adopted to detected the osteoblast proliferation properties.Sodium phenylphosphate were used to measure the osteoblast marker enzyme ALP activity.[Results]Mouse osteoclasts and osteoblasts were cultured successfully in vitro.Isobavachalcone significantly inhibit the mature osteoclast formation at the dose of 0.05 μM,and isopsoralen had a significant role in promoting osteoblast proliferation at the dose of 0.1 μM.[Conclusion]Psoralea components isopsoralen and isobavachalcone have effects on bone cells,suggesting that Fructus Psoraleae maybe act as a drug for anti-osteoporosis or anti-bone resorption.
isopsoralen;isobavachalcone;osteoclasts;osteoblast;proliferation;differention
R285.5
A
1672-1519(2015)05-0299-05
10.11656/j.issn.1672-1519.2015.05.12
国家自然科学青年基金项目(81102860,81202991)。
柴丽娟(1976-),女,博士研究生,助理研究员,主要从事中药雌激素样活性防治骨质疏松研究。
(2014-11-29)
