1株分离于铀矿的可利用玉米秸秆高效产氢的芽孢杆菌*
2015-05-12张晓何晓锐庞园涛朱艳杰黄建新
张晓,何晓锐,庞园涛,朱艳杰,黄建新
(西北大学生命科学学院,陕西西安,710069)
氢能是一种可再生的洁净能源,具有重量轻、无污染、热值高等特性,成为21世纪的理想能源[1-3]。目前制氢的方法有物理化学法和生物法。物理化学制氢方法是以矿物资源为原料,需要消耗大量的能源,制氢成本较高;生物制氢是利用可再生能源通过生物的转化制取氢气,这一过程既缓解了能源危机,又消除了环境污染,是一种理想的产能方式[4]。其中,厌氧发酵微生物制氢因其产氢效率高,对环境的适应性强,反应器设计简单,能够利用有机废水、固体废物进行发酵产氢等特点越来越受到青睐[5]。已报道的厌氧发酵产氢细菌包括梭菌(Clostridium)[6]、肠杆菌(Enterobacter)[7]、芽孢杆菌(Bacillus)[8]、埃希氏菌(Escherichia)[9]等几大类,虽然有关梭菌类和肠杆菌类菌株的发酵制氢研究报道较多,但高效产氢菌种的获得、降低制氢成本以及工业化生产仍是生物制氢技术中的难点。此外现有的生物制氢技术利用的基质主要集中在一些简单碳水化合物如葡萄糖、蔗糖、淀粉以及由这些简单化合物构成的废水等,对于纤维素类等难以降解物质的发酵产氢研究很少[10-15]。本文从铀矿极端环境中分离获得1株利用玉米秸秆酵解物发酵产氢的丁酸梭菌(Clostridium butyricum)w-14,该菌株具有兼性厌氧特点,可以葡萄糖(10 g/L)为发酵底物,累积产氢量达1 071.4 mL/L培养基;以玉米秸秆酵解物为发酵基质,累积产氢量可达140.24 mL/g-cs,比已有文献报道发酵秸秆的产氢效率高[16-17],该研究对开发利用可再生生物质转化生产洁净氢能源具有理论和实际应用价值。
1 材料与方法
1.1 材料
1.1.1 菌种
产氢菌:从十红滩砂岩型铀矿岩芯中富集分离获得。
秸秆降解用麸曲:本实验室用康氏木霉(K-3)、黑曲霉(Q-2)固态发酵制备、保藏(以下简称KQ-麸曲),使用前测定纤维素酶活为0.80~0.93 U/g(干曲)(酶活为单位为:1 h从底物溶液中分解产生1 mg葡萄糖的酶量)。
1.1.2 培养基
产氢菌富集培养基(g/L):蛋白胨8,牛肉膏3,酵母膏 1,NaCl 3,KH2PO41.5,MgSO4·7H2O 0.05,FeSO4·7H2O 0.05,葡萄糖10,L-半胱氨酸0.3,1 000 mL,pH 7.0,115 ℃灭菌30 min。
产氢菌的分离培养基:产氢菌富集培养基中加入琼脂1.4%,用于二重叠皿法分离菌种。
玉米秸秆产氢发酵培养基(g/L):蛋白胨5,酵母膏0.5,L-半胱氨酸0.3,玉米秸秆酵解物200 mL,无机盐营养液20 mL,蒸馏水780 mL,pH 7.0,115℃灭菌,30 min。
无机盐营养液(g/L):NH4HCO32,KH2PO41,MgSO4·7H2O 0.1,NaCl 0.01,Na2MoO4· 2H2O 0.01,CaCl2·2H2O 0.01,MnSO4·7H2O 0.015,FeCl20.002 5,起始 pH 5.0。
1.2 实验方法
1.2.1 高效产氢菌的分离筛选
铀矿岩心样在超净工作台中紫外照射20~30 min,去除四周表层约1.0~1.5 cm,取岩芯内部分于无菌研钵内磨成细粉,以5 g/100 mL的量,加入产氢菌富集培养基,无菌液体石蜡封液面,37℃深层富集培养。待培养瓶中的培养液浑浊并有大量气体产生后,用100 μL气密性进样器抽取气体于GC-SP 6890型气相色谱仪检测气体组分,选取有氢气产生的培养液,采用二重叠皿隔绝空气培养法进行产氢菌分离、纯化。分离获得的可产氢菌株,接种于产氢菌富集培养基中,连接气体收集装置(图1),于37℃水浴进行深层发酵培养,根据单位培养基产氢量来比较菌株的产氢能力,筛选产氢能力高的菌株。重复进行3次。
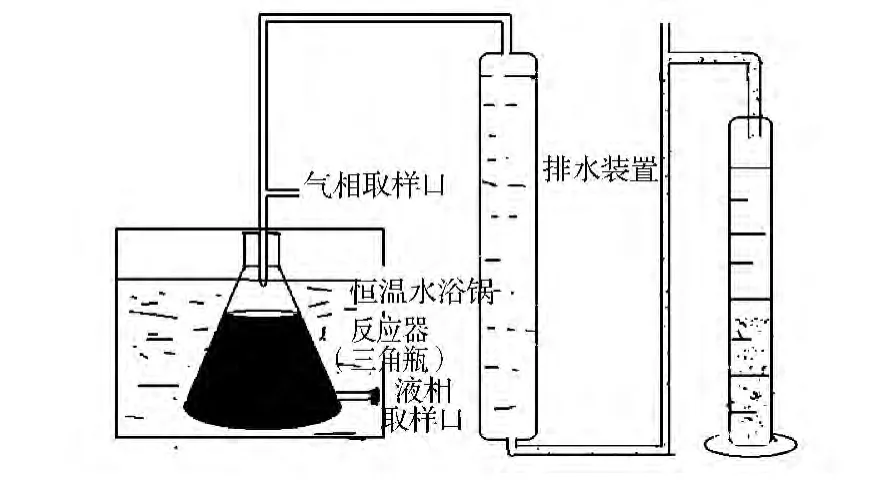
图1 气体体积分析装置示意图Fig 1 A static equipment to measure the volume of hydrogen produced
1.2.2 产氢菌株的鉴定
依据《伯杰细菌鉴定手册》(第八版)[18]、《常用细菌鉴定手册》[19]及16S rRNA基因序列分析对菌种进行鉴定;扩增菌株的16S rRNA基因序列所用的引物为:27F:5-GAGAGTTTGATCMTGGCTCAG-3'1495R:5'-CTACGGCTA CCTTGTTACGA-3'(上海sangon公司)。反应条件:95℃预变性5 min,30个循环(94℃ 1 min,55℃ 1 min,72℃ 1 min)72℃延伸 10 min,0.7%的琼脂糖凝胶电泳纯化回收PCR产物测序,测序工作委托上海Sangon公司完成;测序后将测序结果用BLAST软件与GenBank中16S rRNA基因序列进行同源性比较。从GenBank中调取不同菌株的16S rRNA基因序列用于系统发育分析,16S rRNA基因序列用MEGA 5.1构建系统发育树。
1.2.3 产氢菌生长曲线测定
采用间歇试验测定菌株的生长曲线,将培养24 h的产氢细菌按5%的接种量接种于装有800 mL液体产氢培养基的1 000 mL锥形瓶中,37℃恒温水浴下培养,定时测其累积产氢量和活菌数的变化,绘制产氢菌的生长曲线。
1.2.4 秸秆的预处理
玉米秸秆水洗烘干,用微型粉碎机粉碎过80目的筛子,过筛的玉米秸秆粉用0.75%的氨水50℃浸泡预处理16 h,水洗至中性,烘干备用。
1.2.5 玉米秸秆酵解物的制备
取预处理后秸秆粉100 g,麸皮10 g,无机盐营养液15 mL,蒸馏水 200 mL于 1 000 mL烧杯中,121℃,处理20 min,冷却至45℃,再加入不同量(5,10,15,20,25 g/L)的 KQ-麸曲,加水补足至 500 mL,搅拌混匀,在45℃,pH为5.0条件下酵解84 h,酵解后100℃煮沸10 min,加水混匀,取1 mL浸提过滤测定还原糖含量,以酵解物还原糖浓度及产氢菌株利用不同KQ-麸曲浓度下的酵解物进行发酵作用的累积产氢量来确定玉米秸秆酵解最适KQ-麸曲用量,在此基础上再确定出温度(35,40,45,50 ℃),时间(60,72,84,96 h),pH(4.0,4.5,5.0,5.5)不同酵解条件的酵解物对产氢菌株发酵产氢的影响,依据产氢细菌利用不同酵解条件的酵解物累积产氢量确定出秸秆酵解最适条件。酵解物于4℃保存备用。
1.2.6 秸秆酵解物产氢发酵
250 mL锥形瓶中加入180 mL玉米秸秆产氢发酵培养基,接种经16 h培养活化的产氢菌(w-14)种子液,接种量为10%,于37℃下,深层静置培养,定时检测产气量,分析气相产物中氢气浓度,平均产氢速率,做3个平行。
1.2.7 w-14菌株利用秸秆酵解物产氢条件的优化
采用L9(34)正交试验对w-14菌株利用玉米秸秆酵解物发酵产氢条件即温度、接种量、初始pH值和菌龄进行优化。
1.2.8 玉米秸秆酵解物发酵产氢5L放大实验
玉米秸秆产氢发酵培养基3.5 L置于5 L间歇搅拌(90 r/min)深层发酵产氢反应器(图2),初始pH为7.0,接种经16 h培养活化w-14的种子液,密封发酵罐,连接湿式气体流量计,调节反应温度为(37±1)℃,用湿氏气体流量计测量产气量,定时取样检测生物气中氢气含量,计算出累积产氢量。
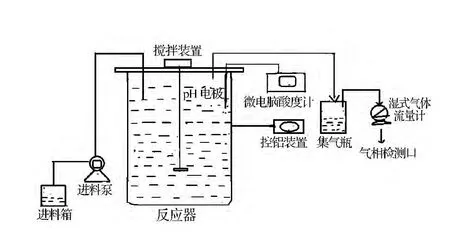
图2 厌氧发酵产氢反应器及流程图Fig 2 The general layout of batch stirring submerged fermentation to produce hydrogen bioreactor
1.2.9 分析测定
pH值用DELAT 320型酸度计测量。稀释二重叠皿平板法测定活菌数。水解液中还原糖含量用3,5-二硝基水杨酸法(DNS)测定。气体的收集采用排水法。定期从发酵产生的气体中取100 μL注入气相色谱仪(型号GC-SP 6890)测定发酵气体中氢气的含量。氩气为载气,流速为40 mL/min,色谱柱为3 mm内径不锈钢柱(TDX分子筛填充柱)柱温、汽化室和检测室分别为90、130、130 ℃。
2 结果与讨论
2.1 产氢菌的分离与筛选
经初筛和复筛,从铀矿床中分离得到5株产氢能力较好的菌株,结果见表1,其利用产氢菌富集培养基单位体积产氢量为(928.3±90.24)mL/L,与相关文献数据相比[20-22],这些源于铀矿极端环境的野生菌株具有较高的产氢量,其中菌株w-14的产氢量最高。静态产氢试验时,接种4 h后w-14菌株开始有气泡产生。24 h后用气相色谱对w-14菌株的气相产物进行分析(产氢色谱图见图3),氢气含量达到86.72%。间歇产氢试验中,w-14的产氢累积量达到1 071.4 mL/L,比李珊珊等[20]利用阴沟肠杆菌FMLC以葡萄糖为底物产氢的累积产氢量(1 032 mL/L)略高,故源于铀矿极端环境的产氢菌株具有很好的应用潜力。
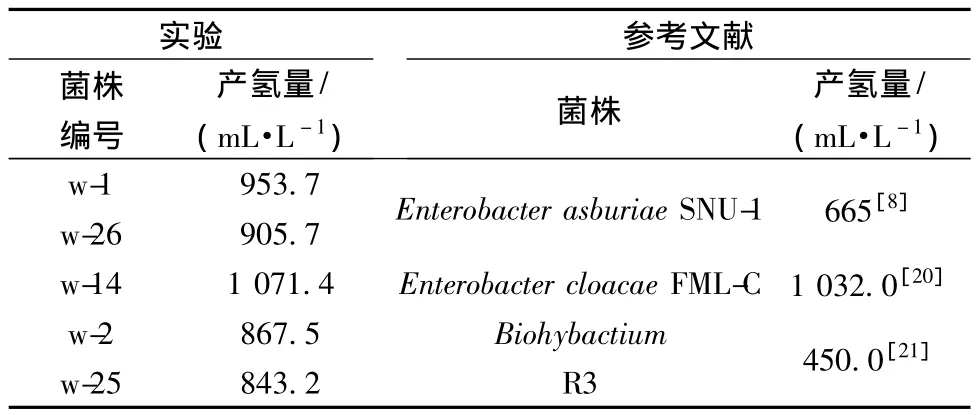
表1 筛选后的产氢菌株的产氢能力对比Table 1 The hydrogen production ability of hydrogen production bacteria after screening
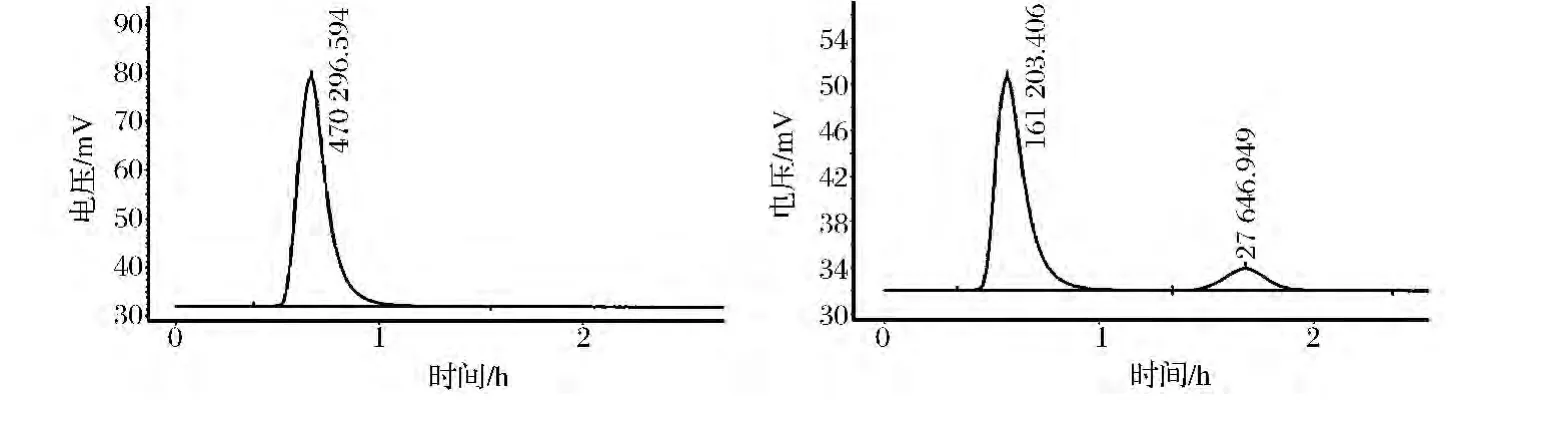
图3 纯氢(左),w-14菌株(右)的产氢色谱峰值Fig 3 The chromatogram curve of standard hydrogen(left)and the strain w-14(right)
2.2 w-14菌株鉴定
w-14菌株在肉汁胨培养基深层培养20h,菌体杆状,大小(0.6~1)μm×(3.0~5.6)μm,革兰氏染色阳性(图4),培养28~30 h产生芽孢,芽孢中生;专性或兼性厌氧,具运动性。生理生化反应结果见表2;16S rRNA序列用MEGA 5.1构建系统发育树见图5。
16S rRNA基因序列同源性比较可见,w-14和Clostridium butyricum strain W4同源性达到100%。根据菌株形态特征,生理生化及16S rRNA基因序列分析结果,w-14菌株鉴定为 Clostridium butyricum。GenBank登录号为KM528123。

图4 w-14革兰氏染色(左)和扫描电镜(右)照片Fig 4 Gram's staining(left)and scanning electron microscope image(right)of the strain w-14
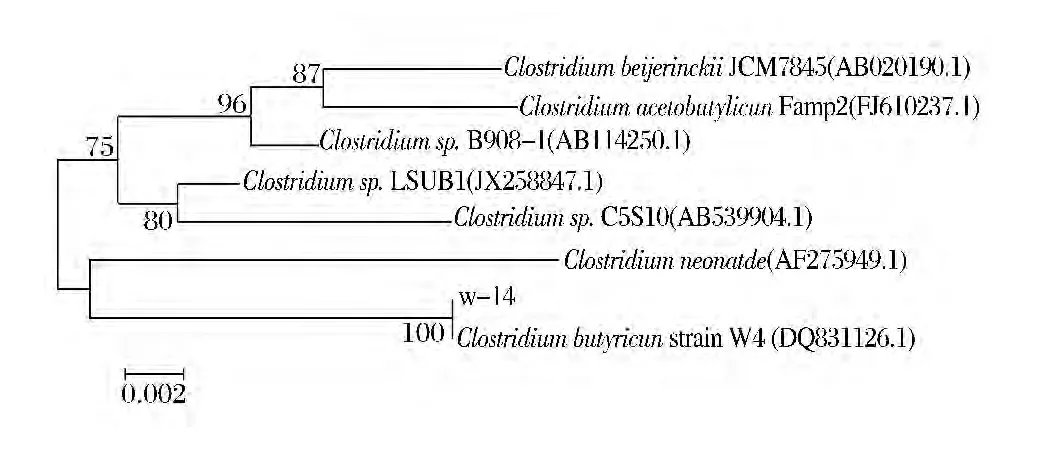
图5 菌株w-14的16S rRNA基因序列的系统发育树状图Fig.5 Neighbor-joining tree showing the phylogenetic position of the isolated strain w-14,based on the 16S rRNA gene sequences of the strain w-14

表2 菌株w-14的生理生化鉴定结果(一)Table 2 Physiological characteristics of the strain w-14
2.3 w-14菌株以玉米秸秆酵解物为基质的发酵产氢
2.3.1 w-14菌株生长与产氢规律
菌株w-14在产氢菌富集培养基的生长与产氢曲线如图6所示
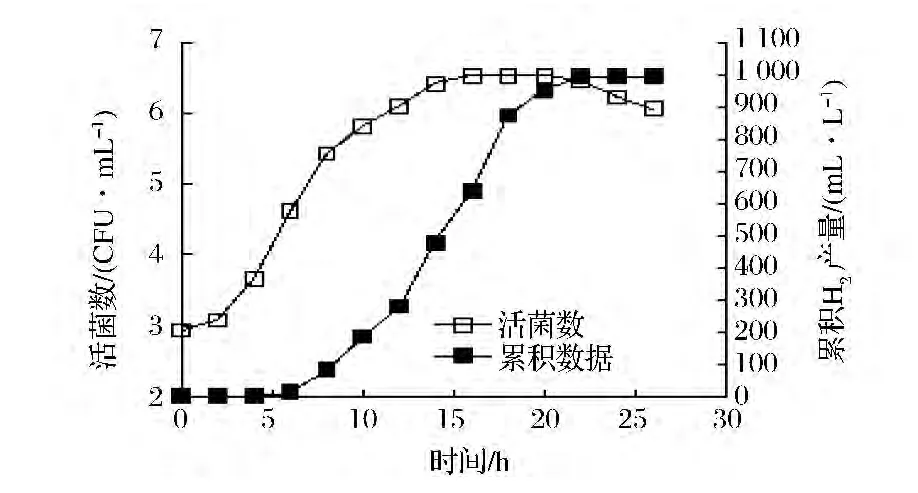
图6 菌株w-14的生长与产氢曲线Fig.6 The curve of w-14 ’s growth and hydrogen production
由图6可见,0~4 h菌数增加缓慢为延迟期。4~16 h为对数生长期,细菌数量从5.64×104CFU/mL增加到4.7×106CFU/mL,菌数呈指数递增,16 ~20 h为稳定期,活菌数基本上没有变化始终在5.6×106个上下,21 h之后为衰亡期,菌数有所下降。w-14菌株产氢从6 h开始,持续到24 h。并在6~18 h期间产氢量迅速增加。
2.3.2 不同KQ-麸曲浓度的秸秆酵解对w-14菌株产氢的影响
秸秆酵解加入KQ-麸曲的量对其酵解物中还原糖和w-14菌株生长及产氢影响结果见图7。由图7可见,随着麸曲质量浓度的增加,还原糖含量逐渐增加,活菌数和菌株产氢量也随着糖浓度的增加而增加,当麸曲质量浓度为20 g/L,还原糖含量、菌数和菌株的产氢量分别为403 mg/g-cs、6.03×106CFU/mL和99.7 g/g-cs,当麸曲浓度为30 g/L时,还原糖含量、菌数和菌株的产氢量变化不大,故确定的麸曲最适用量为20 g/L。
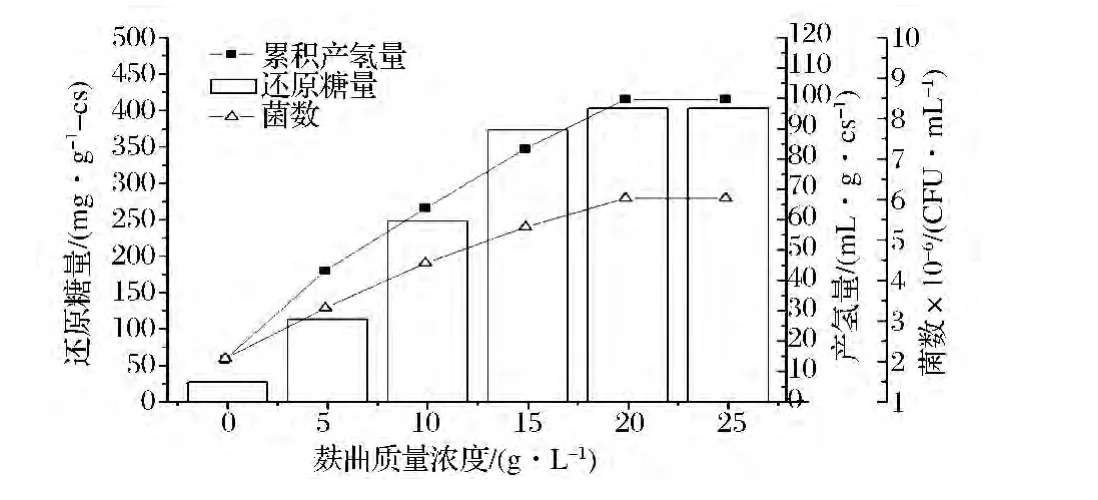
图7 不同麸曲浓度下还原糖含量和菌株w-14生长、产氢量的变化曲线Fig.7 The curve of w-14 ’s growth,cumulative H2yield and reducing sugar content at different concentrations of bran koji
2.3.3 玉米秸秆酵解温度、时间、pH对w-14菌株产氢的影响
预处理的秸秆粉经KQ-麸曲酵解,其酵解温度、时间及pH对w-14菌株产氢的影响见图8。
由图8可见,w-14菌株以不同酵解作用条件下的玉米秸秆酵解物为基质累积产氢量随时间的变化趋势有相似性,均经过5~6 h的延迟期后开始产生氢气,随后累积产氢量随酵解温度、时间、pH的增加而迅速增加,结果表明w-14菌株利用在45℃,pH 5.0酵解84 h的秸秆酵解物的累积产氢量达99.7 mL/g-cs,其后随着酵解温度、pH、时间继续增加,w-14菌的累积产氢量不再增加并呈下降趋势,其原因是温度、pH升高,影响了麸曲酶活性导致纤维素的降解率下降,还原糖减少,产氢量下降;以上结果与文献[17]纤维素酶对玉米秸秆进行糖化酵解发酵产氢的研究相比,具有成本低,氢气转化率高,易于工业化生产的优势。
2.3.4 w-14菌株以秸秆酵解物为基质产氢发酵条件优化结果
L9(34)正交试验结果见表3。由表3可知,w-14菌株以秸秆酵解物为基质最佳产氢发酵条件为:接种量为10%,温度为37℃,初始 pH值为7.0,菌龄16 h,在此条件下菌株的产氢量和平均产氢速率最大,分别为140.24 mL/g-cs和12.19 mL/(g-cs·h)。分别以产氢量和平均产氢速率为指标,其影响因素的均表现为:D(温度)>C(接种量)>B(初始pH)>A(菌龄)。优化后w-14菌株利用秸秆酵解物的产氢量比优化前提高40.66%。
2.3.5 w-14菌株利用玉米秸秆酵解物发酵产氢放大实验
由图9可见,5 L厌氧反应器中菌株w-14利用秸秆酵解物产氢的累积产氢量与氢气浓度(累积产氢量占总气体的百分含量)随时间的变化,在0~36 h累积产氢随着发酵时间增加迅速增加,累积氢产量达到142.65 mL/g-cs,其后产氢量增加的速度有所减缓,并逐渐趋于稳定;发酵培养至56 h时产氢基本结束,累积氢产量为149.09 mL/g-cs,与正交试验结果140.24 mL/g-cs一致。其氢气浓度也呈现是先增加后减少趋势,24 h时氢气浓度达到最高54.62%。随着w-14菌进入稳定生长期,底物逐渐消耗,氢气浓度开始缓慢下降,至56 h时发酵结束,氢气浓度降到30.23%。
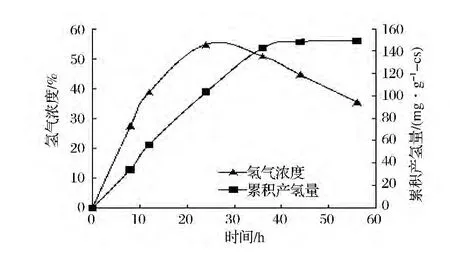
图9 累积产氢量与氢气浓度随时间的变化曲线Fig.9 The curve of cumulative H2yield and H2 percentage of mix gas vs.time
3 小结
从铀矿中分离获得1株可利用玉米秸秆的高效产氢菌w-14,经生理生化及16S rRNA基因序列分析鉴定w-14为丁酸梭菌(Clostridium butyricum),与已有研究的丁酸梭菌相比,该菌株非严格厌氧菌,深层培养即可,更利于工业化生物氢能源生产。w-14菌株以经KQ-麸曲发酵后的玉米秸秆酵解物为基质,进行5L深层厌氧发酵,在种龄16 h,接种量10%,pH值7.0,产氢发酵温度37℃条件下累积产氢量达149.09 mL/g-cs。本研究获得的利用秸秆酵解物发酵产氢的菌株w-14以及对玉米秸秆的酵解处理工艺对开发利用可再生生物质,转化生产洁净氢能源具有一定的理论研究意义和的应用价值。
[1] Lee D H,Lee D J.Biofuel economy and hydrogen competition[J].Energy Fuel,2008,22(1):177 - 181.
[2] Bockris J M.The origin of ideas on a hydrogen economy and its solution to the decay of the environment[J].International Journal of Hydrogen Energy,2002,27(7 -8):731-740.
[3] CHEN C C,LIN C Y.Start-up of anaerobic hydrogen producing reactors seeded with sewage sludge[J].Acta Biotechnol,2001,21(4):371 -379.
[4] Ayhan D.Biofuels sources,biofuel policy,biofuel economy and global biofuel projections[J].Energy Conversion and Management,2008,49(8):2 106 -2 116.
[5] LIN C N,WU S Y,CHANG J S.Fermentative hydrogen production with a draft tube fluidized bed reactor containing silicone-gel-immobilized anaerobic sludge[J].International Journal of Hydrogen Energy,2006,31(15):2 200 -2 210.
[6] Chen W M,Tseng Z J,Lee K S,et al.Fermentative hydrogen production with Clostridium butyricum CGS5 isolated from anaerobic sewage sludge[J].International Journal of Hydrogen Energy,2005,30(10):1 063 - 1 070.
[7] Kalia V C,Jain S R,Sharma C B,et al.Fermentation of bio-waste to H2by Bacillus licheniformis[J].World Journal of Microbiology and Biotechnology,1994,10(2):224 -227.
[8] Shin J H,Yoon J H,Ahn E K,et al.Fermentative hydrogen production by the newly isolated Enterobacter asburiae SNU-1[J].International Journal of Hydrogen Energy,2007,32(2):192 -199.
[9] Bisaillon A,Turcot J,Hallenbeck P C.The effect of nutrient limitations on hydrogen production by batch cultures of Escherichia coli[J].International Journal of Hydrogen Energy,2006,31(11):1 504 -1 508.
[10] LI J Z,REN N Q ,LI B K ,et al.Anaerobic biohydrogen production from monosaccharides by a mixed Microbial community culture[J].Bioresource Technology,2008,99(14):6 528-6 537.
[11] XING D F,REN N Q,WANG A J ,et al.Continuous hydrogen production of auto-aggregative ethanoligenens harbinense YUAN-3 under non-sterile condition[J].International Journal of Hydrogen Energy,2008,33(5):1 489 -1 495.
[12] YANG H J,SHEN J Q.Effect of ferrous iron concentration on anaerobic bio-hydrogen production from soluble starch[J].International Journal of Hydrogen Energy,2006,31(15):2 137 -2 146.
[13] Mei-Ling Chong,Raha Abdul Rahim,Yoshihito Shirai,et al.Biohydrogen production by Clostridium butyricum EB6 from palm oil mill effluent[J].International Journal of Hydrogen Energy,2009,34(2):764 -771.
[14] Chen S D,Lee K S,Lo Y C,et al.Batch and continuous biohydrogen production from starch hydrolysate by Clostridium species[J].Int J Hydrogen Energy,2008,33(4):1 803-1 812.
[15] TAO Y Z,CHEN Y,WU Y Q,et al.High hydrogen yield from a two-step process of dark-and photo-fermentation of Sucrose[J].International Journal of Hydrogen Energy,2007,32(2):200 -206.
[16] FAN Y T,ZHANG Y H,ZHANG S F.Efficient conversion of wheat straw wastes into biohydrogen gas by cow dung compost[J].Bioresource Technology,2006,97(3):500-505.
[17] WANG Y,WANG H,FENG X Q,et al.Biohydrogen production from cornstalk wastes by anaerobic fermentation with activated sludge[J].International Journal of Hydrogen Energy,2010,35(7):3 092 -3 099.
[18] Buchanan R E,Gibbons N E.Bergesy’s Manual of Determinative Bacteriology[M].Beijing:Science Press,1984:157-795.
[19] 东秀珠,蔡妙英,等,常见细菌鉴定手册[M].北京:科学出版社,2001:156-198.
[20] 李珊珊,范代娣,马晓轩,等.厌氧发酵产氢细菌的筛选及其产氢优化[J].微生物学通报,2009,36(9):1 275-1 282.
[21] 任南琪,林明,马汐平,等.厌氧高效产氢细菌的筛选及其耐酸性研究[J].太阳能学报,2003,24(1):80-84.
[22] 王东阳,李永峰,任南琪,等.新型产氢细菌Biohybactium R3利用乳糖进行发酵产氢的实验研究[J].现代化工,2008,28(增刊2):130 - 132.
