体外模拟柴达木大肥菇胞内多糖在幼龄肠道的消化特征
2022-02-22张奋搏胡世成谢惠春焦迎春
张奋搏,胡世成,谢惠春,焦迎春*
1(青海大学 农牧学院,青海 西宁,810016)2(青海省青藏高原药用动物资源重点实验室,青海 西宁,810008)
柴达木大肥菇[Agaricusbitorquis(Quél.) Sacc.]是生长于青藏高原柴达木盆地的一种大型野生食用真菌[1],具有高蛋白、低脂肪、高纤维和维生素及矿物质丰富等特点,同时含有丰富的多糖、三萜、酚酸等活性成分,其中多糖是柴达木大肥菇中一类具有多种生理功效的活性物质[2]。研究者发现食用菌多糖可以改善脂质代谢,保护胰岛免受伤害[3],并且还具有抗氧化、降血糖和调节免疫[4]等益生功效。同时,课题组前期的研究表明在柴达木大肥菇的3种多糖中,胞内多糖(intercellular polysaccharides,IPS)相比于胞外多糖及子实体多糖,具有更好的抗氧化、抗疲劳作用[5],是3种多糖中作为益生元进行功能性食品开发的最佳选择。
多糖是一种广泛存在于自然界中的重要活性成分,不能被人体的唾液、食道、胃液、肠液消化,但可以借助肠道中的微生物发酵将其分解和利用[6],难消化多糖经由特定微生物酵解能够产生短链脂肪酸和其他代谢产物,研究发现短链脂肪酸对于人体有很好的益生作用,如维持水电解质的平衡、为人体供能、保护肠黏膜的屏障,此外,研究表明,多糖能够影响肠道微生物菌群结构,维护菌群稳态,增加有益微生物和减少有害微生物,对于肥胖、痔疮、直肠癌、结肠癌等慢性疾病都展现出较好的预防效果[7]。目前,多糖的肠道微生物酵解特征的研究多以体外模拟的方式开展,取得了较好的成效。KONG等[8]发现,肠道菌群酵解海藻浒苔和海带的硫化酸多糖后,发酵体系的pH降低,短链脂肪酸的含量均显著增加,且有调节菌群结构的效果,益生菌均显著高于对照组。CHEN等[9]的研究表明,茶树花多糖(tea flower polysaccharide,TFPS)可以被人体粪便微生物水解成一些分子质量较小的片段,但不能在唾液、胃液、小肠液中被消化。同时,发酵体系的pH降低,短链脂肪酸的产量显著提高。此外,TFPS的发酵产物也促进了益菌群的生长。
针对柴达木大肥菇的研究,目前已经完成了菌种驯化、成分分析、多糖提取工艺优化、多糖抗缺氧及抗疲劳作用探究,但尚未见针对IPS的活性功能对人体的影响开展研究。本实验以柴达木大肥菇IPS为研究对象,通过构建体外模型,测定并分析酵解过程中多糖含量、pH值、单糖和短链脂肪酸组成及含量的动态变化,研究多糖酵解前后,肠道菌群的消化特征差异,为在功能性食品工业中将柴达木大肥菇IPS开发成益生元提供科学依据和数据支持,也为青海高原地区这一独具特色的食用真菌活性成分开发提供思路和理论基础。
1 材料与方法
1.1 材料与试剂
柴达木大肥菇菌种,青海大学食品科学与工程实验室保藏菌种;柴达木大肥菇IPS,青海大学食品科学与工程实验室自行制备。
短链脂肪酸标准品(色谱纯)、单糖标准品(色谱纯)、半乳糖醛酸标准品(色谱纯)、葡萄糖醛酸标准品(色谱纯)、无水葡萄糖标准品、胰蛋白胨、蛋白胨、可溶性淀粉、酵母浸提物、果胶、酪蛋白、刃天青、吐温-80、尔胶、半胱氨酸、胆酸盐、黏蛋白,美国Sigma公司。
1.2 仪器与设备
SPD-20AV液相色谱、GC-2030气相色谱,日本岛津公司;YQX-Ⅱ厌氧培养箱,上海新苗医疗器械制造公司;722 N紫外可见分光光度计,上海佑科仪器仪表公司;THZ-103B恒温振荡培养箱,上海一恒科技公司;SB-3200TDT超声波清洗机,宁波新芝生物科技公司。
1.3 实验方法
1.3.1 多糖的制备
将柴达木大肥菇菌丝体与蒸馏水按料液比1∶10(g∶mL)混合,在温度50 ℃、超声辅助提取10 min的条件下重复多次提取多糖。混合多次提取的多糖溶液,用苯酚硫酸法测定其浓度。于水温60 ℃,转速65 r/min在旋转蒸发仪中浓缩至目标体积,收集多糖浓缩液,在洁净工作台中,用一次性针筒及0.2 μm滤膜进行无菌过滤。
1.3.2 D-PBS溶液及培养基的配制
D-PBS溶液:0.8 g NaCl,0.02 g KCl,0.115 g Na2HPO4和0.02 g KH2PO4,用蒸馏水定容于100 mL。D-PBS在121 ℃下灭菌30 min,备用。
发酵培养基:根据张冠亚[10]的方法稍作修改:0.175 g胰蛋白胨,0.175 g蛋白胨,0.175 g可溶性淀粉,0.157 5 g酵母浸提物,0.157 5 g NaCl,0.157 5 g KCl,0.07 g 果胶,0.105 g酪蛋白,0.14 g黏蛋白,0.052 5 g NaHCO3,0.003 15 g MgSO4·H2O,0.035 g 尔胶,0.028 gL-半胱氨酸,0.017 5 g KH2PO4,0.017 5 g K2HPO4,0.014 g胆酸盐,0.002 8 g CaCl2,0.000 175 g FeSO4·7H2O,0.14 mL 0.25 g/L刃天青和0.035 mL吐温-80用蒸馏水定容于35 mL。培养基在121 ℃下灭菌30 min,以备使用。
1.3.3 多糖体外酵解
根据姚思雯等[11]的方法稍作改进:收集健康幼龄儿童(3~5岁)的粪便样品,标准为:近1个月内未使用过抗生素、益生菌等促进胃肠动力药物,正常摄入饮食,无肠道疾病的几素;并且与家属签署知情同意书。在厌氧工作站中进行实验操作,将粪便样品和10%(体积分数)D-PBS溶液,搅拌制成为20%(质量分数)的固液混合物,纱布过滤,收集滤液,备用。将1 mL 多糖溶液(20 mg/mL)与2 mL粪便滤液、2 mL发酵培养基加入到厌氧培养管中,封管后置于37 ℃、160 r/min恒温摇床中进行酵解培养并在酵解0、1、2、4、6、12、24、48 h后依次取出相应时间点的厌氧管。将厌氧培养管迅速进行冰浴20 min,终止酵解反应。空白对照组与上述步骤一致,仅将多糖溶液替换成无菌水。
1.3.4 多糖含量的测定
1.3.4.1 多糖标准曲线的绘制
采用苯酚-硫酸法[12]:将葡萄糖标准品烘干至恒重,准确称取0.01 g并溶于蒸馏水中配制成0.1 mg/mL标准溶液。吸取标液0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL各补水至2.0 mL,依次添加6%(体积分数)的苯酚试剂0.5 mL和浓硫酸5.0 mL,摇匀,静置20 min,空白对照仅将标液替换成蒸馏水,其余步骤与上述操作相同,于490 nm处测OD值。绘制葡萄糖标准曲线,得回归方程为:y=31.918x+0.056 9(R2=0.998 2)。
1.3.4.2 样品吸光值的测定
取酵解上清液10 μL,加入390 μL蒸馏水进行稀释,另吸取20 μL稀释液,补水至1 mL,依次加入0.25 mL 6%苯酚、0.25 mL浓硫酸,混匀,静置20 min,于490 nm下检测其OD值,根据标准曲线及稀释倍数计算含量。
1.3.5 单糖及醛酸组成及含量的测定
1.3.5.1 多糖的衍生化处理
取酵解上清液200 μL,依次加入0.3 mol/L 氢氧化钠、200 μL 0.5 mol/L 1-苯基-3-甲基-5-吡唑酮-甲醇溶液200 μL,混匀,在70 ℃下水浴100 min,冷却至室温,再加入0.3 mol/L盐酸 200 μL,混匀,用1 mL 氯仿萃取1次,在8 000 r/min条件下离心10 min,抽取水相。
1.3.5.2 液相色谱条件
色谱柱型号为C18(4.6 mm×250 mm,5.00 mm),流动相为0.1 mol/L的磷酸缓冲液(pH 6.92)-乙腈(体积比80∶20),流速为1 mL/min,检测器为UVD,柱温箱和检测器的温度均为35 ℃,进样量为5 μL。
1.3.5.3 单糖及醛酸标准曲线的绘制
精确称取半乳糖醛酸、阿拉伯糖、葡萄糖醛酸各0.01 g,溶于10 mL超纯水中,使其终质量浓度均为1.00 mg/mL;精确称取葡萄糖、甘露糖0.02 g,溶于10 mL超纯水中,配制成2 mg/mL单糖标准液;将2次标准液混合,按照0.1、0.2、0.3、0.4、0.5 μL的上样量进行液相色谱测定,根据测定结果分别以单糖含量、峰面积为横纵坐标,作标准曲线,得各单糖及醛酸的回归方程,如表1所示。

表1 标准溶液中各单糖及醛酸的回归方程Table 1 regression equation of monosaccharide and aldehyde acid in standard solution
1.3.6 短链脂肪酸组成及含量的测定
1.3.6.1 气相色谱条件
参考RODRIGUES等[13]的方法稍作改进,色谱柱为WAX,流动相为高纯度氮,检测器为火焰离子检测器,检测器温度和进样口温度均为240 ℃,分流比1∶10,氢气流量30 mL/min,空气流量300 mL/min,进样量0.2 μL。升温程序:初始温度100 ℃,持续0.5 min,再升温至180 ℃,升温速度为4 ℃/min。
1.3.6.2 短链脂肪酸标准曲线的绘制
将短链脂肪酸混标按照0.1、0.2、0.3、0.4、0.5 μL 上样量进行气相色谱测定,根据测定结果以及产品中附带的短链脂肪酸浓度表计算短链脂肪酸含量,以短链脂肪酸含量、峰面积为横纵坐标,做标准曲线,得各短链脂肪酸的回归方程,如表2所示。
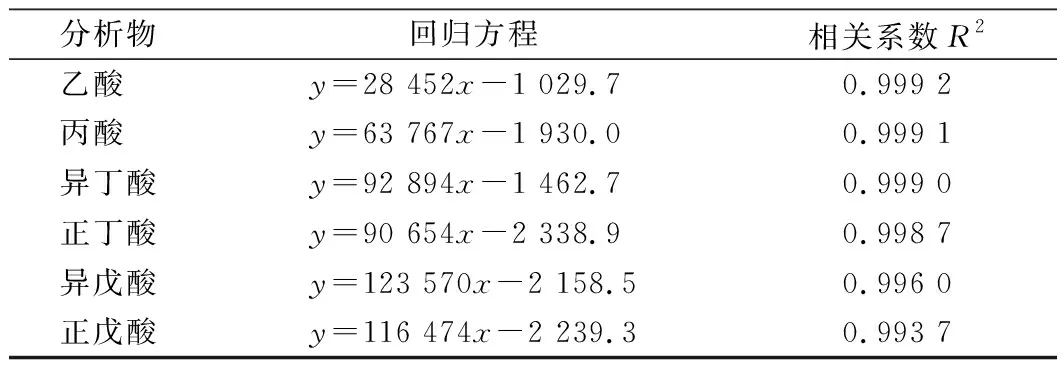
表2 标准溶液中各短链脂肪酸的回归方程Table 2 regression equation of each short-chain fatty acid in standard solution
1.3.7 pH的测定
将经过不同培养时间的实验组和对照组的酵解产物在9 200 r/min条件下离心15 min,取酵解上清液,用pH计重复测定3次。
1.4 数据分析
通过SPSS 23.0处理数据及其标准差;使用Origin(2018 C)软件制作数据图;差异显著水平为P<0.05;数据书写格式为:平均值±标准差。
2 结果与分析
2.1 酵解过程中多糖含量变化
多糖是一类天然高分子聚合物,在人体的消化过程中,由于人体自身缺乏碳水化合物活性酶,大部分的植物多糖经过酶解后只降低了分子质量,并不产生游离单糖,而在肠道菌群的共同作用下可以将多糖降解并产生一系列酵解产物[14]。如图1所示,随着酵解时间的延长,多糖含量呈现持续下降的趋势,酵解4~6 h时,多糖含量显著下降(P<0.05)。在体外酵解0~4 h时,多糖含量降幅缓慢,酵解4 h后,IPS残量为(2.36~0.16)mg/mL,相较于初始值下降了30.38%;酵解4~12 h时,多糖的降解速率迅速加快,酵解12 h后,IPS已被微生物菌群完全消耗。据文献报道,肠道菌群对于不同多糖的消耗率各不相同,XUE等[15]研究的香菇多糖在体外酵解24 h后碳水化合物的消耗率为100.00%;LIU等[16]研究发现,长根奥德蘑多糖在体外酵解24 h后碳水化合物的消耗率为56.39%,本实验中的IPS仅在体外酵解12 h后消耗率已达到100.00%,表明IPS有良好的消化性,能够被菌群充分降解,快速发挥益生功效。
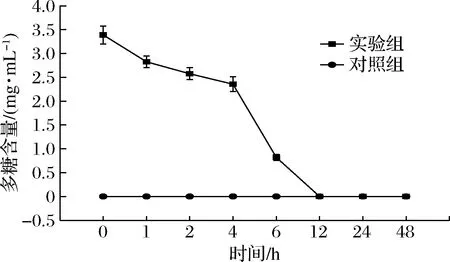
图1 不同酵解时间多糖的含量变化Fig.1 Changes of IPS content in different fermentation time
2.2 酵解过程中单糖及醛酸组成及含量变化
2.2.1 酵解过程中单糖及醛酸总量变化
在微生物群落的酵解作用下,多糖部分糖苷键发生断裂,导致在酵解的初期阶段寡糖及糖醛酸含量的增加,随着发酵时间的延长,产生的寡糖及糖醛酸又会被微生物群落作为生长发育的底物消耗,因此在发酵后期寡糖及糖醛酸的含量逐渐减少。如图2所示,随着酵解时间的延长,实验组和对照组的单糖及醛酸含量都呈现先升高后降低趋势,且实验组与对照组之间差异显著(P<0.05)。体外酵解1 h时,单糖及醛酸总量迅速上升,达到(37.71±1.54) μg/mL,是对照组的1.45倍,酵解1 h后,单糖及醛酸总量的上升速率开始降低;在体外酵解6 h时,总量达到最大值(53.21±1.11)μg/mL,相较于酵解1 h增加了41.10%,是对照组最大值的1.46倍;体外酵解6 h后,单糖及醛酸总量呈下降趋势,酵解48 h时,单糖及醛酸总量降低了99.40%,最终降至(0.32±0.03)μg/mL。MAO等[17]的研究表明冬虫夏草胞外多糖酵解液中单糖含量随着酵解时间的延长先升高后降低,与本实验结果一致。
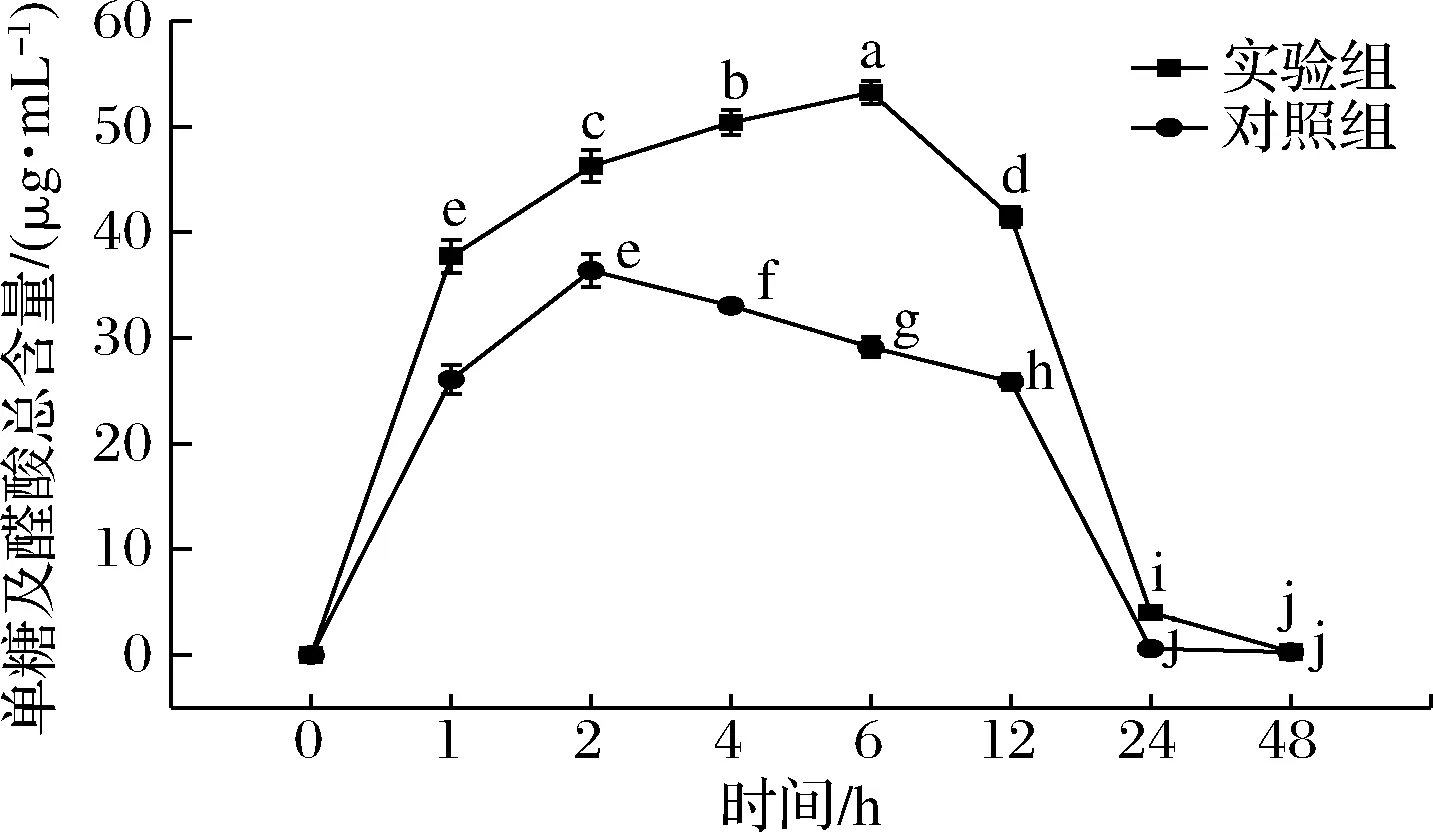
图2 不同酵解时间单糖及醛酸的总量变化Fig.2 Changes of total amount of monosaccharide and uronic acid with different fermentation time注:不同字母表示具有显著性差异(P<0.05)(下同)
结果表明,柴达木大肥菇IPS可以作为被肠道菌群利用的碳源,在体外发酵过程中,肠道菌群不断利用IPS将其分解为单糖及醛酸以满足自身的生长发育及繁殖的需要。
2.2.2 酵解过程中单糖及醛酸组成变化
随着酵解时间的延长,甘露糖、葡萄糖醛酸(图3-A、图3-B)的含量都呈先升高后降低的趋势,在酵解24 h时出现组间差异最大值;半乳糖醛酸(图3-C)的含量呈先升高后降低的趋势,在酵解2 h时出现组间差异最大值;葡萄糖(图3-D)的含量呈先升高后降低的趋势,在酵解6 h时出现组间差异最大值;阿拉伯糖(图3-E)的含量呈持续下降的趋势,在酵解1 h时出现组间差异最大值。
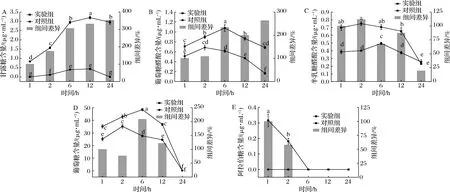
A-甘露糖;B-葡萄糖醛酸;C-半乳糖醛酸;D-葡萄糖;E-阿拉伯糖图3 不同酵解时间各单糖及醛酸的含量及组间差异变化Fig.3 The contents of monosaccharide and uronic acid and the difference between groups at different time of fermentation注:组间差异变化表示以酵解1 h组间差值为基准的相对差异变化
由图4所示,在体外酵解1 h时,发酵体系中的单糖和醛酸组成为:葡萄糖93.23%、甘露糖2.20%、葡萄糖醛酸1.87%、半乳糖醛酸1.85%、阿拉伯糖0.85%,与对照组相比均差异显著(P<0.05);在体外酵解2~24 h时,发酵体系中葡萄糖和阿拉伯糖含量一直呈下降趋势,甘露糖、葡萄糖醛酸和半乳糖醛酸含量一直呈上升趋势,且与对照组相比均差异显著(P<0.05);在体外酵解24 h时,单糖和醛酸的剩余总量为(4.06±0.19)μg/mL,相较于6 h下降了92.37%,发酵体系中的单糖和醛酸组成为:葡萄糖4.68%、甘露糖72.66%、葡萄糖醛酸17.00%、半乳糖醛酸5.66%,与对照组相比差异显著(P<0.05)。
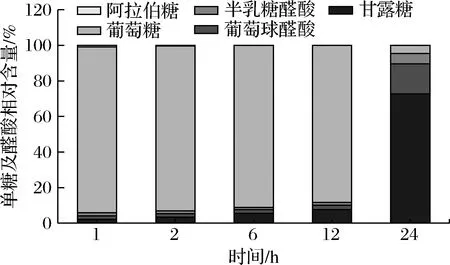
图4 不同酵解时间单糖及醛酸的相对含量变化Fig.4 Relative content changes of monosaccharide and uronic acid at different fermentation time
分析各种单糖及醛酸的相对含量变化情况可知,随着发酵时间的延长,葡萄糖和阿拉伯糖的相对含量持续降低,而甘露糖、葡萄糖醛酸的相对含量呈上升趋势。葡萄糖相对含量下降最显著,从93.23%降至4.68%,阿拉伯糖在体外发酵2 h后已无法被检测到,表明在发酵过程中葡萄糖及阿拉伯糖更容易被肠道菌群吸收利用。甘露糖、葡萄糖醛酸含量占比持续升高的原因可能与这2种单糖在胞内多糖中的物理构象有关,导致菌群无法迅速将其降解利用。此外,在酵解1~24 h过程中,甘露糖能够保持相对含量的持续上升,表明IPS中的甘露糖可以在菌群中保持较长的时间,能够发挥能持久的功效,其中D-甘露糖具有抑制肿瘤、抗炎、治疗细菌性尿道感染等功效,在未来研究中可以将甘露糖开发作为胞内多糖成分开发的一个重点。
2.3 酵解过程中短链脂肪酸组成及含量变化
2.3.1 酵解过程中短链脂肪短总量变化
如图5所示,随着酵解时间的延长,实验组的短链脂肪总量始终呈上升趋势,对照组总量呈先上升后降低的趋势,且实验组脂肪酸总量始终显著高于对照组(P<0.05)。初始时(0 h)实验组的短链脂肪酸总量为(1.21±0.02) mmol/L,是对照组的1.49倍;在体外酵解6 h时,短链脂肪酸总量不断上升,相较于初始值增加了90.91%,是对照组的1.71倍;在体外酵解12 h时,短链脂肪酸总量显著提升,增加了1.18倍,是对照组的2.78倍;在体外酵解24 h时,短链脂肪酸总量上升速率开始降低,增加了25.84%,是对照组的3.96倍;在体外酵解48 h时,短链脂肪酸总量达到(7.54±0.10) mmol/L,增加了19.12%,是对照组的5.24倍。
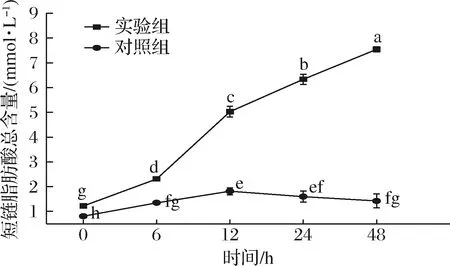
图5 不同酵解时间短链脂肪酸总量变化Fig.5 Changes in total content of short-chain fatty acids in fermentation broth at different times
综上可知,实验组的短链脂肪酸总量不断增加,这与白灵菇多糖[18]相关的研究结果一致,此结果表明肠道菌群利用了IPS降解后的各种单糖及醛酸,并且产生了相应的酵解产物——短链脂肪酸。对照组的短链脂肪酸总量在12 h后出现下降的趋势,可能是因为肠道菌群在消耗完对照组中少量的间接糖源后,又将产生的酵解产物作为能源摄取,以满足自身生存的需求。
2.3.2 酵解过程中短链脂肪酸组成变化
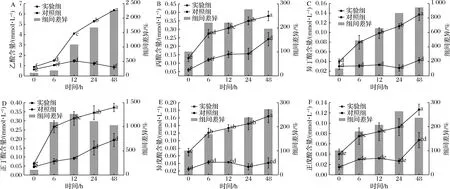
随着酵解时间的延长,乙酸、异丁酸、异戊酸(图6-A、图6-C、图6-E)的含量都呈持续上升的趋势,在酵解48 h时出现组间差异最大值;丙酸、正戊酸(图6-B、图6-F)的含量都呈持续上升趋势,在酵解24 h时出现组间差异最大值,正丁酸(图6-D)的含量呈持续上升的趋势,在酵解12 h时出现组间差异最大值。
A-乙酸;B-丙酸;C-异丁酸;D-正丁酸;E-异戊酸;F-正戊酸图6 不同酵解时间各短链脂肪酸的含量及组间差异变化Fig.6 The contents of short-chain fatty acids and the difference between groups at different fermentation time注:组间差异变化表示以酵解0 h组间差值为基准的相对差异变化
如图7所示,在初始时,实验组的短链脂肪酸总量为(1.21±0.02) mmol/L,其中占比依次为:乙酸71.90%、丙酸10.74%、异丁酸3.31%、正丁酸4.96%、异戊酸5.79%、戊酸3.30%;多糖在体外酵解6 h时,短链脂肪酸总量为(2.31±0.03) mmol/L,其中占比依次为:乙酸64.50%、丙酸11.70%、异丁酸3.46%、正丁酸11.69%、异戊酸5.19%、戊酸3.46%;多糖在体外酵解12 h时,短链脂肪酸总量为(5.04±0.20)mmol/L,其中占比依次为:乙酸81.51%、丙酸6.17%、异丁酸1.99%、正丁酸6.16%、异戊酸2.58%、戊酸1.59%;多糖在体外酵解24 h时,短链脂肪酸总量为(6.34±0.20) mmol/L,其中占比依次为:乙酸83.52%、丙酸5.52%、异丁酸1.81%、正丁酸5.44%、异戊酸2.21%、戊酸1.50%;多糖在体外酵解48 h时,短链脂肪酸总量达到最高值为(7.54±0.10) mmol/L,其中占比依次为:乙酸84.35%、丙酸5.04%、异丁酸1.86%、正丁酸4.91%、异戊酸2.12%、戊酸1.72%。
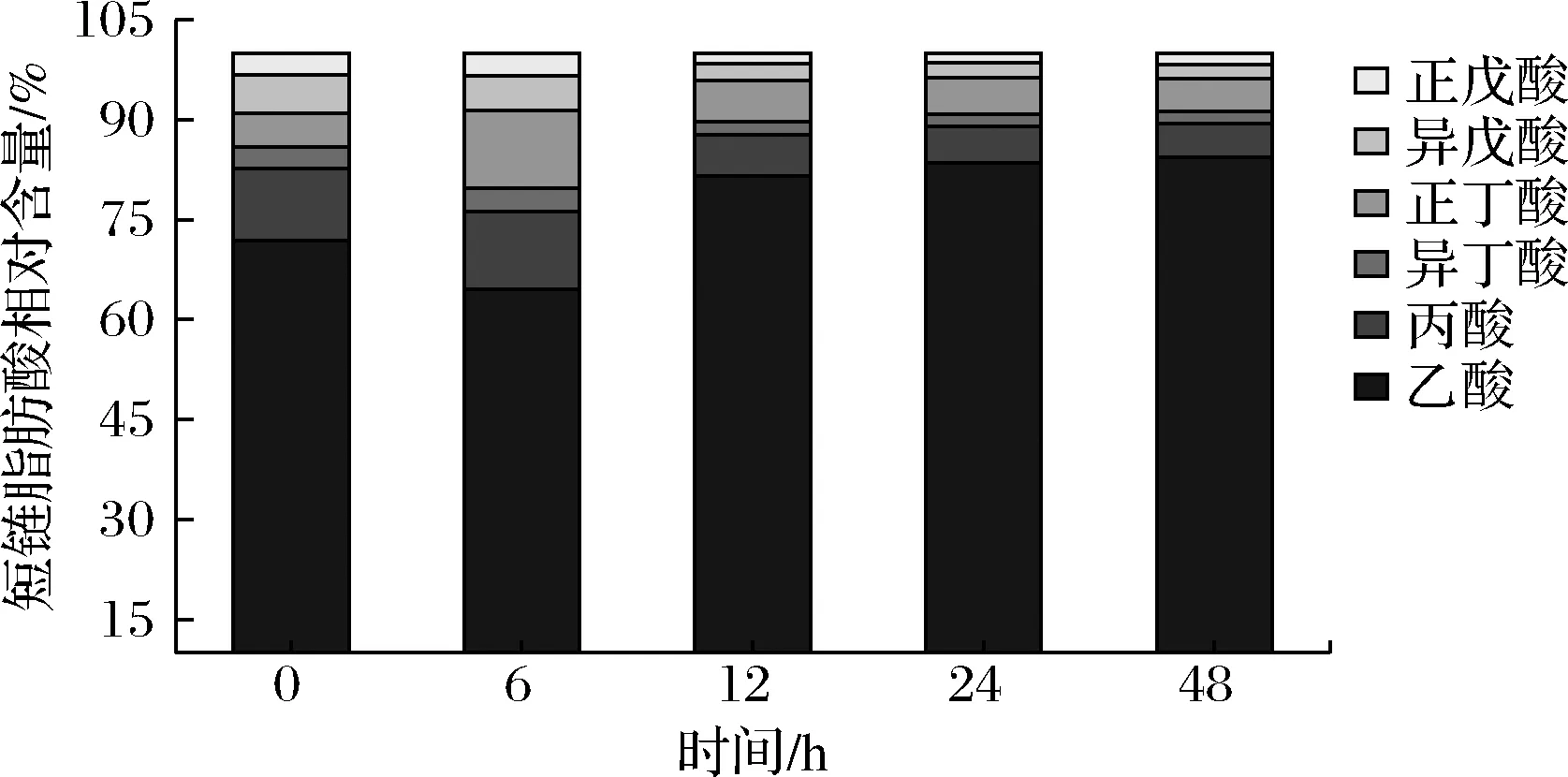
图7 不同酵解时间短链脂肪酸的相对含量变化Fig.7 Relative content changes of short-chain fatty acids with different fermentation times
综上可知,发酵产物中的短链脂肪酸,含量从高到低依次是乙酸>丙酸>正丁酸>异戊酸>异丁酸>正戊酸。在发酵初始时间(0 h),实验组中部分单个短链脂肪酸与对照组无显著差异,如正丁酸、异丁酸,但在多糖发酵48 h时,实验组全部短链脂肪酸都显著高于空白对照组,这个结果进一步表明IPS外模拟消化的过程中,可以被肠道菌群酵解并产生丰富的短链脂肪酸。短链脂肪酸可以抑制肠道炎症、调节免疫系统[19]、维护肠道上层屏障完整性[20]、抑菌[21]等多种功效,是对人体十分健康的代谢产物。此外还有文献报道乙酸可以参与肝脏代谢并作为周边组织的能源[22]。丁酸和丙酸具有抗炎、抑制癌症功效,被部分研究人员认定为组蛋白去乙酰化酶抑制剂[23]。
2.4 酵解过程中pH变化
如图8所示,酵解体系中的pH随着酵解时间的延长逐渐降低,实验组和对照组初始pH存在显著差异(P<0.05),可能是因为浓缩多糖溶液的过程中采用了旋蒸的方式产生了游离H+导致实验组的初始pH值呈弱酸性。体外酵解(0±24 h)时,实验组的pH值持续降低,从6.21±0.01降到3.56±0.01,酵解24 h后, pH值不再下降,稳定在3.56±0.01。体外酵解1~12 h时,对照组的pH值呈下降趋势,从6.98±0.01降到4.65±0.01,酵解12 h后,pH值开始上升,上升趋势一直持续至48 h,最终上升至5.89±0.01。对照组在体外酵解12 h后pH值出现了上升的趋势,推测是24 h后对照组总短链脂肪酸含量下降导致的。本实验结果与黄菊青等[24]报道的竹菇多糖在发酵过程中降低了酵解体系中的pH结果相似。
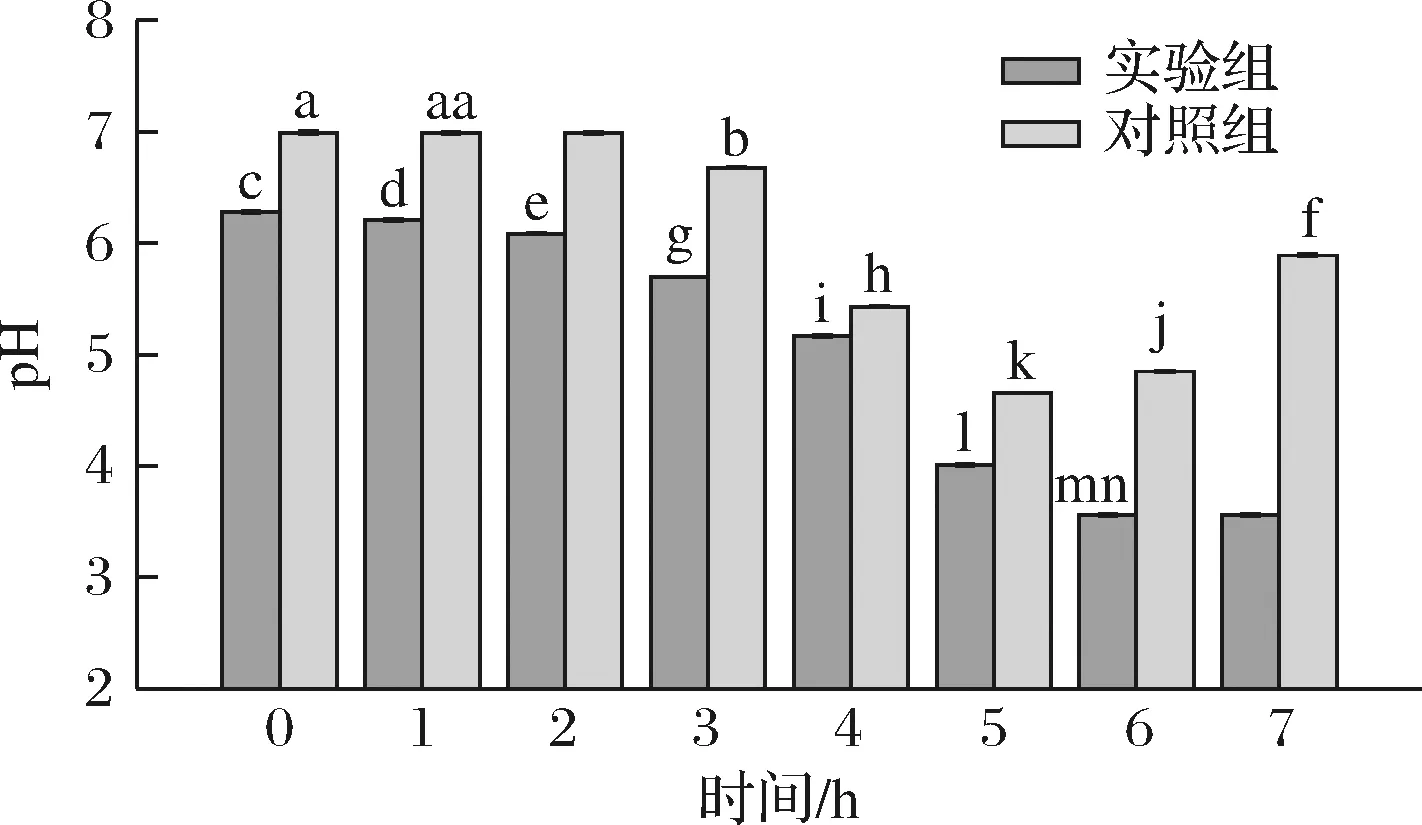
图8 不同酵解时间酵解体系中的pH的变化Fig.8 Changes of pH in the fermentation system with different fermentation time
综上可知,实验组和对照组的pH值具有显著性差异(P<0.05),且实验组的pH值始终低于对照组,表明IPS的添加有助于酵解液产生更多的H+,有报道称肠道中的pH值降低有利于抑制有害菌的定植,避免肠道异常障碍[25]。此外,IPS在发酵24 h后,发酵体系中的pH并未持续下降,而是保持稳定,这表明IPS在肠道菌群的发酵过程中,有利于降低有害菌数量,并维持菌群结构的稳态。
3 结论与讨论
在借助幼龄人群的肠道菌群构建的体外模型中,IPS被微生物群落降解后共产生5种单糖及醛酸:葡萄糖、甘露糖、葡萄糖醛酸、半乳糖醛酸和阿拉伯糖。而MAO等[17]的研究表明,冬虫夏草胞外多糖经微生物群落降解产生的单糖为甘露糖、葡萄糖、半乳糖和果糖,与本文结果相比,冬虫夏草胞外多糖在降解后并未产生任何糖醛酸,可能是IPS与胞外多糖在分子质量和空间结构上的差异,或是原材料生长的海拔、气候不同影响多糖的化学组分存在差异,导致肠道菌群在降解多糖后产生的单糖组成不同。此外,各单糖及醛酸被微生物利用的先后顺序也存在差异。在本文中,葡萄糖与阿拉伯糖的相对含量随酵解时间的延长显著降低,表明在酵解过程中,生物群落更倾向于将葡萄糖及阿拉伯糖作为主要碳源,而冬虫夏草胞外多糖的体外酵解结果表明,微生物群落更倾向于将葡萄糖及半乳糖作为主要碳源,刘孟洋[26]的研究表明,绣球菌多糖在体外酵解过程中,微生物群落主要将降解产生的葡萄糖与甘露糖作为能源物质,这可能是单糖在多糖中的空间位置不同导致的。
随着酵解时间的延长,单糖及醛酸逐渐被肠道菌群消耗并产生了丰富的短链脂肪酸,在本文中,乙酸、丙酸、异丁酸、正丁酸、异戊酸和正戊酸的含量都随着酵解时间的延长持续上升,但相比于其他短链脂肪酸,乙酸的含量最高且与对照组相比差异最显著,而YU等[27]的研究显示,云芝多糖经过体外酵解产生的各种短链脂肪酸中,丙酸的含量最高,乙酸含量其次。对比单糖组成的结果发现;IPS被微生物群落降解后产生了单糖、葡萄糖醛酸及半乳糖醛酸,在云芝多糖的单糖组成中没有任何糖醛酸,而黑灵芝多糖的单糖组成中同样含有半乳糖醛酸,且其短链脂肪酸含量组成与本文相似,因此可能是糖醛酸的存在导致多糖酵解过程中乙酸含量的增加。此外,KOH[28]等报道称,不同的菌属利用不同的途径合成乙酸,如嗜粘阿克曼氏菌,拟杆菌属、戏歧杆菌属、普雷沃菌属、瘤胃球菌属等可通过乙酰辅酶α途径合成乙酸,白僵菌、梭状芽孢杆菌、链球菌可通过wood-Ljungdahl通路合成乙酸,所以也可能是因IPS有利于上述菌属的生长发育,使其代谢活跃导致乙酸的大量合成。
综上,可知柴达木大肥菇IPS可以充分被幼龄人群肠道菌群利用,并且相较于其他食用菌多糖及藻类多糖具有独特的酵解特征,碳水化合物消耗率在酵解12 h便能达到100%,说明柴达木大肥菇IPS具有较好的消化作用,并且通过酵解可产生大量对人体有利的短链脂肪酸,具有较好的益生作用,但柴达木大肥菇IPS在体内是否具有这样的酵解特征还有待进一步研究,后续可以通过灵长类动物实验或采用更加贴近人体肠道复杂情况的体外模型进行考证,并结合微生物群落的基因测序数据以及酵解产物的代谢组学数据更深入地探究柴达木大肥菇IPS与肠道菌群之间的相互联系。
