不消化性葡聚糖体外酵解液对RAW 264.7巨噬细胞的免疫调节作用
2023-10-16张豪钟亚东谢明勇
张豪,钟亚东,谢明勇
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
不消化性多糖广泛存在于食物中,不能被人体消化酶降解,进入结肠后,在丰富的肠道微生物碳水化合物活性酶的作用下,糖苷键断裂,产生小分子的低聚糖或单糖,同时产生短链脂肪酸(short chain fatty acid,SCFAs)、乳酸等有益代谢产物[1-3]。肠道是人体最大的免疫器官,肠上皮细胞具有摄取免疫球蛋白、分泌细胞因子、提呈抗原等免疫功能,与肠组织中的突触细胞、巨噬细胞和淋巴细胞等共同构建肠道免疫系统[4-5]。研究表明,多糖的结肠发酵引起的肠道微生物和SCFAs 的组成、浓度变化会影响着肠道的上皮功能和免疫调节能力[6-7]。
近年来,多糖的肠道免疫调节功能活性相关研究较多,例如,茯苓多糖能抑制高脂饮食下肠道巨噬细胞的凋亡,从而保护肠道屏障的完整性[8]。枸杞果实多糖能够修复肠道屏障来发挥抗糖尿病效果[9]。桑叶多糖能够改善小鼠受损的肠道屏障,通过调节肠道菌群组成和SCFAs 的产生来发挥免疫调节作用[10]。大量研究表明不消化性葡聚糖(indigestible glucans,IGs)具有促进肠道益生菌的生长、改善肠道内环境,增强肠道免疫调节能力等作用[11-12]。然而,关于IGs 在结肠中的酵解产物对肠道免疫调节作用的相关研究较少。多糖的体外肠道菌酵解是分析多糖在人体肠道中降解和活性作用的重要方法,同时为研究多糖的肠道酵解与人体免疫调节的关系提供了可靠方向。本研究以RAW 264.7巨噬细胞为研究对象,以脂多糖(lipopolysaccharides,LPS)为阳性对照,探讨大麦β-葡聚糖(barley βglucan,BG)、海带多糖(laminarin,L)、酵母β-葡聚糖(yeast β-glucan,BY)、茯苓多糖(pachyman,PAC)、抗性淀粉(resistant starch,R)和聚葡萄糖(litesse,Lit)体外酵解产物的免疫调节活性,以期为不消化性葡聚糖的肠道免疫研究和功能食品开发提供参考。
1 材料与方法
1.1 材料与试剂
脂多糖:美国Sigma-Aldrich 公司;小鼠巨噬细胞系RAW 264.7:中国科学院上海生命科学研究院细胞资源中心;胎牛血清:以色列Biological Industries 公司;达尔伯克(氏)改良伊格尔(氏)培养基(Dulbecco's modified eagle medium,DMEM)(含双抗)、磷酸盐缓冲溶液(phosphate buffered saline,PBS):北京索莱宝科技有限公司;多粘菌素B、一氧化氮检测试剂盒、活性氧检测试剂盒:上海碧云天生物技术有限公司;CCK-8试剂盒:美国GlpBio 公司;小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)试剂盒:江苏酶免实业有限公司。
试验中所用IGs 的详细信息[13]如表1所示。

表1 IGs 的基本信息Table 1 Detail information of IGs
1.2 仪器与设备
Varioskan LUX 多功能酶标仪(微孔板检测仪)、CO2培养箱:美国Thermo Scientific 公司;3k15 通用台式冷冻离心机:美国Sigma 公司;CKX41 倒置显微镜:日本Olympus 公司;CytoFLEXS 流式细胞仪:美国Beckman Coulter 公司;FE28-Standard 酸碱度测试仪(pH 计):美国Mettler toledo 公司;7890 B 气相色谱仪:美国Agilent 公司。
1.3 试验方法
1.3.1 粪菌制备
新鲜的粪便样品取自3 位健康志愿者(2 女1 男,22~25 岁,无肠道疾病史),在厌氧手套箱内用含有0.1%的L-半胱氨酸盐酸盐的PBS 缓冲液以1 ∶10(g/mL)比例进行稀释匀浆,经100 μm 细胞过滤器过滤,得到的过滤液用于接种。
1.3.2 体外酵解及产物处理
体外酵解的培养基参考Hughes 等[14]的方法配制。将BG、BY、L、PAC、R 和Lit 6 种IGs 分别以10%的质量分数溶于培养基中,另设置无碳水化合物添加的培养基为空白对照组(control,C),分装至亨盖特厌氧管中并灭菌。体外酵解时,制备的粪便菌液以10%的体积分数接种到厌氧管内培养基中,使每管培养基终体积为10 mL,厌氧酵解24 h(37 ℃,150 r/min),在0、24 h 时收集酵解液,离心15 min(4 ℃,13 000 r/min),取上清液经0.22 μm 无菌滤膜过滤除菌后置于-80 ℃保存。
1.3.3 pH 值和SCFAs 含量测定
取适量酵解液测定其pH 值。将酵解液离心15 min(4 ℃,13 000 r/min),所得上清液过0.22 μm 水系滤头。取0.6 mL 过膜后上清液加入0.2 mL 的10%硫酸涡旋1 min 酸化,0.4 mL 乙醚涡旋混匀,静止2 min 后离心2 min(4 ℃,13 000 r/min),吸取乙醚层过0.22 μm 有机滤膜后经气相色谱仪检测。
采用火焰离子化检测器;色谱柱为熔融石英毛细管柱HP-FFAP;色谱条件设置参考文献[15]。
1.3.4 CCK-8 测定细胞活力
将细胞以1×105个/mL 的密度接种于96 孔细胞培养板中,每孔100 μL DMEM 培养基(含10%胎牛血清),在培养箱(37 ℃,5% CO2)中过夜培养后弃去旧培养基。设置正常组、阴性对照组、阳性组与样品组。正常组加入100 μL 含有10% PBS 的完全培养基,阳性组加入100 μL 含有1 μg/mL LPS(溶剂为PBS,以10%的体积比加入)的完全培养基,样品组加入100 μL 含有不同浓度的IGs 或IGs 酵解液的完全培养基,IGs 的终浓度为0、25、50、100、200、400 μg/mL(以完全培养基溶解和稀释),IGs 酵解液的终浓度为0.03、0.1、0.3、1、3、10、30、100 μL/mL(以PBS 稀释后按体积分数10%加入完全培养基中),阴性对照组只含有培养基、不含细胞。继续培养24 h 后弃去旧培养基,所有孔均加入100 μL 含有10% CCK-8 溶液的培养基,避光培养1 h后,用酶标仪测定450 nm 处的吸光度。细胞活力计算公式如下。
式中:C为巨噬细胞的细胞活力,%;A0为阴性对照组的吸光度;A1为样品组或阳性组吸光度;A2为正常组吸光度。
1.3.5 一氧化氮释放测定
RAW 264.7巨噬细胞的接种培养、分组和给药方式与1.3.4 相同,给药24 h 后收集细胞培养液,按照一氧化氮(nitric oxide,NO)测定试剂盒说明书进行测定。
1.3.6 流式细胞仪检测活性氧含量
将RAW 264.7巨噬细胞以5 个/mL 的细胞密度接种于6 孔细胞培养板中,每孔2 mL 培养基,在培养箱(37 ℃,5% CO2)中过夜培养后弃去旧培养基。根据分组,正常组加入2 mL 含有10% PBS 的完全培养基,LPS 组加入2 mL 含有1 μg/mL LPS 的完全培养基,样品组加入2 mL 含有不同浓度酵解液的完全培养基,酵解液的终浓度为1、10、100 μL/mL。继续培养24 h,弃去旧培养基,用PBS 冲洗,加入含有10 μmol/L 2',7'-二氯荧光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA)的无血清培养基(按照1 ∶1 000的体积比用不含胎牛血清的DMEM 培养基稀释DCFHDA,得到终浓度为10 μmol/L 的DCFH-DA),在37 ℃避光孵育30 min,然后除去培养基,避光用PBS 洗两遍,细胞刮刀收集细胞,离心(1 000×g、5 min),以500 μL PBS 重悬细胞,流式细胞仪测定荧光强度,在Treestar FlowJo 10.6.2 软件中进行活性氧(reactive oxygen species,ROS)数据分析。
1.3.7 细胞因子检测
RAW 264.7巨噬细胞的接种培养、分组和给药方式与1.3.6 相同,给药培养24 h 后收集细胞培养液,按照小鼠TNF-α 试剂盒说明书进行测定。
1.3.8 内毒素分析
设置BG 酵解液组(终浓度为1 μL/mL)和LPS 处理组(终浓度为1 μg/mL),两组分别加入多粘菌素B(polymyxin B,PMB,100 μg/mL) 预处理24 h。RAW 264.7巨噬细胞的接种培养和给药方式与1.3.4 相同,给药24 h 后收集细胞培养液进行TNF-α 测定。
1.4 数据处理
使用Graphpad prism 7.0 对试验结果进行作图分析。应用mintab 19.0 统计软件对各组试验数据进行正态性检验,正态性分布的多组数据间进行单因素方差分析(ANOVA)和Tukey 多重比较检验评估不同组间的差异,当P<0.05 时,认为其具有显著性差异。
2 结果分析
2.1 IGs 对RAW 264.7巨噬细胞活力的影响
细胞活力的测定是评价药物对细胞生长影响作用的一种常用方法[16],通过对样品处理后的巨噬细胞活性的检测可以评价样品的毒性和免疫增强能力。IGs 对RAW 264.7巨噬细胞活力的影响如图1所示。


图1 IGs 对RAW 264.7巨噬细胞活力的影响Fig.1 Effect of IGs on viability of RAW 264.7 macrophages
由图1 可知,在0~400 μg/mL 的浓度范围6 种IGs对RAW 264.7巨噬细胞处理后,相比于0 μg/mL 的正常组,细胞活力没有显著性地降低,而且除R 外,BG 的400 μg/mL、L 的100~400 μg/mL、BY 的25~400 μg/mL、Lit 的20~50 μg/mL 和200~400 μg/mL 以及PAC 的25~200 μg/mL 对RAW 264.7巨噬细胞活力有显著性地提高作用(P<0.05)。表明6 种IGs 在浓度为0~400 μg/mL时,对RAW 264.7巨噬细胞没有毒性作用。
2.2 IGs 酵解液的pH 值和总SCFAs 含量测定
多糖在肠道中酵解产生大量SCFAs,如乙酸、丙酸和丁酸等,是肠道酵解的重要代谢产物[17]。IGs 酵解液的pH 值和总SCFAs 含量测定结果如图2所示。

图2 IGs 体外酵解24 h 的pH 值变化和总SCFAs 含量Fig.2 pH change and total SCFA concentration in IGs fermented for 24 h in vitro
在本试验中总SCFAs 含量为乙酸、丙酸、丁酸、异丁酸、异戊酸和戊酸含量之和。由图2 可知,经过24 h的体外酵解,6 种IGs 均显著性地降低了反应体系的pH 值(P<0.05),表明酵解过程中产生了大量的酸性物质。与空白对照组相比,6 种IGs 的酵解均显著提高了总SCFAs 的含量(P<0.05),其中L 产量最高,此外由高到低依次是BG、BY、Lit、R 和PAC,其中,BY、Lit 和R 的产量之间没有显著性差异(P>0.05)。IGs 的体外酵解过程中SCFAs 的产生与它们的理化性质有关,水溶性越高、糖链结构越简单的IGs 的酵解速率越大,SCFAs 产量越高[18-19]。
2.3 IGs 酵解液对RAW 264.7巨噬细胞活力的影响
IGs 酵解液对RAW 264.7巨噬细胞活力的影响如图3所示。


图3 IGs 酵解液对RAW 264.7巨噬细胞活力的影响Fig.3 Effect of IG fermentation broths on viability of RAW 264.7 macrophages
由图3 可知,与正常组相比,0、24 h 的IGs 酵解液在0.03~100 μL/mL 时不同程度地提高了RAW 264.7巨噬细胞活力,且在一定范围内巨噬细胞活力与酵解液浓度呈依赖性增加。
当酵解0 h 时,BG、L、BY、PAC 酵解液对细胞活力的最佳作用浓度与空白对照组一致,为100 μL/mL,R 和Lit 则为30 μL/mL。酵解24 h 时,IGs 酵解液和空白对照组的最佳作用浓度均比0 h 酵解液组低,添加量较低时即出现活力抑制的现象。其中,前者为0.3~30 μL/mL,后者为10~30 μL/mL。由此可知,体外酵解提高了IGs 对细胞活力的促进效果,且IGs 酵解液效果比空白对照组更优。
各24 h 组在更高浓度(例如BG 酵解液30~100 μL/mL)作用时,其细胞活力均呈现下降趋势。这些变化可能是由于24 h 酵解液中含有大量的SCFAs 和多糖碎片,且这些代谢物在各组中的含量有所差异,在低添加量时显著促进细胞的增殖活性,而提高酵解液添加量时,SCFAs 含量增大、pH 值过低而抑制了RAW 264.7巨噬细胞的正常生长[20]。
2.4 IGs 酵解液对RAW 264.7巨噬细胞释放NO 的影响
NO 的产生是巨噬细胞受到刺激活化的重要特征之一,与细胞的炎症反应紧密相关[21]。通过对0 h 和24 h 各IGs 酵解液组的细胞NO 释放量进行测定,分析各组IGs 在不同添加量下对细胞炎症反应的影响,结果如图4所示。



图4 IGs 酵解液对RAW 264.7巨噬细胞释放NO 的影响Fig.4 Effect of IG fermentation broths on NO release from RAW 264.7 macrophages
由图4 可知,与正常组相比,酵解0 h 的各组与酵解24 h 的空白对照组在各剂量下对NO 释放量均无显著影响,而24 h 的IGs 酵解液剂量为0.3~100 μL/mL时不同程度地促进了NO 的释放,表明IGs 在酵解24 h后能促进巨噬细胞的炎症反应。其中,对于酵解24 h的IGs 酵解液,BG 组在3~30 μL/mL,R 组和L 组在1~10 μL/mL,BY、PAC 组在10~100 μL/mL 时、Lit 组在3~100 μL/mL,作用效果较强,且显著高于正常组(P<0.05)。
与细胞活力测定结果相似,当剂量进一步提高时,各IGs 酵解24 h 组NO 释放量开始不同程度地下降,这可能是高浓度发酵液的pH 值过低,导致细胞生长紊乱。另外,根据对RAW 264.7巨噬细胞活力和NO 释放量的测定,确定了后续试验所用24 h IG 酵解液的低、中、高剂量分别为1、10、100 μL/mL,并按照此浓度进行其他指标测定。
2.5 IGs 酵解液对RAW 264.7巨噬细胞ROS 生成的影响
ROS 是需氧细胞在生长过程中氧化反应的一类代谢产物,同时是重要的信号分子,参与维持细胞正常的生理机能[22]。本研究使用流式细胞术进行测定分析,DCFH-DA 荧光探针被细胞内ROS 氧化为DCF,产生绿色荧光,DCF 荧光强度越强,则细胞内ROS 含量越高。IGs 酵解液对RAW 264.7巨噬细胞ROS 生成的影响如图5所示。
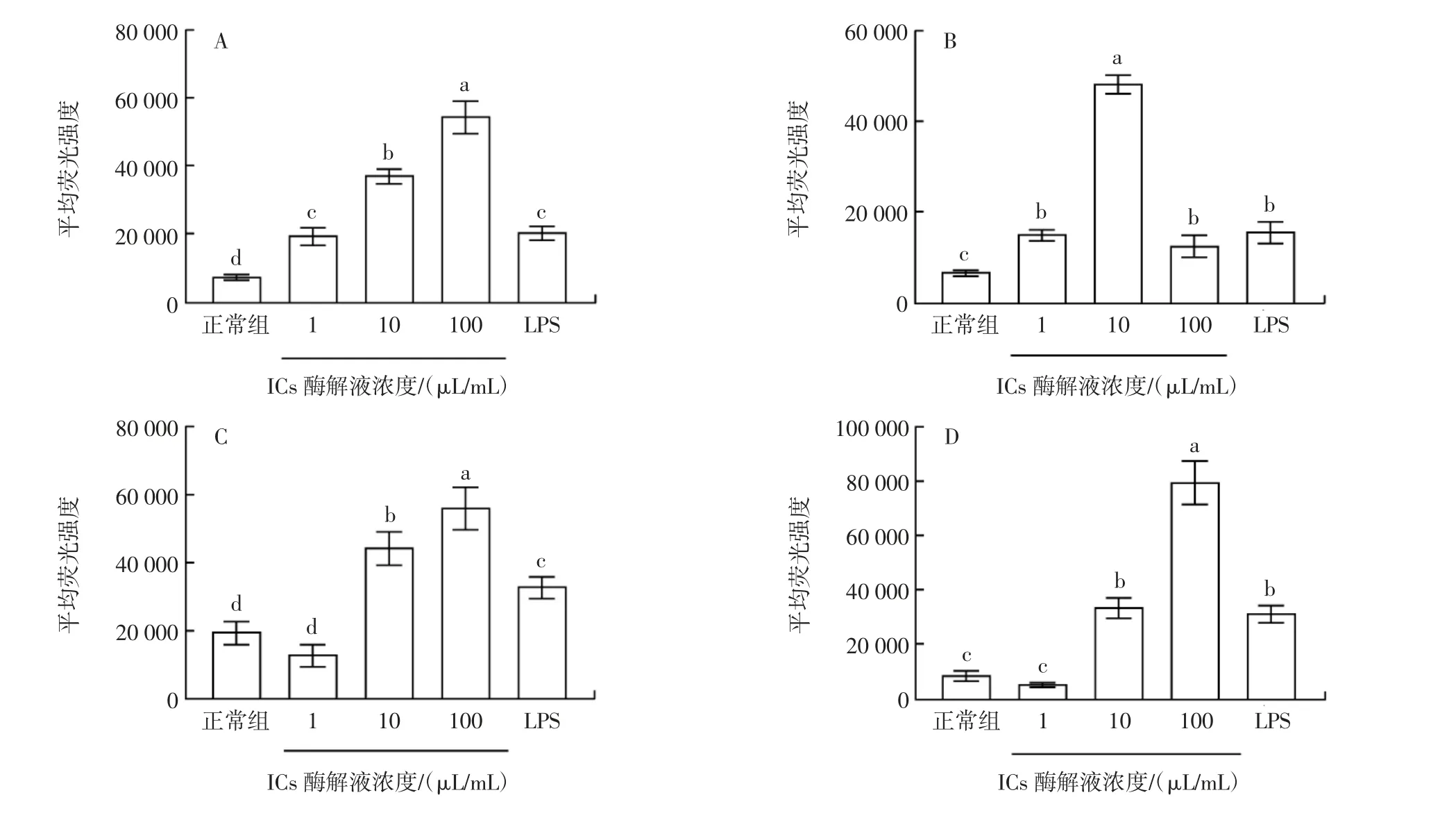

图5 IGs 的24 h 酵解液对RAW 264.7巨噬细胞ROS 生成的影响Fig.5 Effect of 24 h fermentation broths of IGs on ROS production from RAW 264.7 macrophages
图5 表明,相比于正常组,BG、R、Lit 和L 组的各浓度均能够显著性地促进细胞ROS 的产生(P<0.05),且前三者呈浓度依赖性增加,而L 酵解液剂量为10 μL/mL时ROS 的产量最高。BY 和PAC 酵解液剂量为10、100 μL/mL 时,能够显著性地促进细胞ROS 的产生(P<0.05),且在100 μL/mL 时,PAC 组的ROS 产量远高于其余IGs 组。表明各组IGs 酵解液均具有刺激细胞生成ROS 的能力,其能力的差异可能与酵解产物的组成有关。
2.6 IGs 酵解液对RAW 264.7巨噬细胞释放TNF-α的影响
细胞因子是机体细胞和体液免疫反应过程中重要的信号分子,巨噬细胞被激活后能够产生大量的细胞因子,如γ 干扰素(interferon-γ,IFN-γ)、白介素-4(interleukin,IL-4)、肿瘤坏死因子(tumor necrosis factor,TNF)和白介素-10(interleukin-10,IL-10)等,参与免疫功能的调控[23]。TNF-α 是机体重要的炎症介质,由巨噬细胞和淋巴细胞分泌,参与人体的炎症反应和免疫反应。IGs 酵解液对RAW 264.7巨噬细胞释放TNFα 的影响如图6所示。


图6 IGs 的24 h 酵解液对RAW 264.7巨噬细胞释放TNF-α 的影响Fig.6 Effect of 24 h fermentation broths of IGs on TNF-α release from RAW 264.7 macrophages
由图6 可知,与正常组相比,除100 μL/mL 的BY酵解液对TNF-α 没有显著影响外,各IG 酵解液在各浓度均显著性地提高了TNF-α 释放量(P<0.05)。表明各IG 酵解液均能显著性地激活巨噬细胞,使其TNFα 的分泌量提高。
2.7 酵解液中内毒素的影响分析
PMB 是一种s能与LPS 特异性结合的抗生素,使LPS 不能诱导巨噬细胞活化为M 1 型,抑制LPS 对巨噬细胞的促炎作用[24]。IGs 的肠道菌体外发酵液上清中可能含有细菌LPS,在本试验中以BG 酵解液为例,使用PMB 预处理来排除酵解液中LPS 的作用。已知1 μg/mL 的LPS 和1 μL/mL 的BG 酵解液给药处理对巨噬细胞TNF-α 分泌的作用效果相似,对LPS 和BG酵解液组同时进行PMB 预处理,结果如图7所示。

图7 PMB 预处理对巨噬细胞TNF-α 释放量的影响Fig.7 Effect of PMB pretreatment on TNF-α release from macrophages
由图7 可知,经PMB 处理后,LPS 组的TNF-α 释放量显著性下降(P<0.05),而BG 组变化不显著,表明IGs 的24 h 酵解液促进RAW 264.7巨噬细胞炎症反应表达的主要成分是其他酵解产物而不是来自肠道菌裂解的LPS。
3 结论
以RAW 264.7巨噬细胞为研究对象,分析IGs 体外肠道菌酵解液的免疫调节作用。结果表明,6 种IGs对细胞没有毒性作用,在肠道菌的酵解过程中产生了大量的SCFAs。IGs 的24 h 发酵液都显著提高了细胞免疫调节活性,能够提高RAW 264.7巨噬细胞的细胞活力,促进细胞NO 的释放、ROS 的产生和TNF-α 的分泌。此外,PMB 的处理结果表明,IGs 的酵解产物而不是肠道菌结构成分LPS 促进了巨噬细胞的TNF-α 的分泌。本研究为IGs 在肠道酵解的免疫调节研究提供理论参考,同时为IGs 的相关产品的开发提供依据。
