磁共振弥散加权成像对克罗恩病继发肠道狭窄的性质判定
2015-05-07朱建国张发明何雯雯韩晖云
朱建国,张发明,刘 斐,何雯雯,田 俊,韩晖云
0 引 言
克罗恩病(Crohn's disease,CD)是一种不明原因的慢性、反复发作的消化道炎性病变,多见于青少年,跳跃性分布是该病的特征。临床可继发多种并发症,以肠道狭窄最为常见[1]。研究表明,病程10 年以上的CD 患者,1/3 会发生肠道狭窄,狭窄早期以炎性为主,后期向纤维性转化[2]。对于炎性狭窄,临床上可通过药物治疗,对于纤维性肠道狭窄只能采取手术方式,因此狭窄性质的判断至关重要[3]。肠镜检查是最常见的检查方法,但狭窄严重时,有继发穿孔的风险。磁共振检查因其无创、无辐射优势,逐步应用于CD研究。磁共振弥散加权成像(diffusion-weighted imaging,DWI)基于水分子的布朗运动,无需注入对比剂,即可得到细胞构成、细胞膜完整性等分子水平的信息,通过测量表面扩散系数(apparent diffusion coefficient,ADC)还能得到定量参数[4-5]。目前临床上已将DWI 用于肝纤维化的分级研究[6]。据此推测,因炎性组织和纤维组织含水量的不同,理论上DWI也能用于鉴别CD 继发肠道狭窄的性质。本研究采用回顾性分析方法,通过应用DWI 测量ADC 值,探讨DWI 对CD 继发肠道狭窄的判别作用。
1 资料与方法
1.1 一般资料与方案设计 收集2014 年1 月至同年6 月经我院肠镜检查和病理诊断为CD 的31 例患者,其中男18 例、女13 例,年龄21 ~71 岁,平均(38.90±13.65)岁。排除磁共振检查禁忌者。本研究得到医院伦理委员会批准,所有病例检查前均签署知情同意书。患者接受常规磁共振扫描,确定肠管狭窄最显著位置(肠腔狭窄判断标准:与邻近肠腔相比,狭窄程度>80%,且肠壁厚度>3 mm),并划分成6 个区域:末端回肠、盲肠、升结肠、横结肠、降结肠、直乙状结肠(为便于和结肠镜结果对照,小肠肠管病变和肛周病变不纳入本研究);在选定的狭窄肠段行DWI 序列扫描,2 位从事腹部影像诊断10 年以上放射科医师分别测量病变肠壁的ADC 值(感兴趣区域范围:12 ~30 mm2),取2 人的均值作为病变段肠壁的ADC 值。
所有患者在24 h 内接受结肠镜检查,并在DWI扫描的肠段取病理活检(定位时参照骨性标志,如腰椎、髂骨等)。根据病理学结果,将狭窄肠段分为炎性狭窄组和纤维性狭窄组(如病理学检查同时有炎性和纤维性改变,则将该病例剔除)。
1.2 磁共振扫描参数 磁共振检查使用GE 公司3.0T 磁共振扫描仪(Signa HDxt)及配套的腹盆腔线圈(8 通道)。患者磁共振检查前6 h 禁食,检查前1 h 口服2.5%的甘露醇溶液1500 mL(每10 min 300 mL)以充盈肠道,检查开始前3 min,静脉注射山莨菪碱20 mg 抑制肠蠕动。
常规序列扫描参数:冠状位T2 加权单次激发快速自旋回波序列(层厚/间距=5 mm/1 mm;TR/TE=2800/70;屏气),轴位T2 加权快速自旋回波脂肪抑制序列(层厚/间距=4 mm/2 mm;TR/TE=12000/90;呼吸触发),轴位T1 加权三维容积超快速扫描序列(层厚/间距=4 mm/0 mm;TR/TE=4.5/1.7;屏气),增强扫描轴位T1 加权三维容积超快速多期动态序列(层厚/间距=4 mm/0 mm;TR/TE=4.5/1.7;屏气)。对比剂:马根维显,剂量0.1 mmol/kg,速率2 mL/s。DWI序列参数:轴位,层厚/间距=4 mm/0 mm,TR/TE=6000/最小,矩阵=128×128,视野=40 cm,b 值=0.600 s/mm2,激励次数=6。
1.3 统计学分析 采用SPSS 19.0 软件进行数据分析。数据以均数±标准差形式表示。首先应用Bland-Altman 一致性分析评价2 位放射科医师测量数据的一致性。采用单样本Kolmogorov-Smirnov 检验检查31 个病变肠壁ADC 值正态性。根据ADC 值绘制受试者操作特征曲线(receiver-operating characteristic curve,ROC)。以P≤0.05 为差异有统计学意义。
2 结 果
本研究共纳入31 段病变肠管。依据病理结果,将31 段肠管分为炎性狭窄组21 段,纤维性狭窄组10 段。见表1,图1、图2。

表1 各组克罗恩病患者狭窄肠管位置分布情况(n)Table 1 The position and number of bowel stenosis in group of inflammatory/fibrotic groups(n)
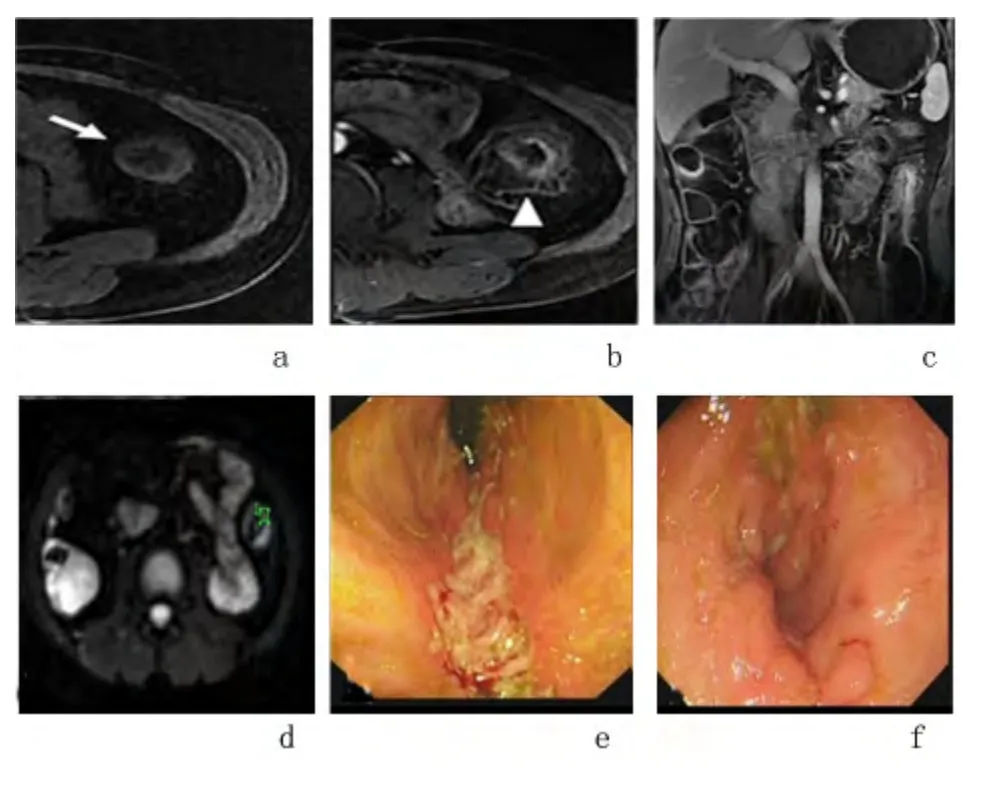
图1 典型CD 患者肠道炎性狭窄常规MRI 平扫图Figure 1 Conventional MRI scanning of typical infammatory bowel stenosis
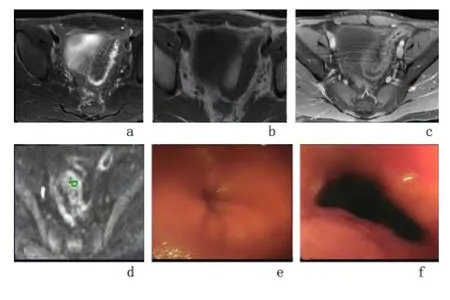
图2 典型CD 患者肠道纤维性狭窄常规MRI 平扫图Figure 2 Conventional MRI scanning of typical fibrotic bowel stenosis
ADC 值一致性检验结果显示见图3。Bland-Altman 分析显示3.23%(1/31)的点在95%一致性界定以外,在一致性界定范围内2 位医生测量的ADC 值差值的绝对值最大为0.140×103mm2/s,最小为0.018×103mm2/s,证实测量数据的可靠性。Kolmogorov-Smirnov 检验,Z=0.605、P=0.857,示31 例数据符合正态分布。炎性狭窄组肠壁ADC 值(1.40±0.23)×103mm2/s[(1.01 ~1.83)×103mm2/s],纤维性狭窄组(0.80±0.16)×103mm2/s[(0.53 ~1.03)×103mm2/s],组间比较差异有统计学意义(t=7.403,P <0.05)。ROC 曲线下面积为0.981(95%CI 0.943 ~1.000),以1.11×103mm2/s作为截断点,对炎性狭窄判断的敏感性和特异性分别为90.5%和100%,见图4。
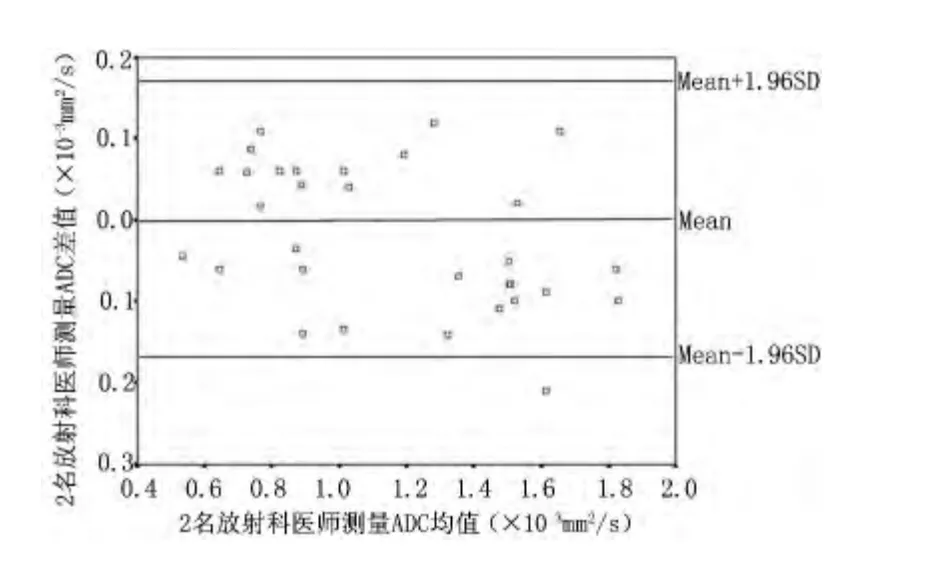
图3 2 位医师测量ADC 值Bland-Altman 一致性检验图Figure 3 Bland-Altman Plot picture of ADC measurement by two doctors

图4 31 例CD 患者ADC 值受试者工作特征曲线Figure 4 Receiver operating charmteristic curve of 31 CD patients'ADC value
3 讨 论
CD 患者继发肠道狭窄时,对狭窄性质的判定决定临床治疗方案。常规磁共振根据T2 信号强度、病变肠壁强化程度与方式、病变肠管周围肠系膜情况等也能提供鉴别诊断信息,但这些信息均缺乏定量参数[7-11]。既往研究中,已有学者采用DWI 序列获得定量参数来研究炎性肠壁。Oto 等[12]通过测量11 例患者病变肠管ADC 值来判断炎性病变的程度,认为相对正常肠管,病变肠管的信号会增高、ADC 值下降。Kiryu 等[13]认为病变活动期时,肠管的ADC 值会下降。Neubauer 等[14]指出肠壁的厚度和ADC 值之间存在明确相关性。本研究通过测量ADC 值得到定量指标来鉴别狭窄性质,尚鲜有报道。
相对正常肠壁,炎性病变肠壁DWI 信号增高,ADC 值下降,造成这一表现的原因尚不明确。可能存在的病理机制为细胞水肿和细胞密集导致细胞外间隙减小。而引起细胞肿胀的原因则包括:细胞构成的改变、微小脓肿形成、灌注增加。引起细胞密度改变的原因则是黏膜层和黏膜下层集合淋巴结细胞、膨胀扩大的淋巴管、过渡增殖的神经元和炎性反应形成的肉芽组织。
CD 后期肠壁纤维化不可避免会伴发肠道梗阻[15]。纤维化会累及整个肠壁,包括黏膜层、黏膜下层、肌层和浆膜层。慢性炎症刺激成肌纤维细胞,导致细胞外基质蛋白沉积,最终形成肠壁纤维化[16]。因此胶原纤维和成肌纤维细胞被认为是导致肠壁纤维化的关键因素[10,17-18]。纤维化造成DWI 信号和ADC 值变化的原因尚不明确。既往研究发现,肝硬化时ADC 值较正常肝下降[19-20],造成这一现象的原因可能是结缔组织增生、血窦变窄、肝血流减少[21]。故认为同样机制也能解释肠壁纤维化导致水分子弥散功能的改变。
Yi 等[22]研究认为,慢性肝炎不伴发纤维化时肝的ADC 值较伴发纤维化增高。Li 等[23]的研究表明,肝纤维化程度越重,弥散成像测得的ADC 值越低。在本研究中,CD 继发肠道纤维性狭窄时肠壁的ADC 值明显低于炎性狭窄。结合本研究结果与既往对肝纤维化的研究结论,认为纤维成份对水分子弥散功能的限制作用大于细胞炎性水肿,因此DWI序列能够有助于判定CD 继发肠道狭窄性质。
受限于回顾性研究方法和病例数有限,本研究存在一些不足:①因要参照结肠镜检查,故本研究只纳入了末端回肠和结肠,没有涉及到空肠和近端回肠;②不能完全排除测量ADC 值时产生的误差;③本研究中选取b 值=0.600 s/mm2,参数变化后结果如何有待进一步研究。总之,本研究证实了可使用DWI 序列通过测量ADC 值来判断CD 继发肠道狭窄性质,对指导临床治疗有一定实际意义。
[1] 徐晓帆,谢 颖,龚剑峰,等.18 例克罗恩病并发肠管膀胱瘘的诊疗分析[J].医学研究生学报,2013,26(12):1266-1268.
[2] Rodrigues C,Oliveira A,Santos L,et al.Biodegradable stent for the treatment of a colonic stricture in Crohn's disease[J].World J Gastrointest Endosc,2013,5(5):265-269.
[3] Bittencourt LK,Matos C,Coutinho AC.Diffusion-weighted magnetic resonance imaging in the upper abdomen:technical issues and clinical applications[J].Magn Reson Imaging Clin N Am,2011,19(1):111-131.
[4] Koh DM,Collins DJ.Diffusion-weighted MRI in the body:applications and challenges in oncology[J].Am J Roentgenol,2007,188(6):1622-1635.
[5] Kele PG,van der Jagt EJ.Diffusion weighted imaging in the liver[J].World J Gastroenterol,2010,16(13):1567-1576.
[6] Zimmermann EM,Al-Hawary MM.MRI of the small bowel in patients with Crohn's disease[J].Curr Opin Gastroenterol,2011,27(2):132-138.
[7] Fornasa F,Benassuti C,Benazzato L.Role of magnetic resonance enterography in differentiating between fibrotic and active inflammatory small bowel stenosis in patients with Crohn's disease[J].J Clin Imaging,2011,35(1):1-7.
[8] Kim AY.Role of computed tomography enterography/magnetic resonance enterography:is it in prime time?[J]Clin Endosc,2012,45(3):269-273.
[9] Nyree G,Lee AG,Simon A,et al.Small bowel MR enterography:problem solving in Crohn's disease[J].Insights Imaging,2012,3(4):251-263.
[10] Stasi C,Falchini M,Milani S.Imaging modalities for the noninvasive assessment of fibrosis in Crohn's disease[J].Scientific World J,2012,2012:450151.
[11] Dagia C,Ditchfield M,Kean M,et al.Imaging for Crohn disease:Use of 3-T MRI in a paediatric setting[J].J Med Imaging Radiat Oncol,2008,52(2):480-488.
[12] Oto A,Zhu F,Kulkarni K,et al.Evaluation of diffusion-weighted MR imaging for detection of bowel inflammation in patients with Crohn's disease[J].Acad Radiol,2009,16(5):597-603.
[13] Kiryu S,Dodanuki K,Takao H,et al.Free-breathing diffusionweighted imaging for the assessment of inflammatory activity in Crohn's disease[J].J Magn Reson Imaging,2009,29(6):880-886.
[14] Neubauer H,Pabst T,Dick A,et al.Small-bowel MRI in children and young adults with Crohn disease:retrospective head-tohead comparison of contrast-enhanced and diffusion-weighted MRI[J].Pediatr Radiol,2013,43(6):103-114.
[15] Michael SG,Mukesh GH.MRI in patients with inflammatory bowel disease[J].J Magn Reson Imaging,2011,33(2)527-534.
[16] Speca S,Giusti I,Rieder F,et al.Cellular and molecular mechanisms of intestinal fibrosis[J].World J Gastroenterol,2012,18(28):3635-3661.
[17] Latella G,Sferra R,Speca S,et al.Can we prevent,reduce or reverse intestinal fibrosis in IBD?[J]Eur Rev Med Pharmacol Sci,2013,17(10):1283-1304.
[18] Rieder F,Fiocchi C.Intestinal fibrosis in IBD a dynamic,mul tifactorial process[J].Nat Rev Gastroenterol Hepatol,2009,6(6):228-235.
[19] Annet L,Peeters F,Abarca-Quinones J,et al.Assessment of diffusion-weighted MR imaging in liver fibrosis[J].J Magn Reson Imaging,2007,25(1):122-128.
[20] Taouli B,Tolia AJ,Losada M,et al.Diffusion-weighted MRI for quantification of liver fibrosis:preliminary experience[J].Am J Roentgenol,2007,189(4):799-806.
[21] Kanematsu M,Goshima S,Watanabe H,et al.Diffusion/perfusion MR imaging of the liver:practice,challenges,and future[J].Magn Reson Med Sci,2012,11(3):151-161.
[22] Yi W,Daniel R.G,Josh L,et al.Assessment of chronic hepatitis and fibrosis:comparison of magnetic resonance elastography(MRE)and diffusion-weighted imaging(DWI)[J].Am J Roentgenol,2011,196(3):553-561.
[23] Li H,Chen TW,Chen XL,et al.Magnetic resonance-based total liver volume and magnetic resonance-diffusion weighted imaging for staging liver fibrosis in mini-pigs[J].World J Gastroenterol,2012,18(48):7225-7233.
