超声在监测兔酒精性脂肪肝模型建立中的应用
2015-05-07李鸿利汤跃跃李云燕陆永萍
李鸿利,韦 嘉,袁 媛,汤跃跃,李云燕,陆永萍
0 引 言
脂肪性肝病己成为仅次于病毒性肝炎的第二大肝病[1]。脂肪肝会逐渐发展为脂肪性肝炎、肝纤维化,肝硬化并可能引起肝细胞癌变恶性事件发生[2]。因此,早期发现和诊断脂肪肝病变及病变程度是判断病情、决定治疗方案的关键环节。肝组织活检是诊断肝纤维化和肝硬化的金标准[3],但该方法有创,对于肝病患者,尤其是脂肪肝患者,接受率低。超声可实时动态观察脂肪肝从正常肝直至脂肪性肝硬化的动态病变过程,还可准确发现脂肪肝出现变化的时间点,且可重复性好、灵敏度高[4-6]。复制出与人类脂肪肝发病机制相仿的动物模型,进行超声监测及病理对照,可更好地研究脂肪肝的发展进程,为及时干预、治疗提供实验室依据。本研究首先建立兔脂肪肝动物模型,用超声观察并行病理切片对照,监测兔脂肪肝发展情况,为深入研究脂肪肝肝纤维化发病机制提供动物模型。
1 材料与方法
1.1 模型制备 选取健康雄性日本大耳白兔,40只(昆明医科大学实验动物中心提供),体重1.00 ~1.52 kg,兔龄(17.01±1.54)d。实验动物合格证号:SCXK(滇)2011-0004。随机数字表法分为实验组和对照组,每组20 只,实验组50°乙醇(红星二锅头)强行灌胃,2 次/d,每次10 mL,常规饲料喂养,自由饮水。对照组常规饲料喂养,自由饮水。
1.2 超声观察 于喂养前,喂养12、16 和20 周共4次对兔脂肪肝程度进行观察。观察前所有兔禁食8 ~12 h,采用Aixplorer 型超声诊断仪(Supersonic Imagine公司,法国)ShearWaveTM实时剪切波弹性成像,L15-4 线阵探头,频率4 ~15 MHZ。将兔平躺固定于操作台上,右4 肋至腹部备皮,充分暴露检查区,行腹部及肝进行的超声观察,包括肝大小、回声、包膜情况,有无腹水等。对肝声像图征象进行详细记录。
按照脂肪肝的诊断标准将脂肪肝分为轻、中、重度:①轻度即肝内回声增强,但能显示肝内血管边界及膈肌;②中度即肝内回声中等度增强,肝内管道或膈肌显示轻度减弱;③重度即肝内回声明显增强,肝内管道、膈肌或肝右叶后部分显示差或不能显示[7]。
1.3 病理观察 20 周超声观察后处死动物,取出肝,称量肝湿重(liver weight,LW),观察肝大小、形态、颜色、表面光滑度、叶间裂宽度、边缘锐利度及切面情况[8]。同时留取10%甲醛固定标本肝组织标本,经常规脱水、透明、浸蜡、包埋、切片(片厚4 ~6 μm),分别进行HE 及苦味酸(天狼星红)染色。制备成病理切片,在显微镜下观察。脂肪肝病理分级诊断标准:正常,肝细胞脂肪变性<5%;轻度,肝细胞脂肪变性为5%~33%;中度,肝细胞脂肪变性为34%~66%;重度,肝细胞脂肪变性>66%[9-10]。肝纤维化分期:S0 期为无纤维化;S1 期为汇管区扩大伴纤维增生;S2 期为汇管区周围纤维化或纤维间隔形成,小叶结构保留;S3 期为肝纤维化伴小叶结构紊乱,未形成肝硬化;S4 期为重度纤维化或早期肝硬化[11]。
1.4 统计学分析 所有数据用SPSS 17.0 进行统计分析,计量资料用均数±标准差()表示,两组均数比较采用t 检验,相关采用Pearson 线性相关或Spearman 等级相关。以P≤0.05 为有统计学意义。
2 结 果
动物模型在制备饲养过程中,对照组分别在12及16 周各死亡1 只;实验组分别在12 周死亡2 只及16 周死亡1 只,死亡原因为灌胃时乙醇误吸入气管导致肺炎,以及乙醇中毒引起的中枢神经抑制或肝衰竭。
2.1 一般情况 对照组:兔皮毛光滑,活动灵活,进食量与排便正常,体重稳步逐增。实验组:兔皮毛渐粗糙失去光泽,兔灌胃后数10 min 内出现困倦,活动迟缓,部分酣睡,需2 ~3 h 后恢复,进食减少,粪便稀,体重下降。对照组兔龄与体重进行相关性分析,呈正相关(r=0.96,P <0.01);实验组兔龄与体重进行相关性分析,呈正相关(r=0.87,P <0.01)。大鼠兔龄与体重的关系见表1。
表1 各组兔龄与体重的关系Table 1 Age and body weight of the rabbits in the experimental and control groups at different times
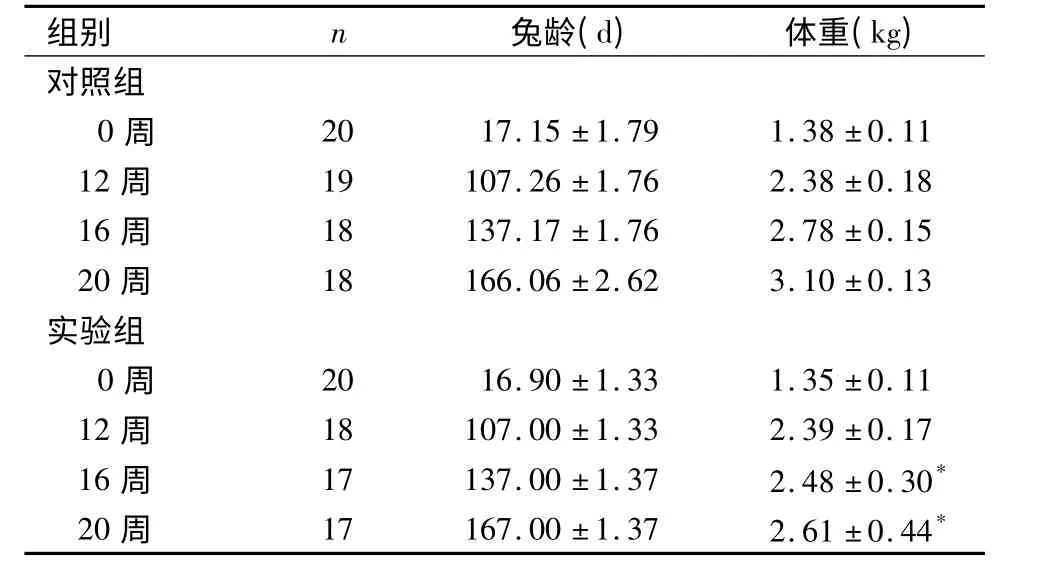
表1 各组兔龄与体重的关系Table 1 Age and body weight of the rabbits in the experimental and control groups at different times
与对照组同期比较,*P <0.05
组别 n 兔龄(d) 体重(kg)对照组0 周 20 17.15±1.79 1.38±0.11 12 周 19 107.26±1.76 2.38±0.18 16 周 18 137.17±1.76 2.78±0.15 20 周 18 166.06±2.62 3.10±0.13实验组0 周 20 16.90±1.33 1.35±0.11 12 周 18 107.00±1.33 2.39±0.17 16 周 17 137.00±1.37 2.48±0.30*20 周 17 167.00±1.37 2.61±0.44*
2.2 兔肝组织超声观察 超声评价2 组动物模型肝情况见表2。对照组20 只兔肝全部监测过程中,二维超声表现呈中等稍低回声,内部回声均匀,光点稍粗,管道结构清晰,管壁与实质对比回声稍强,包膜规则、光滑,无腹水。实验组12 周后均发生了不同程度的脂肪肝改变,随着喂饲期的增加,脂肪肝逐渐加重,早期以轻度脂肪肝为主,到20 周时以重度脂肪肝为主,同时6 例发生了腹水(肝肾间隙可见暗区1 ~3 cm),进入了肝硬化期。见图1。
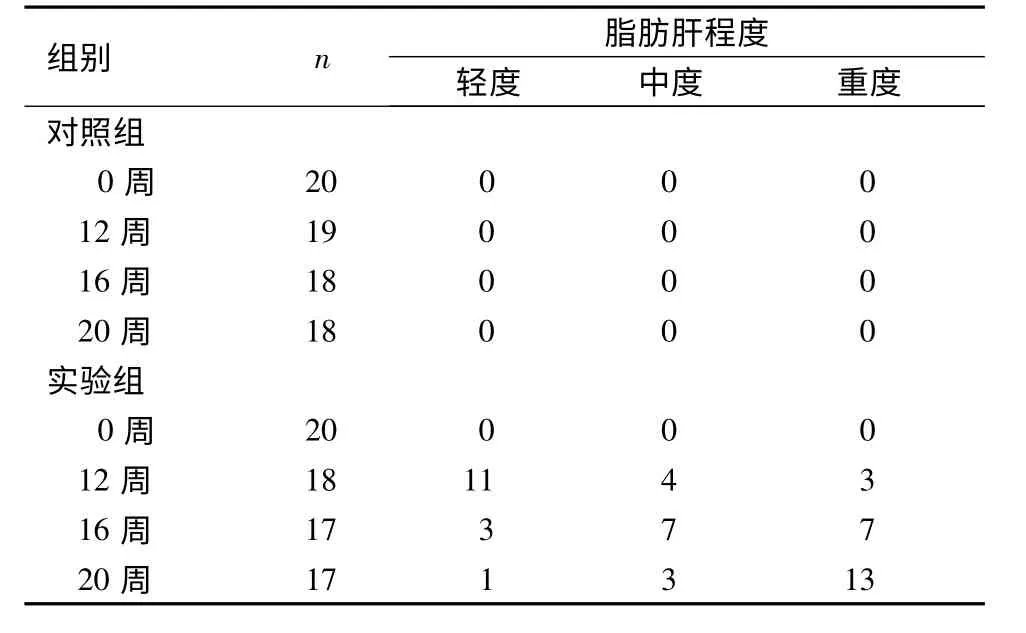
表2 兔脂肪肝程度与饲养周期的关系(n)Table 2 Severity of fatty liver in the experimental and control groups of rabbits at different times(n)
2.3 兔肝组织大体标本对照 20 周处死动物取出肝后观察兔肝的大体标本。对照组:肝被膜光滑,大小适中,肝外观呈暗红色,左叶明显大于右叶,叶间裂清晰,边缘锐,切面光滑;如触口唇,弹性好,质软细腻。实验组:大部分出现肝被膜不光滑,肝体积较小,肝左右叶比例减小,叶间裂变小,肝边缘变钝,颜色为土黄色,质地韧,如触额头,组织增粗。见图2。

图1 实验组兔不同程度脂肪肝的二维超声图像Figure 1 Two-dimension ultrasonography for the severity of alcoholic fatty liver in the experimental rabbits
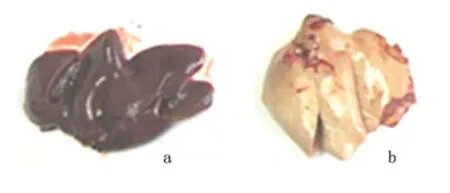
图2 兔肝组织大体标本Figure 2 Liver specimens of the experimental and control rabbits
2.4 HE 染色分析脂肪变面积 对照组:以小叶中央静脉为中心呈放射状排列,肝小叶轮廓清晰,肝细胞呈多边形,脂肪细胞量<10%,细胞分界清,核圆,位于细胞中央,细胞质丰富,呈嗜碱性。实验组:肝细胞排列十分紊乱,肝细胞胞体肿大呈球形,脂肪变面积60%~85%,细胞质明显减少,细胞核固缩,被脂肪滴挤压偏位,均可见有散在和局灶性炎性细胞浸润。见图3。病理结果显示对照组均未出现脂肪肝,实验组中轻度脂肪肝1 只、中度脂肪肝4 只、重度脂肪肝12 只,与超声对兔脂肪肝的分级基本一致。见表3。
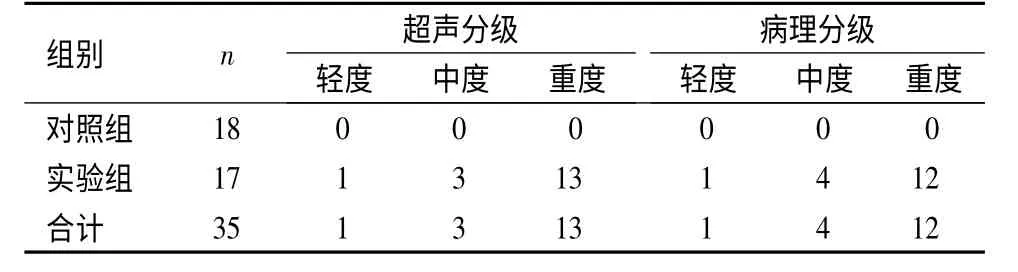
表3 兔脂肪肝的超声分级与病理分级的关系(n)Table 3 Ultrasound and pathological grading of fatty liver in the experimental and control rabbits at 20 weeks(n)
2.5 苦味酸-天狼星红染色分析纤维化程度 对照组:未见明显的纤维化。实验组:出现不同程度的纤维化表现,实验组5 只为S1-S2 期,表现汇管区扩大伴纤维增生或纤维间隔形成,小叶结构保留,余12只均为S3-S4 期表现,可见到大量纤维间隔形成,小叶结构紊乱并分隔破坏肝小叶、汇管区炎症明显。见图3。
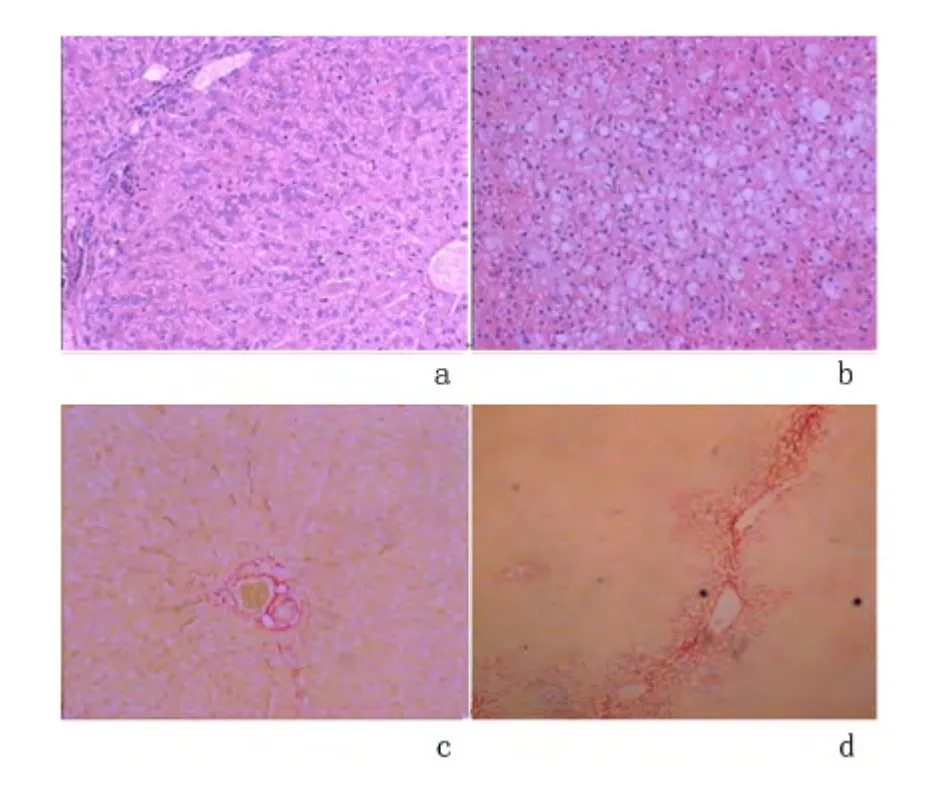
图3 兔肝组织HE 染色及天狼星红染色镜下比较(×200)Figure 3 HE and Sirius red staining of the liver tissues from the experimental and control rabbits(×200)
3 讨 论
随着人们生活水平的提高以及生活方式和饮食结构的改变,饮酒人数和饮酒量不断增多,导致酒精性肝纤维化及肝硬化发病率逐年增加,成为危害国民健康的重要因素[12-13]。研究表明平均每年约有12%的酒精性脂肪肝患者转变成肝硬化[14],随着对脂肪肝机制的深入认识,动物模型的建立也成为了关键,制备完善、标准的动物模型是研究疾病的基础。从造模的成功性、稳定性、简便性及经济性方面考虑,既往多选用大鼠;但家兔的肝大小适中,更适合于使用常规临床设备行影像学研究[15],兔与人类饮酒所致的肝脂肪代谢相似,可更快地复制出人脂肪肝模型,且病死率低,因此本实验选用新西兰大耳兔造模。饮水中加入乙醇是最早的造模方法,但动物厌酒,主动摄食乙醇的量较低,且乙醇易于挥发,浓度随着放置时间的延长而减低,故造模成功率不高,本实验采用乙醇2 次/d 灌胃,不仅保证了兔每天的饮酒量一致,还保持了兔体内24 h 较稳定的乙醇浓度。因此,我们通过定量乙醇灌胃的方法制备酒精性脂肪肝兔模型。与对照组相比,实验组兔于12 周后均发生了不同程度的脂肪肝改变,且随着喂饲期的延长,脂肪肝逐渐加重,早期以轻度脂肪肝为主,到20 周时以重度脂肪肝,而对照组在整个实验过程中均未发生脂肪肝病变。本实验结果显示,乙醇灌胃的方法制备酒精性脂肪肝兔模型具有乙醇的摄入量容易控制,影响因素少,可控性强,重复性好,成功率高,造模时间短等优点。酒精性脂肪肝兔模型的建立为今后研究酒精性脂肪肝的发病机制以及药物治疗提供了良好的模型动物[16]。
目前临床上公认的脂肪肝诊断的金标准是肝穿刺病理学诊断,但由于其具有创伤性,很难作为临床和筛查的有效方法[17]。而体外超声具有无创伤、操作简便、可控性好等优点,可作为诊断和筛查酒精性脂肪肝的有效方法。本研究发现2 组兔经过预设饲养条件喂养12 周后,通过二维超声观察发现对照组兔肝超声显示无异常,实验组所有兔均发生了脂肪肝改变,12 周时二维超声观察后明确动物模型制备成功。随着饲养期的延长,二维超声监测全过程中对照组正常饮食饲养的兔肝 表现为正常肝声像。实验组二维超声表现为肝增大,回声增高,前方明显,后方部分衰减,光点细密,管道结构较对照组模糊。二维超声检查对兔脂肪肝的分级与病理分级基本一致,其中一列病理分级为中度脂肪肝,超声分级为重度脂肪肝,这可能与脂肪肝后期兔子的消化功能受损导致肠气干扰明显,以及腹水形成等影响超声检查有关。这也就说明,常规超声检查评价脂肪肝分级具有一定局限性,即易受到肠气、腹水等因素的影响,且具有一定主观性,因此评价脂肪肝程度还需引入相关检查手段。此外2 组兔龄和体重在实验前基本相当,但随着饲养期的延长,体重也出现了明显差异,可能是因为实验兔的生长发育受到了限制,与肝损伤有明显关系。
本实验通过酒精性脂肪肝兔模型来研究常规超声检查技术在动物脂肪肝诊断方面的应用,明确常规超声检查能判断脂肪肝兔模型建立是否成功,且常规超声检查能初步判断脂肪肝病变的程度,为进一步分析兔酒精性脂肪肝超声定量评价与肝脏病理形态学改变程度的相关性研究奠定了基础,但本实验观察例数较少,还需进一步扩大标本量加以研究。且动物模型试验是一种间接性研究,只能在局部或某方面与人类疾病相似,兔为食草动物,与人类代谢机制不同,故动物模型试验结论的正确性是相对的,最终还必须在人体上得到验证。
[1] Paschos P,Paletas K.Non alcoholic fatty liver disease and metabolic syndrome[J].Hippokratia,2009,13(1):9-19.
[2] Brunt EM.Nonalcohlic steatchepatitis[J].Semin Liver Dis,2004,24(1):3-20.
[3] 中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪肝性病诊疗指南[J].中华肝脏病杂志,2006,14(13):161-163.
[4] 康 伟,邱天爽.脂肪肝医学超声图像定量分析的研究[J].大连理工大学,2007,41(5):445.
[5] 段瑞红,张 旭,郑丽娟.脂肪肝的超声分度及生活习惯指导[J].中国伤残医学,2013,21(8):315-316.
[6] 杨丽莉,杨天宏,崔周敏,等.血脂康治疗脂肪肝的临床观察[J].临床荟萃,2003,18(6):341-342.
[7] 李治安.临床超声影像学[M].北京:人民卫生出版社,2003:924-925.
[8] 王 宇,郑锦锋.非酒精性脂肪肝营养干预的研究进展[J].医学研究生学报,2014,27(1):99-101.
[9] Brunt EM.Pathology of nonalcoholic fatty liver disease[J].Nat Rev Gastroenterol Hepatol,2010,7(4):195-203.
[10] Merat S,Khadem SF,Nouraie M,et al.A modification of the B runt system for scoring Iiver histology of patients with non-alcoholic fatty Iiver disease[J].Arch lran Med,2010,13(1):38-44.
[11] 曾 涛,张 丹,周 果.彩色多普勒超声在慢性肝炎肝纤维化分期诊断中的价值[J].中国医药指南,2013,11(4):324-329.
[12] 刘滨菘,李 强.脂肪及细胞因子与非酒精性脂肪性肝病关系的研究进展[J].医学研究生学报,2013,26(11):1211-1214.
[13] 张蔚韡,杜 兵,罗克文,等.健康体检中脂肪肝发病率及相关因素分析[J].临床医学,2008,28(5):15-16.
[14] Bugianesi E,BLeone N,Vanni E,et al.Expanding the natural history of nonalcoholic steatohepatitis:from cryptogenic cirrhosis to hepatocellular carcinoma[J].Gastroenterology,2002,123(1):134-140.
[15] 胡晓峰,刘 斌,刘可夫,等.家兔肝纤维化模型的建立及CT 灌注成像[J].医学影像学杂志,2008,18(1):25-29.
[16] 李晓娟,张大鸥,隋丽华,等.超声在评价大鼠酒精性脂肪肝模型中的应用[J].中国比较医学杂志,2013,23(4):19-23.
[17] Brunt EM.Pathology of nonalcoholic fatty liver disease[J].Nat Rev Gastroenterol Hepatol,2010,7(4):195-203.
