聚乙烯醇缩丁醛对三维联通纳米氧化锆骨组织工程支架压缩强度的影响
2015-05-07朱瑞乔朱迎兰史小蕾
朱瑞乔,马 娟,朱迎兰,史小蕾,董 震,金 磊
0 引 言
20 世纪90 年代美国学者Crane 等[1]首次系统阐述了骨组织工程的概念、研究方法及发展前景。骨组织工程原理包括支架材料、种子细胞和成骨因子3 个方面,研究理想的支架材料是目前骨组织工程研究的热点之一[2-6]。颌面部骨缺损的特殊性对支架外形、稳定性以及多形性的要求与四肢和躯干不同,不可吸收的组织工程支架在颌骨的应用占有了绝对的优势。氧化铝及氧化锆这类生物惰性材料机械性显著,能够满足承重骨的力学要求,虽不能在体内降解,但与组织相容性好,不会产生炎症,无异物反应,可在体内长期存在且不产生形变。氧化锆陶瓷是目前公认的最具发展前景的生物材料,在机械性能和生物相容性均表现出明显的优势,已成功用于制作口腔全瓷修复体、人工髋关节替代物以及骨组织工程支架[7-11]。
我们前期已经采用模板复制法制备出纳米多孔氧化锆支架,可较好地复制模板的外形,孔隙率控制在60%~90%,其具有良好的三维联通网络骨架结构,骨髓间充质干细胞可在其表面附着并表现出良好的生长繁殖能力[12-13]。但制作时水基浆料的稳定性及其与有机模板的润湿性较差,影响了支架的成型率,支架烧结塌坯现象问题明显;支架微观结构表面存在明显的微裂纹,压缩强度未达到理想水平。为了获得高质量的分散均匀的浆料,通常会在分散体系中加入一定量的分散剂,虽添加量不大,但可明显地改进多孔支架的物理性能,改善最终成型的支架质量[14]。在氧化锆浆料体系中,可加入聚乙烯醇[15]、磷酸三乙酯、聚乙烯醇缩丁醇[16]等作为分散剂和黏结剂。
本研究对聚乙烯醇缩丁醛(Polyvinyl butyral,PVB)作为分散剂的效果进行了研究评估,期望通过PVB 的添加增加氧化锆陶瓷浆料的稳定性,同时评估该浆料对研究成型的三维联通纳米氧化锆骨组织工程支架强度的影响。
1 材料与方法
1.1 材料与仪器 制作陶瓷浆料的粉料为纳米3Y-TZP(平均粒径40nm,TOSOH,日本)。分散剂为PVB(Aldrich,美国)。有机模板为聚氨酯软泡(60ppi,佛山冠德,中国)。
研究仪器主要有超声振荡器(VITASONICⅡ,VITA,德国),高温烧结炉(KSL-1700X,合肥科晶,中国),自动三重纯水蒸馏器(SZ-97A,上海亚荣,中国),数码相机(IXUS801S,Canon,日本),扫描电子显微镜(XL30,Philips,荷兰),万能试验机(3365,INSTRON,美国)。
1.2 实验方法 用10 g 溶剂(95%乙醇与去离子水质量比1∶1)分别配制5wt%纳米氧化锆悬浮液,加入不等量(0 ~0.3wt%)PVB,超声分散1 h 并不断搅拌。将各组悬浮液分别倒入10 mL 离心管内,静置1 周观察其稳定分散效果。
用于浸渍成型的氧化锆浆料含量为60wt%,支架的制备方法采用课题组的成型方法[12]。制备好的支架用万能实验机测定其压缩强度,扫描电镜(SEM)观察其孔隙结构及支架表面形貌。
1.3 统计学分析 采用SPSS 13.0 软件进行统计分析,定量结果以均数±标准差表示,组间比较采用单因素方差分析(One-Way Anova),组内两两比较采用Bonferroni 校正方法。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 PVB 的加入量对纳米3Y-TZP 粉末分散效果的影响 实验开始时乙醇基浆料及水基浆料分层明显,上层为上清液,下层为白色沉淀,而添加了不同含量PVB 的氧化锆乙醇水基浆料分层均不明显,上层为白色的浑浊液,下层见白色沉淀,上下层分层不明显,白色浑浊液明暗度不同。0.2wt% PVB 试管中可见白色浑浊液与底层的白色沉淀无明显分界,显示其分散效果好。见图1。

图1 沉降实验结果图Figure 1 Results of sedimentation experiment
2.2 不同PVB 含量的纳米氧化锆浆料制作的支架压缩强度对比 不同PVB 含量的纳米氧化锆浆料压缩强度研究结果见图2。其中0.2wt%PVB 浆料制作的支架压缩强度为(0.324±0.030)MPa,明显高于其他浓度PVB 浆料,差异有统计学意义(P <0.01)。原有的去离子水浆料的支架压缩强度[(0.109±0.021)MPa]明显低于其他浓度PVB 浆料,差异有统计学意义(P <0.05)。不同浓度PVB(除0.2wt%以外)浆料支架压缩强度差异无统计学意义(P >0.05)。
2.3 不同PVB 含量的纳米氧化锆浆料制作的支架扫描电镜观察 经过烧结,除去模板后支架基本复制了原有的模板结构,呈现了一个孔洞相互连通,三维贯通的网络结构,孔隙率高,孔径较大,分布均匀,基本无阻塞,与松质骨结构极为相似。添加了PVB的浆料制作的支架烧结后表面存在的模板复制法制作支架与水基浆料支架相比,结构破坏(裂纹,断裂,孔洞)明显减少,孔梁断裂消失。而0.2%PVB支架展现出了一个相对完好的结构,表面的裂纹数量及分布面积较小,孔梁较为完整,结构破坏最少见图3。
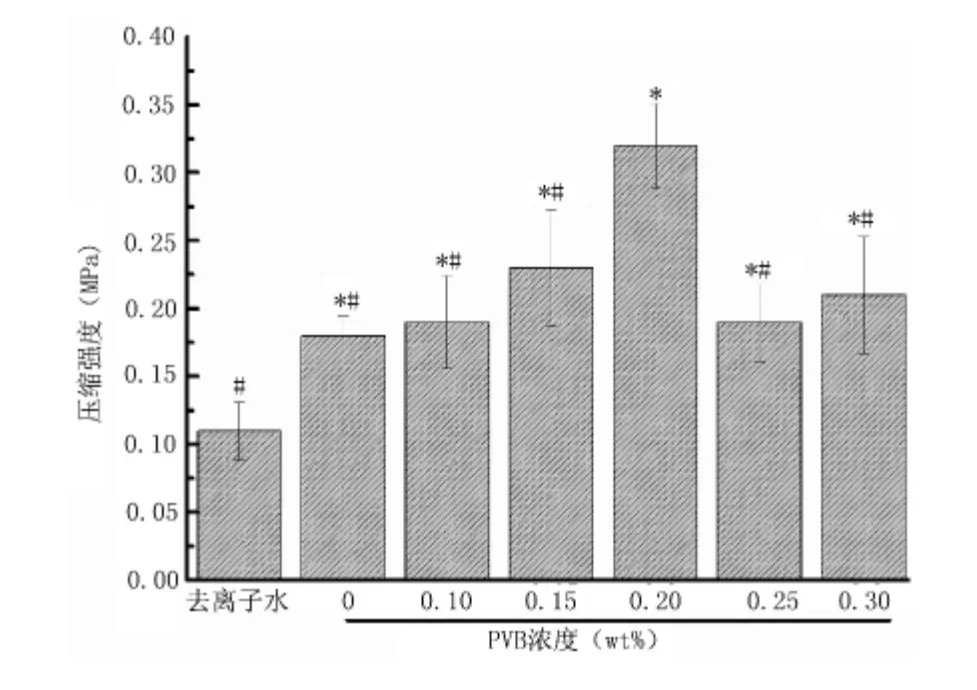
图2 不同浆料制作的氧化锆支架压缩强度对比Figure 2 Compressive strength of the scaffolds prepared with different slurries
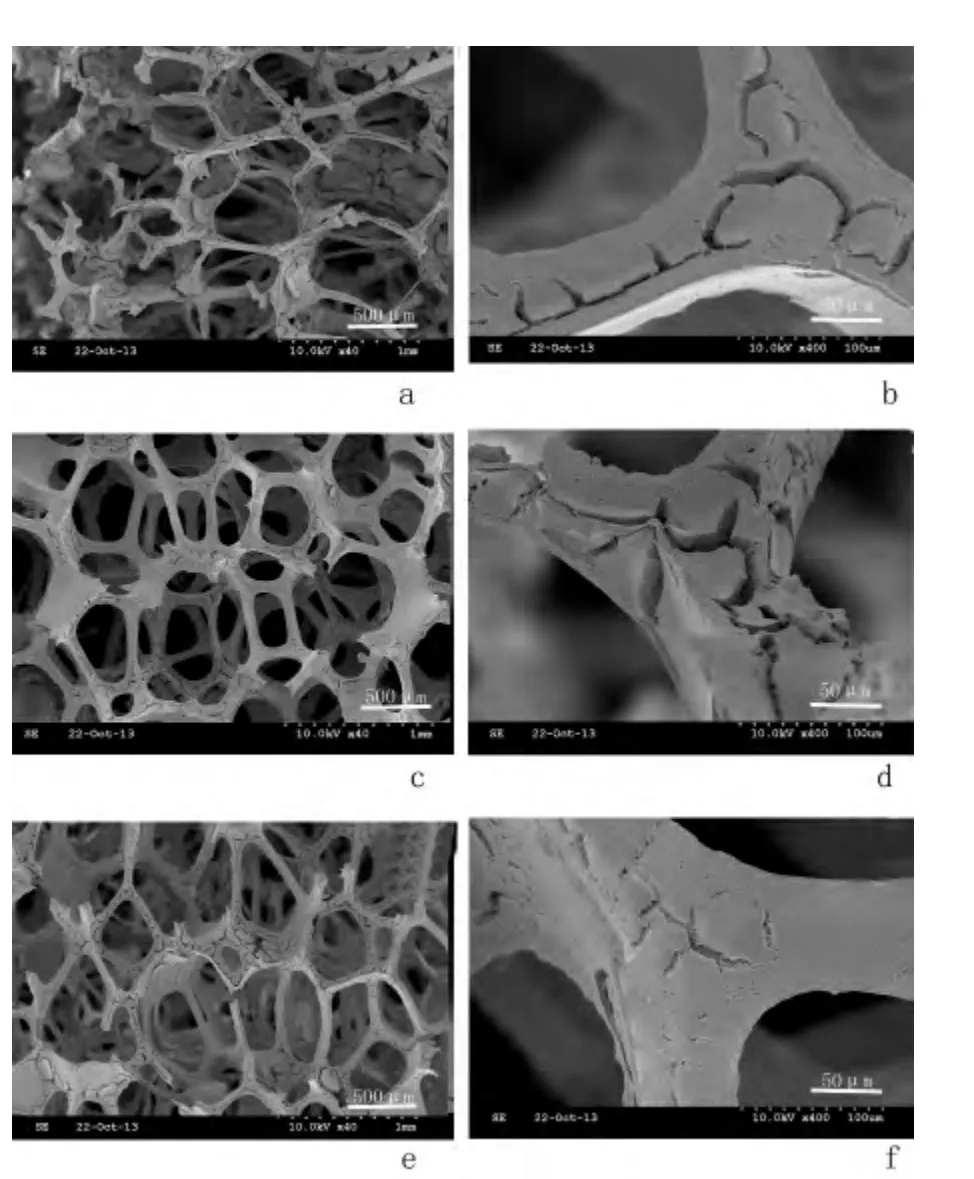
图3 不同PVB 含量的纳米3Y-TZP 浆料制作的支架表面形貌观察结果Figure 3 Morphologies of the porous zirconia scaffolds fabricated using the slurries with or without
3 讨 论
众多学者们一直在研究骨组织缺损的修复和再生,研究内容包括不同材料不同成型方法以及细胞的附着等[11,15,17-19]。氧化锆陶瓷独特的应力诱导相变增韧机制使其具有较高的机械强度,生物惰性材料的特性使其具有很好的生物相容性,使其可以与其他生物材料混合或单独作为生物材料应用于骨组织工程研究[7,9,20,21]。
制备多孔氧化锆支架的方法多种多样,其中文中采用的模板制作法最为简单便捷,无需复杂的设备,制作成本低。但本课题组初期制作的支架压缩强度及初次成型率均未达到理想水平。回顾文献我们可知,模板复制法中浆料的制备是重要的生产环节之一,高性能的浆料不仅有利于成型,而且对保证制品的性能起重要作用[14,22-23]。为获得高性能的浆料,可在浆料分散体系中加入分散剂、黏结剂以及消泡剂等。PVB 作为众所周知的分散剂和黏结剂,因此我们选用了其加入我们的浆料体系中[7]。
PVB 不溶于去离子水,易溶于酒精。而为了有效改善有机泡沫体与氧化锆浆料之间的润湿性和黏附性,浆料基体中应加入定量的95%乙醇[24]。因此,我们在曾用的水基分散体系中加入了95%乙醇。沉降实验的结果证明选用PVB 作为分散剂对浆料性稳定性有明显改善作用。PVB 的分子链上有很多-OH,可以有效的吸附在纳米氧化锆晶体表面,阻止了晶体团聚现象的发生;PVB 作为大分子聚合物,在氧化锆粉体之间形成的位阻层具有一定的厚度,因此PVB 的添加能有效的改善纳米氧化锆陶瓷浆料的稳定性。在实验过程中,我们可发现浆料的配制时间可缩短至8 ~12 h,较以往采用去离子水作为溶剂时的48 ~72 h 的配制时间明显减少,说明PVB 作为分散剂作用明显。但沉降实验关于PVB 添加量的肉眼判定结果并不十分明确,因此我们配制不同含量的浆料并制作支架,根据压缩强度和SEM 进一步评估PVB 的适宜含量。
压缩强度结果显示添加了PVB 后,支架的强度明显增高,其中以添加含量为0.2%时强度提高最为明显,且SEM 结果同时显示此组支架的表面破坏(裂纹、断裂、孔洞)最少。模板复制法在泡沫体烧结过程中不可避免的会出现裂纹,当受到外力作用时,裂纹处产生应力集中,裂纹迅速延伸扩展,使支架整体结构受到破坏,因此理论上减少了支架的裂纹即可提高压缩强度。我们添加PVB 后,使浆料更稳定,能均匀地涂覆在泡沫体表面;并防止干燥烧结过程粉末过早分离海绵,且在分散和烧结过程中自身的形状基本不发生改变,不影响支架的成型;而溶剂的改变也使浆料与泡沫体的亲和性增加,提高了挂浆量;烧结过程中PVB 能防止烧结脱胶中支架过早塌陷,并减少裂纹和结构破坏的数量。因此,我们发现加入PVB 后能明显改善支架的压缩强度和表观形貌。但PVB 含量过少时,改善的效果不明显,所以含量较低的组压缩强度和表面形貌改善不明显;PVB 含量过高时,则增加了浆料的黏度,易造成模板表面浆料涂覆不均匀以及孔筋交汇处浆料堆积,烧结时PVB 的挥发也会破坏支架的微观形貌,最终使得支架表面的表面形貌破坏严重,影响了支架的压缩强度。因此实验结果显示0.2wt%PVB 浆料的性能最稳定,明显提高了支架的压缩强度,改善了支架的表面形貌。
[1] Crane GM,Ishaug SL,Mikos AG.Bone tissue engineering[J].Nat Med,1995,1(12):1322-1324.
[2] Jin GZ,Kim TH,Kim JH,et al.Bone tissue engineering of induced pluripotent stem cells cultured with macrochanneled polymer scaffold[J].J Biomed Mater Res A,2013,101(5):1283-1291.
[3] Fu Q,Saiz E,Rahaman MN,et al.Bioactive glass scaffolds for bone tissue engineering:state of the art and future perspectives[J].Mat Sci Eng C-mater,2011,31(7):1245-1256.
[4] Bose S,Roy M,Bandyopadhyay A.Recent advances in bone tissue engineering scaffolds[J].Trends Biotechnol,2012,30(10):546-554.
[5] 乔广艳.骨组织工程复合支架材料的研究进展[J].口腔颌面外科杂志,2010,20(5):374-378.
[6] Amini AR,Laurencin CT,Nukavarapu SP.Bone tissue engineering:recent advances and challenges[J].Crit Rev Biomed Eng,2012,40(5):363-408.
[7] An SH,Matsumoto T,Miyajima H,et al.Porous zirconia/hydroxyapatite scaffolds for bone reconstruction[J].Dent Mater,2012,28(12):1221-1231.
[8] Matsumoto TJ,An SH,Ishimoto T,et al.Zirconia-hydroxyapatite composite material with micro porous structure[J].Dent Mater,2011,27(11):e205-212.
[9] Kim HW,Shin SY,Kim HE,et al.Bone formation on the apatite-coated zirconia porous scaffolds within a rabbit calvarial defect[J].J Biomater Appl,2008,22(6):485-504.
[10] Kim DY,Kim M,Kim HE,et al.Formation of hydroxyapatite within porous TiO(2)layer by micro-arc oxidation coupled with electrophoretic deposition[J].Acta Biomater,2009,5(6):2196-2205.
[11] Kim HW,Kim HE,Knowles JC.Hard-tissue-engineered zirconia porous scaffolds with hydroxyapatite sol-gel and slurry coatings[J].J Biomed Mater Res B Appl Biomater,2004,70(2):270-277.
[12] 王 阳,金 磊,史小蕾,等.三维连通多孔氧化锆骨组织工程支架制备研究[J].医学研究生学报,2012,25(6):635-640.
[13] 朱迎兰,朱瑞乔,史小蕾,等.三维联通纳米氧化锆多孔支架对犬骨髓间充质干细胞附着生长的实验研究[J].医学研究生学报,2014,27(6):564-567.
[14] 朱新文,江东亮.有机泡沫浸渍工艺——一种经济实用的多孔陶瓷制备工艺[J].硅酸盐通报,2000,19(3):45-51.
[15] Chen QZ,Thompson ID,Boccaccini AR.45S5 Bioglass-derived glass-ceramic scaffolds for bone tissue engineering[J].Biomaterials,2006,27(11):2414-2425.
[16] Yoon BH,Koh YH,Kim HE.Processing and performance of hydroxyapatite/fluorapatite double layer coating on zirconia by the powder slurr Method[J].J Am Ceram Soc,2006,89(8),2466-2472.
[17] Yuan J,Cui L,Zhang WJ,et al.Repair of canine mandibular bone defects with bone marrow stromal cells and porous beta-tricalcium phosphate[J].Biomaterials,2007,28(6):1005-1013.
[18] Wu W,Chen X,Mao T,et al.Bone marrow-derived osteoblasts seeded into porous beta-tricalcium phosphate to repair segmental defect in canine's mandibula[J].Ulus Travma Acil Cerrahi Derg,2006,12(4):268-276.
[19] Tiainen H,Wiedmer D,Haugen HJ.Processing of highly porous TiO2bone scaffolds with improved compressive strength[J].J Eur Ceram Soc,2013,33(1):15-24.
[20] Kim HW,Knowles JC,Kim HE.Hydroxyapatite/poly(epsiloncaprolactone)composite coatings on hydroxyapatite porous bone scaffold for drug delivery[J].Biomaterials,2004,25(7-8):1279-1287.
[21] Malmstrom J,Adolfsson E,Emanuelsson L,et al.Bone ingrowth in zirconia and hydroxyapatite scaffolds with identical macroporosity[J].J Mater Sci Mater Med,2008,19(9):2983-2992.
[22] 罗民华,梁华银,宋树刚.泡沫陶瓷研制过程中影响因素的试验研究[J].陶瓷学报,2009,30(2):209-212.
[23] Zhu X,Jiang D,Tan S,et al.Improvement in the strut thickness of reticulated porous ceramics[J].J Am Ceram Soc,2001,84(7):1654-1656.
[24] 张爱娟,高增丽,王卫伟,等.有机泡沫浸渍法制备多孔羟基磷灰石生物支架的研究[J].山东大学学报(工学版),2012,42(3):105-109,114.
