含离子液体乙腈-正丙醇体系的等压汽液平衡
2015-04-01李文秀张琦张亲亲张志刚
李文秀,张琦,张亲亲,张志刚
(沈阳化工大学化学工程学院,辽宁省化工分离技术重点实验室,辽宁 沈阳 110142)
引言
乙腈是一种优良的溶剂,具有高溶解性、低沸点、低凝固点、低黏度以及低毒等优点[1-3],被广泛应用于石油、医药、合成纤维、照明、材料等工业。作为色谱中的流动相以及制药中的主要溶剂,乙腈常与正丙醇以混合物的形式大量出现于工厂废液中,直接排放不仅会造成环境的污染,而且会造成资源的浪费,因此对二者进行分离,实现它们的循环再利用是非常必要的。但是,常压下乙腈和正丙醇能够形成共沸物(共沸物系质组成:乙腈80%,正丙醇20%),普通精馏难以实现二者的分离。萃取精馏是化学工业中常用的分离方法,它可以有效地实现共沸物的分离,关键是选择合适的萃取剂。
离子液体是一种新型的绿色溶剂,相较于传统的有机溶剂与无机盐,离子液体具有如下优点:蒸气压极低、热稳定和化学稳定性高、电化学窗口宽、液程宽以及对有机溶剂和无机溶剂的良好溶解性等[4-6]。近些年来,离子液体越来越多地被用作萃取剂来实现共沸物系的分离[7-11],结果表明,离子液体作为萃取剂较传统有机溶剂及无机盐有着更大的优势。所以本实验选择离子液体作为萃取剂进行研究。目前,含离子液体三元体系的汽液相平衡数据已有很多,但未见含离子液体乙腈-正丙醇体系的等压汽液相平衡数据的报道。
本实验分别测定了常压下乙腈-正丙醇-氯化 1-苄基-3-甲基咪唑([BzMIM][Cl])、乙腈-正丙醇-溴化1-苄基-3-甲基咪唑([BzMIM][Br])以及乙腈-正丙醇-溴化 1-己基-3-甲基咪唑[HMIM][Br]三元体系的等压汽液相平衡数据,并通过NRTL模型方程对三组三元体系的汽液平衡数据进行了关联,得到了模型参数。同时,讨论了[BzMIM][Cl]、[BzMIM][Br]和 [HMIM][Br] 3种离子液体的分离效果,为工业上采用离子液体作为萃取剂分离乙腈-正丙醇体系提供了基础数据。
1 实验部分
1.1 实验试剂
3种离子液体购自上海成捷化学有限公司,纯度大于98%。实验中用到的其他药品均购自国药集团化学试剂有限公司,纯度大于99.5%。
1.2 实验装置及分析方法
采用天津大学北洋化工实验设备公司制造的CE-2常压汽液平衡数据测定仪[12]。实验方法如下:分别配制一定比例的乙腈、正丙醇和离子液体的混合溶液,将含有离子液体的乙腈和正丙醇溶液加入到平衡釜中进行加热,保持回流滴数在每分钟20~30滴,稳定3~4 h后,认为气液两相处于平衡状态,取样分析。
采用称重法测量液相中离子液体的含量。气液两相中乙腈和正丙醇的摩尔分数采用安捷伦GC7890A气相色谱仪进行定量分析,TCD检测器检测,载气为氢气,色谱柱为SP-7800。
2 结果与讨论
2.1 实验装置可靠性的检测
为了验证实验装置的可靠性,测定了乙腈-正丙醇二元体系的等压汽液平衡数据,并与文献值比较,结果如图1所示。由图1可知,乙腈-正丙醇二组分物系的等压汽液平衡数据与文献值[13]基本一致,说明实验装置可靠。

图1 在大气压(101.3 kPa)下乙腈(1)-正丙醇(2)体系的等压汽液平衡相图Fig.1 Isobaric vapor-liquid equilibria diagram for acetonitrile(1)-n-propanol (2) at atmospheric pressure (101.3 kPa)
2.2 汽液平衡数据的测定
在大气压(101.3 kPa)下,测定了乙腈-正丙醇-[BzMIM][Cl]、乙腈-正丙醇-[BzMIM][Br]以及乙腈-正丙醇-[HMIM][Br]三元体系的等压汽液平衡数据,其结果见表1~表3,其中,x3是液相中离子液体的摩尔分数,x1为液相中扣除离子液体后乙腈的摩尔分数,y1为气相中乙腈的摩尔分数,T为装置内的平衡温度,α12为乙腈对正丙醇的相对挥发度。
乙腈(1)对正丙醇(2)的相对挥发度可通过式(1)计算

2.3 数据关联
NRTL模型是由Renon等[14]提出的溶剂理论中的局部双液相模型。目前NRTL模型被广泛的用于含离子液体的三组分物系的汽液相平衡数据的关联[15-17],取得了良好的效果。因此,将本实验获得的汽液平衡数据用NRTL模型进行关联,计算相应的能量参数和非随机因素。
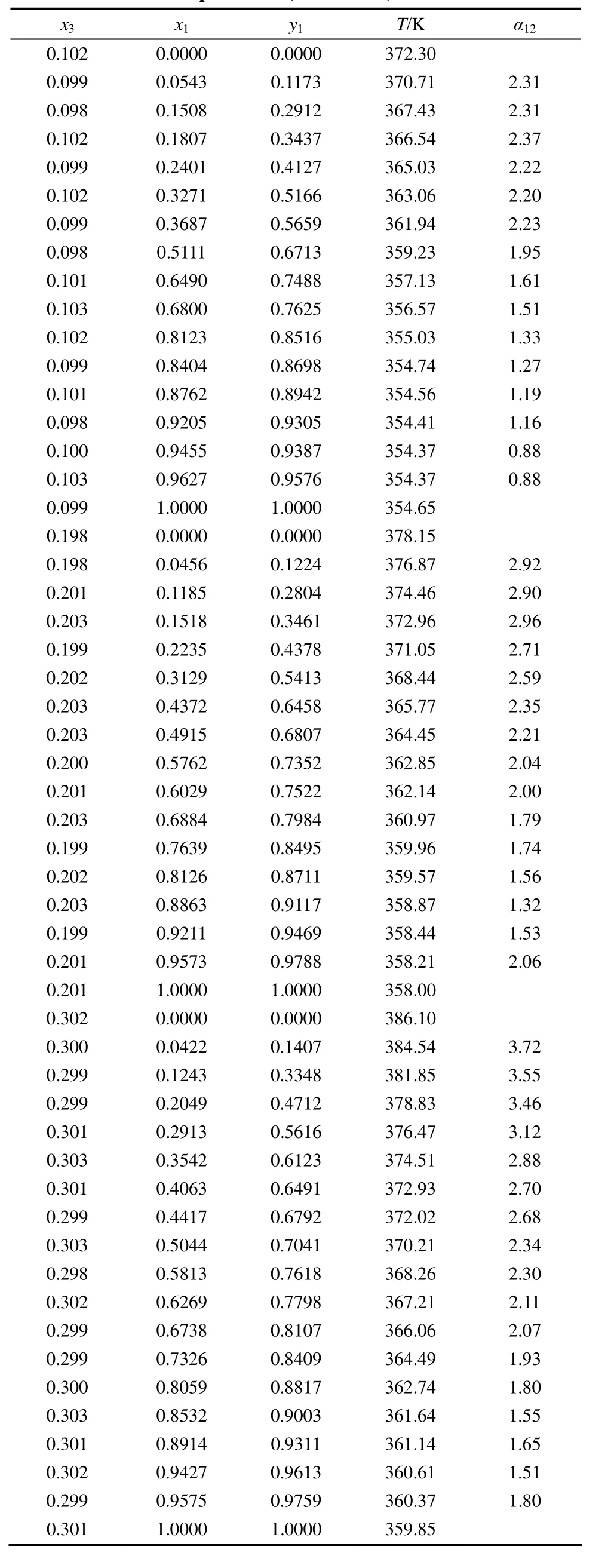
表1 在大气压(101.3 kPa)下乙腈(1)-正丙醇(2)-[HMIM][Br](3)三组分体系的等压汽液相平衡数据Table 1 Isobaric VLE data for acetonitrile (1) -n-propanol (2) - [HMIM][Br] (3) system at atmosphericpressure (101.3 kPa)

表2 在大气压(101.3 kPa)下乙腈(1)-正丙醇(2)-[BzMIM][Br](3)三组分体系的等压汽液相平衡数据Table 2 Isobaric VLE data for acetonitrile (1) -n-propanol (2) - [BzMIM][Br] (3) system at atmosphericpressure (101.3 kPa)

表3 在大气压(101.3 kPa)下乙腈(1)-正丙醇(2)-[BzMIM][Cl](3)三组分体系的等压汽液相平衡数据Table 3 Isobaric VLE data for acetonitrile (1)-n-propanol(2)-[BzMIM][Cl] (3) system at atmosphericpressure (101.3 kPa)
本实验中,选用NRTL模型关联乙腈-正丙醇二组分物系实验数据,所得相应的模型参数见表 4。乙腈-离子液体和正丙醇-离子液体二元交互参数的获得需要调整表1~表3的三元汽液平衡数据。利用NRTL方程对等压汽液相平衡进行关联时,利用非线性最小二乘法,目标函数见式(2)

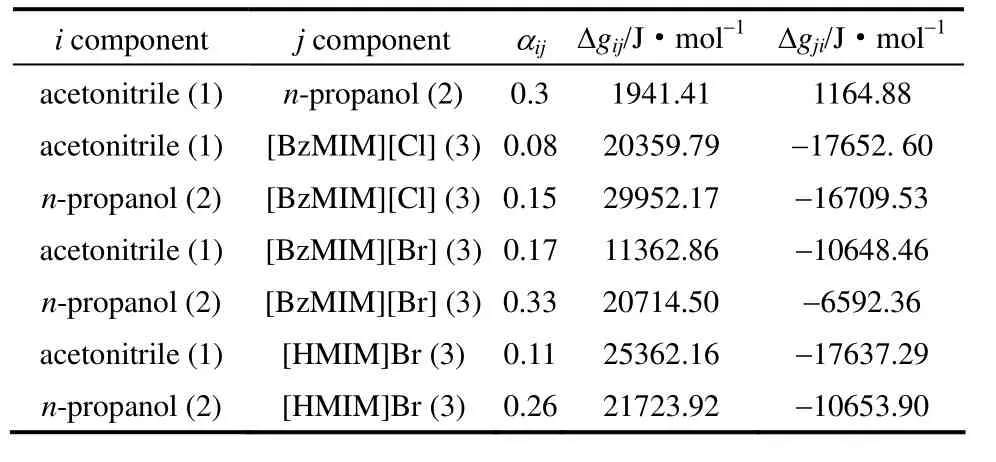
表4 NRTL方程的二元交互作用参数Table 4 Binary interaction parameters of NRTL model
乙腈-正丙醇二组分物系中乙腈的气相摩尔分数的计算值与实验值的绝对平均偏差为0.005,温度平均偏差为 0.2 K。乙腈-正丙醇-[BzMIM][Cl]、乙腈-正丙醇-[BzMIM][Br]以及乙腈-正丙醇-[HMIM][Br]的气相摩尔分数计算值与实验值的绝对平均偏差为0.007,温度平均偏差为0.2 K。
2.4 离子液体对汽液平衡的影响
乙腈-正丙醇-[HMIM][Br]、乙腈-正丙醇-[BzMIM][Br]和乙腈-正丙醇-[BzMIM][Cl]三组分物系的x-y图分别如图2、图3和图4所示。乙腈-正丙醇-[HMIM][Br]、乙腈-正丙醇-[BzMIM][Br]和乙腈-正丙醇-[BzMIM][Cl]三元体系的T-x-y图分别如图5、图6和图7所示。图8所示为溶液中含摩尔分数为0.3的不同离子液体时乙腈对正丙醇的相对挥发度图。

图2 乙腈(1)-正丙醇(2)-[HMIM][Br](3)三组分物系的汽液相平衡数据Fig.2 Isobaric VLE data for acetonitrile-n-propanol -[HMIM][Br] system at 101.3 kPa

图3 乙腈(1)-正丙醇(2)-[BzMIM][Br](3)三组分物系的汽液相平衡数据Fig.3 Isobaric VLE data for acetonitrile (1)-n-propanol (2) -[BzMIM][Br] (3) system at 101.3 kPa

图4 乙腈(1)-正丙醇(2)-[BzMIM][Cl](3)三组分物系的汽液相平衡数据Fig.4 Isobaric VLE data for acetonitrile (1)-n-propanol (2) -[BzMIM][Cl] (3) system at 101.3 kPa
从图2~图7中可以看出,随着离子液体的加入汽液平衡曲线偏离乙腈-正丙醇二组分物系的等压汽液平衡曲线,同时随着离子液体摩尔分数的增大,这一现象越加明显。这主要是由于离子液体对乙腈产生了明显的盐析效应,提高了乙腈-正丙醇二组分物系的相对挥发度,文献[18-21]也有相似报道。
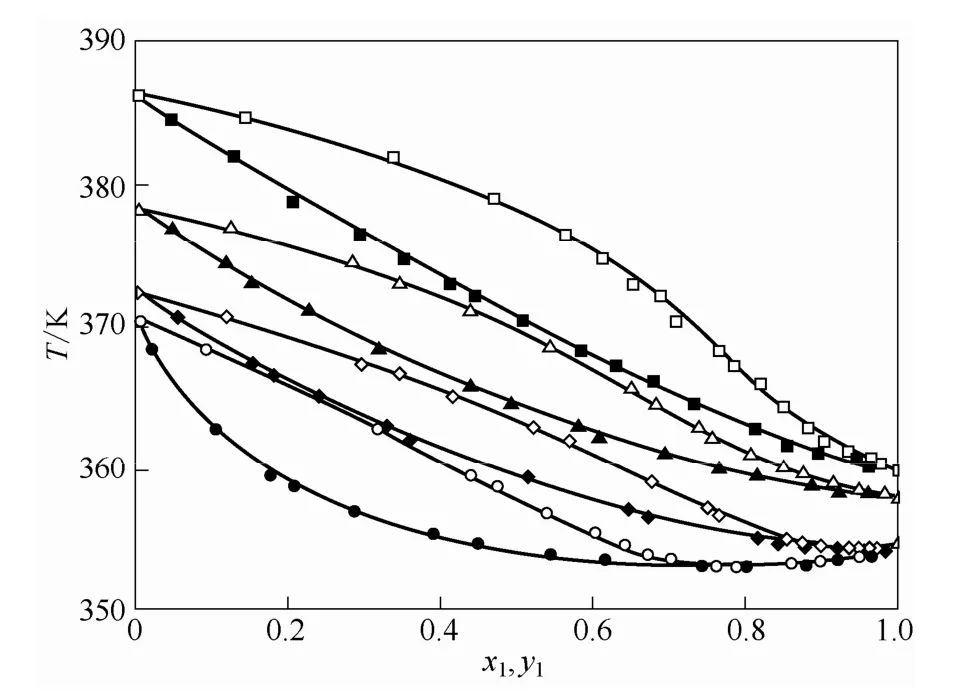
图5 乙腈(1)-正丙醇(2)-[HMIM][Br](3)三组分物系的汽液相平衡数据Fig.5 T-x1-y1diagram for acetonitrile (1)-n-propanol (2) -[HMIM][Br](3) at 101.3 kPa
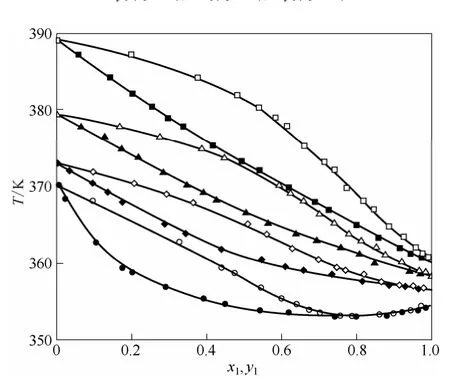
图6 乙腈(1)-正丙醇(2)-[BzMIM][Br](3)三组分物系的汽液相平衡数据Fig.6 T-x1-y1diagram for acetonitrile(1) -n-propanol(2) -[BzMIM][Br](3) at 101.3 kPa
通过图5~图7可知,在加入低浓度的离子液体时,[HMIM][Br]、[BzMIM][Cl]、[BzMIM][Br] 3种离子液体均能使体系的共沸点发生了偏移,液相中摩尔分数为0.1时,[HMIM][Br]使体系的共沸点发生了偏移,但此时并没有完全消除共沸现象。而[BzMIM][Cl]、[BzMIM][Br]在3种含量下皆可完全消除共沸现象。在图5~图7中,离子液体的加入不仅提高了体系的相对挥发度,在常压下,体系的平衡温度也随之提高。上述现象说明,对于分离乙腈-正丙醇二元共沸物系,[BzMIM][Cl]和[BzMIM][Br]相比于[HMIM][Br]有着更强的分离能力。由图8可见,液相中离子液体摩尔分数相同时,离子液体 [BzMIM][Cl]相较于[BzMIM][Br]能更大地增加二组分共沸体系乙腈-正丙醇的相对挥发度。这表明,离子液体[BzMIM][Cl]相较于[BzMIM][Br]有着更强的分离能力。

图7 乙腈(1)-正丙醇(2)-[BzMIM][Cl](3)三组分物系的汽液相平衡数据Fig.7 T-x1-y1diagram for acetonitrile (1)-n-propanol (2) -[BzMIM][Cl] (3) at 101.3 kPa

图8 含摩尔分数为0.3的不同离子液体时乙腈(1)-正丙醇(2)体系中乙腈的相对挥发度Fig.8 Relative volatilities of acetonitrile for acetonitrile (1) -n-propanol (2) systems containing different ILs with mole fraction of 0.3
3 结 论
(1)在大气压(101.3 kPa)下,测定了离子液体摩尔分数约为 0.1、0.2、0.3的乙腈-正丙醇-[BzMIM][Cl]、乙腈-正丙醇-[BzMIM][Cl]、乙腈-正丙醇-[HMIM][Br]三组分物系的等压汽液平衡数据,补充了含离子液体乙腈-正丙醇体系的汽液相平衡数据。
(2)采用NRTL模型对等压汽液平衡数据进行了关联,结果显示,预测值与实验值吻合程度良好,说明NRTL模型可用于关联和预测本体系。
(3)3种离子液体都能够提高乙腈对正丙醇的相对挥发度,且随着液相中离子液体含量的增大,乙腈对正丙醇的相对挥发度相应增加。
(4)3种离子液体提高相对挥发度的顺序为[BzMIM][Cl] > [BzMIM][Br] > [HMIM][Br]。
符号说明
Δg——NRTL方程交互作用参数,J·mol-1
T——平衡温度,K
x——液相分数
y——气相分数
α——相对挥发度
上角标
calcdl——计算值
exptl——实验值
下角标
i,k——组分变量
1——乙腈
2——正丙醇
3——离子液体
[1] O’ Donnell F J, Ayres J T, Mann C K. Preparation of high purity acetonitrile [J].Anal. Chem., 1965, 37:1161-1162.
[2] McConvey I F, Woods D, Lewis M, Gan Q, Nancarrow P. The importance of acetonitrile in the pharmaceutical industry and opportunities for its recovery from waste [J].Org. Process Res. Dev.,2012, 16:612-624.
[3] Walter M, Ramaley L. Purification of acetonitrile [J].Anal. Chem.,1973, 45:165-166.
[4] Plechkova N V, Seddon K R. Applications of ionic liquids in the chemical industry [J].Chem. Soc. Rev., 2008, 37:123-150.
[5] Han X, Armstrong D W. Ionic liquids in separations [J].Acc. Chem.Res., 2007, 40:1079-1086.
[6] Uek T, Watanabe M. Macromolecules in ionic liquids progress,challenges, and opportunitie [J].Macromolecules, 2008, 41:3739-3749.
[7] Seiler M, Jork C, Kavarnou A. Separation of azeotropic mixtures using hyperbranched polymers or ionic liquids [J].AIChE J., 2004,50:2439-2454.
[8] Zhao H. Innovative applications of ionic liquids as “green”engineering liquids [J].Chem. Eng. Commun., 2006, 193:1660-1677.
[9] Lei Z G, Arlt W, Wasserscheid P. Separation of 1-hexene andn-hexane with ionic liquids [J].Fluid Phase Equilibr., 2006, 241:290-299.
[10] Orchilles A V, Miguel P J, Vercher E, Martinez-Andreu A. Ionic liquids as entrainers in extractive distillation:isobaric vapor-liquidequilibria for acetone plus methanol plus 1-ethyl-3-methylimidazolium trifluoromethanesulfonate [J].J. Chem. Eng.Data, 2007, 52:141-147.
[11] Pereiro A B, Araujo J M M, Esperanca J M S S, Marrucho I M,Rebelo L P N. Ionic liquids in separations of azeotropic systems — a review [J].J. Chem. Thermodyn., 2012, 46:2-28.
[12] Wang Xuemeng(王学猛), Jiang Denggao(蒋登高), Geng Zaixin(耿再新). Measurement and correlation of vapor liquid equilibrium data for cyclohexene-1,2-epoxycyclohexane binary system under normal pressure [J].Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2009, 23(3):365-368.
[13] Zeng Hong(曾红), Yao Shun(姚舜), Liu Qisong(刘其松), Zhu Tangfeng(朱堂峰), Song Hang(宋航). Isobaric vapor-liquid equilibria of acetonitrile-propan-1-ol-N,N-dimethyl formamide systems [J].Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2011, 25(3):365-369.
[14] Renon H, Prausnitz J M. Local compositions in thermodynamic excess functions for liquid mixtures [J].AIChE J., 1968, 14:135-144.
[15] Orchilles A V, Miguel P J, Gonzalez-Alfaro V, Vercher E,Martínez-Andreu A. Isobaric vapor-liquid equilibria of 1-propanol+water+trif l uoromethanesulfonate based ionic liquids ternary systems at 100 kPa [J].J. Chem. Eng. Data, 2011, 56:4454-4460.
[16] Doker M, Gmehling J. Measurement and prediction of vapor-liquid equilibria of ternary systems containing ionic liquids [J].Fluid Phase Equilibr., 2005, 227:255-266.
[17] Li Q, Zhang J, Lei Z, Zhu J, Wang B, Huang X. Isobaric vapor-liquid equilibrium for propan-2-ol + water + 1-butyl-3-methylimidazolium tetrafluoroborate [J].J. Chem. Eng. Data, 2009, 54:2785-2788.
[18] Calvar N, Gomez E, Gonzalez B, Dominguez A. Experimental vapor-liquid equilibria for the ternary system ethanol + water +1-ethyl-3-methylpyridinium ethylsulfate and the corresponding binary systems at 101.3 kPa:study of the effect of the cation [J].J. Chem.Eng.Data, 2010, 55:2786-2791.
[19] Orchilles A V, Miguel P J, Vercher E, Martínez-Andreu A. Isobaric vapor-liquid equilibria for 1-propanol + water +1-ethyl-3-methylimidazolium trifluoromethane sulfonate at 100 kPa[J].J. Chem. Eng. Data, 2008, 53:2426-2431.
[20] Orchilles A V, Miguel P J, Vercher E, Martínez-Andreu A. Isobaric vapor-liquid equilibria for methyl acetate + methanol +1-ethyl-3-methylimidazolium trifluoromethane sulfonate at 100 kPa[J].J. Chem. Eng. Data, 2007, 52:915-920.
[21] Cai J, Cui X, Zhang Y, Li R, Feng T. Vapor-liquid equilibrium and liquid-liquid equilibrium of methyl acetate + methanol +1-ethyl-3-methylimidazolium acetate [J].J. Chem. Eng. Data, 2011,56:282-287.
