苯-正丙醇-三辛基甲基醋酸铵物系等压气液相平衡数据的测定及关联
2020-09-15李文秀
李文秀,温 情,曹 颖,张 弢
(沈阳化工大学 化学工程学院 辽宁省化工分离技术重点实验室,辽宁 沈阳 110142)
苯和正丙醇都是常见的有机溶剂,在常压下可形成共沸物(苯含量为80.1%(x)),很难通过常规蒸馏方法分离苯-正丙醇物系[1-3]。王守玉等[4]以氯化锂为萃取剂,通过萃取精馏的方法分离了苯-正丙醇共沸物系。李玲等[5]采用热集成变压精馏的方法分离了苯-正丙醇物系并对其进行优化。Li[6]采用连续萃取精馏工艺,探究了三种醋酸类离子液体作为萃取剂对苯-甲醇共沸物的影响。近年来,离子液体作为新兴的萃取剂被广泛用于共沸物的分离[7-10]。与传统的萃取剂相比,离子液体具有易于回收、对环境的污染小、对设备和管道的腐蚀性低等优点[11-13]。目前为止未见以离子液体为萃取剂对苯-正丙醇共沸物系进行分离的研究报道。
本工作考察了离子液体三辛基甲基醋酸铵([N1,8,8,8][OAc])对苯-正丙醇共沸物系等压气液相平衡的影响。首先测得101.3 kPa下苯-正丙醇-[N1,8,8,8][OAc]三元物系的等压气液相平衡数据,再采用NRTL模型对实验数据进行了拟合,得到模型参数。
1 实验部分
1.1 实验试剂
苯和正丙醇:纯度高于99%(w),中国国药集团有限公司;[N1,8,8,8][OAc]:纯度高于 99%(w),兰州雨陆精细化工有限公司,实验前在373 K、2 kPa下干燥48 h,除去挥发性化合物。
1.2 实验装置及测定方法
采用天津大学北洋化工实验设备公司CE-2型平衡釜测定常压下气液相平衡数据[14]。分别配制一定比例的苯、正丙醇和[N1,8,8,8][OAc]的混合溶液加入到平衡釜中进行加热。采用标准不确定度为0.01 K的精密水银温度计对气液相平衡温度进行测量。保持回流滴数在每分钟20~30滴,稳定3~4 h后,认为气液两相处于平衡状态,记录温度,然后用微量进样器分别从气液两相采样口进行取样分析。
采用称重法测量液相中[N1,8,8,8][OAc]的含量。气液两相中苯和正丙醇的含量采用安捷伦公司GC7820A型气相色谱仪进行定量分析,FID检测,载气为氮气,HP-5型色谱柱。
2 结果与讨论
2.1 实验装置可靠性检验
为了检验平衡装置的可靠性,在101.3 kPa下测量了苯(1)-正丙醇(2)二元物系的气液相平衡数据,结果列在表1中。
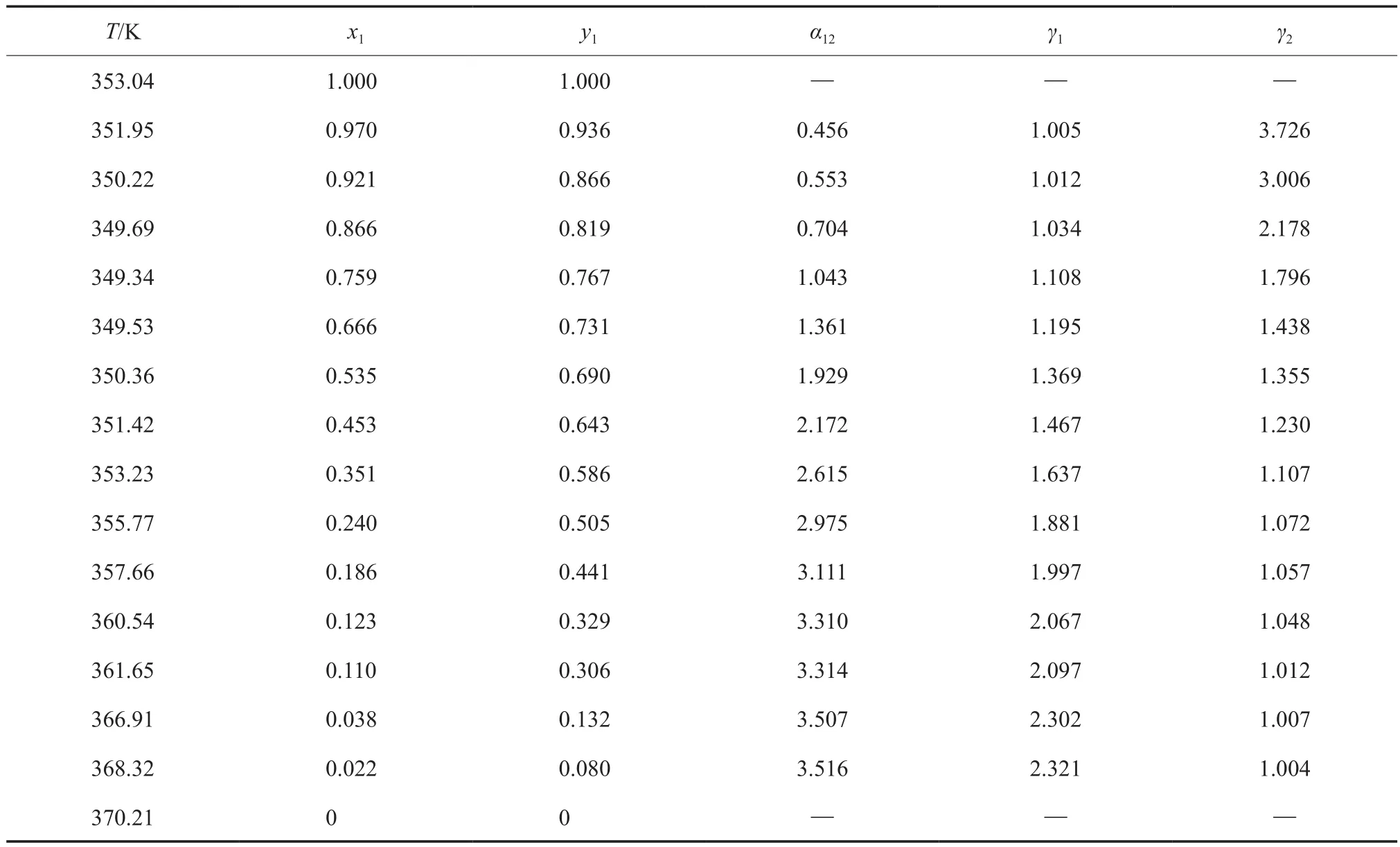
表1 在101.3 kPa下苯(1)-正丙醇(2)二元物系等压气液相平衡数据Table 1 The isobaric vapor-liquid equilibrium(VLE) data for the benzene(1)-n-propanol(2) binary system at 101.3 kPa
图1为101.3 kPa下苯(1)-正丙醇(2)二元物系的气液平衡曲线。由图1可知,实验值与文献值吻合良好。
采用Herington面积归一化法[15]对二元物系的实验数据进行热力学一致性检验,结果见图2。根据计算所得的二组分活度系数,做ln(γ1/γ2)-x1曲线,并计算出偏差(D)和压力熵(J)。由图2可知,|D-J| = 5.722<10,实验测得苯和正丙醇的二元气液平衡数据能够较好地与文献数据吻合,并满足热力学一致性检验,说明所用相平衡测试设备及方法具有较高的可靠性。
2.2 三元气液相平衡数据
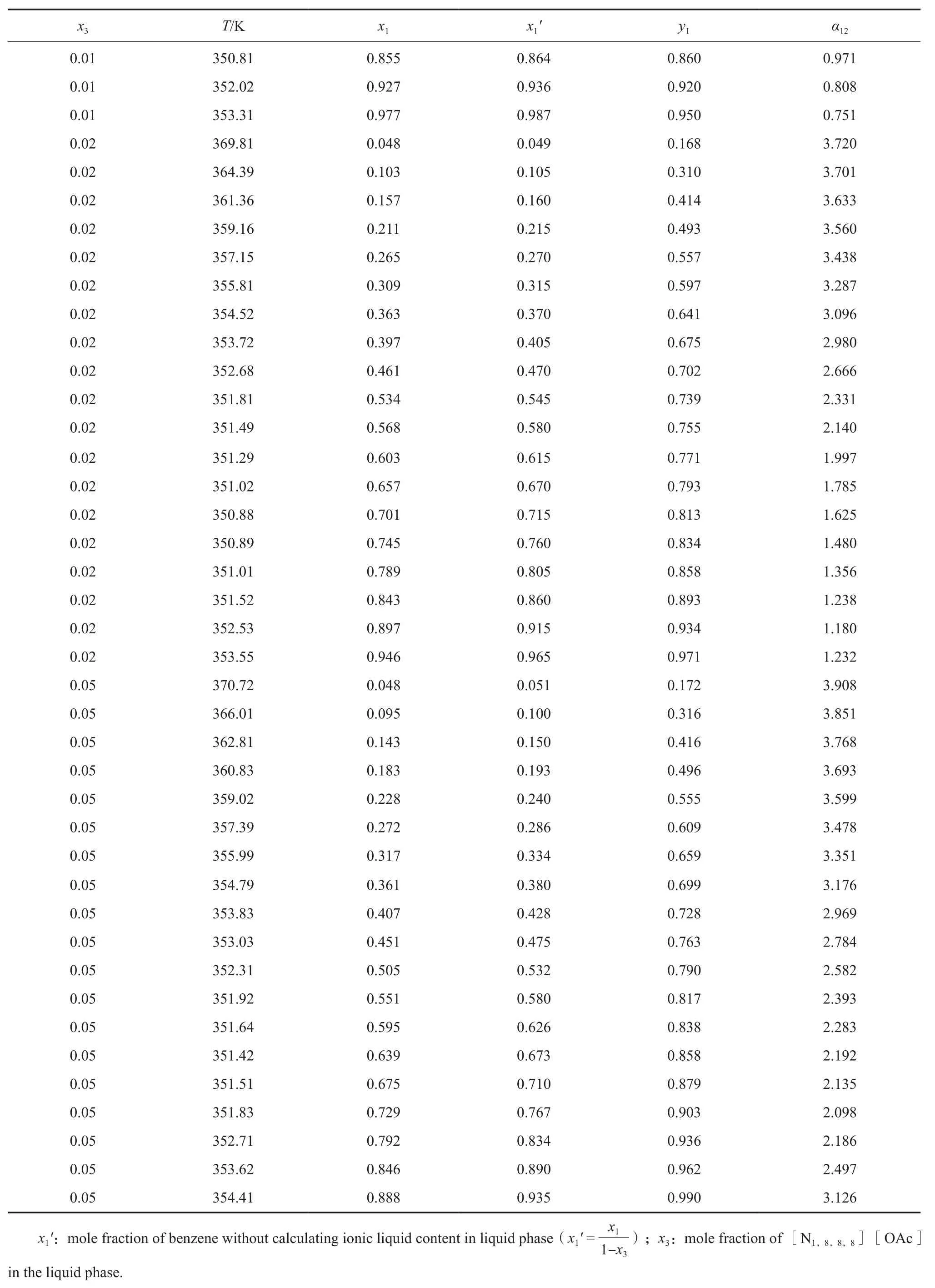
101.3 kPa 下苯(1)-正丙醇(2)-[N1,8,8,8][OAc](3)三元物系等压气液相平衡数据见表2。
2.3 数据关联
采用非随机双液体(NRTL)模型对实验数据进行了关联[16-17]。依据表2中的气液相平衡数据,通过最小化方程中的目标函数得到NRTL方程的二元交互作用参数模型参数,结果见表3。
2.4 [N1,8,8,8][OAc]对气液相平衡的影响
图 3为 101.3 kPa下 苯(1)-正 丙 醇(2)-[N1,8,8,8][OAc](3)三元物系等压气液平衡曲线。由图 3 可知,离子液体[N1,8,8,8][OAc]的加入对苯表现出明显的盐析作用,提高了苯对正丙醇的相对挥发度,使物系的共沸点发生了明显的上移,[N1,8,8,8][OAc]摩尔分数越大,偏离程度越大,当[N1,8,8,8][OAc]摩尔分数达 0.02 时,共沸点消失。基于 NRTL 模型计算可知,[N1,8,8,8][OAc]可以打破共沸的最小摩尔分数为0.014 4。因此,[N1,8,8,8][OAc]可用作分离苯-正丙醇共沸物系的萃取剂。
图 4 为 101.3 kPa 下[N1,8,8,8][OAc](3)对苯(1)-正丙醇(2)共沸物系相对挥发度的影响。
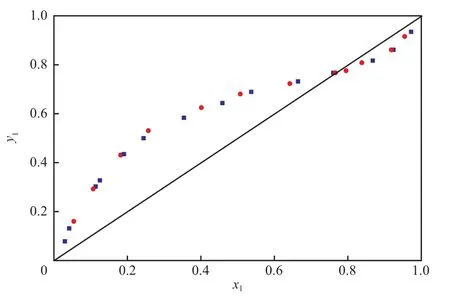
图1 在101.3 kPa下苯(1)-正丙醇(2)二元物系的气液平衡曲线Fig.1 VLE curves for the benzene(1)-n-propanol(2) system at 101.3 kPa.
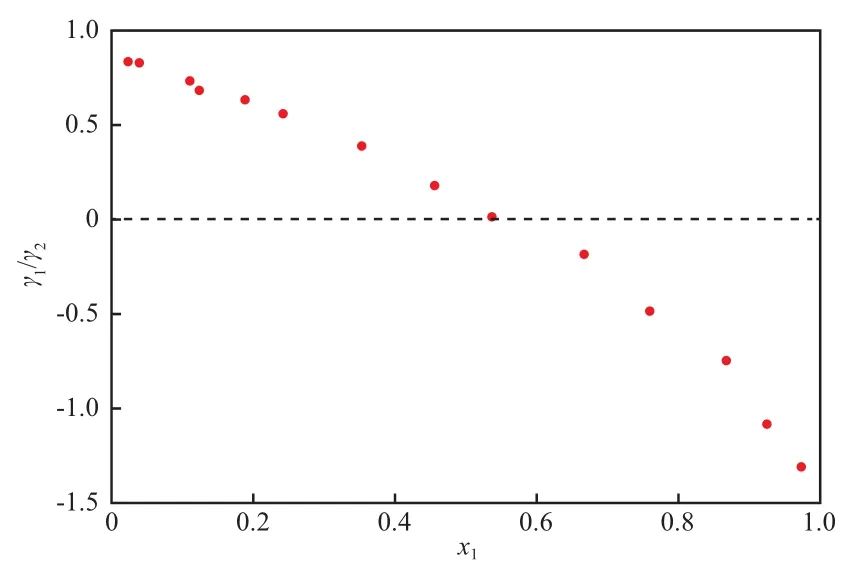
图2 热力学一致性检验Fig.2 Thermodynamic consistency test.
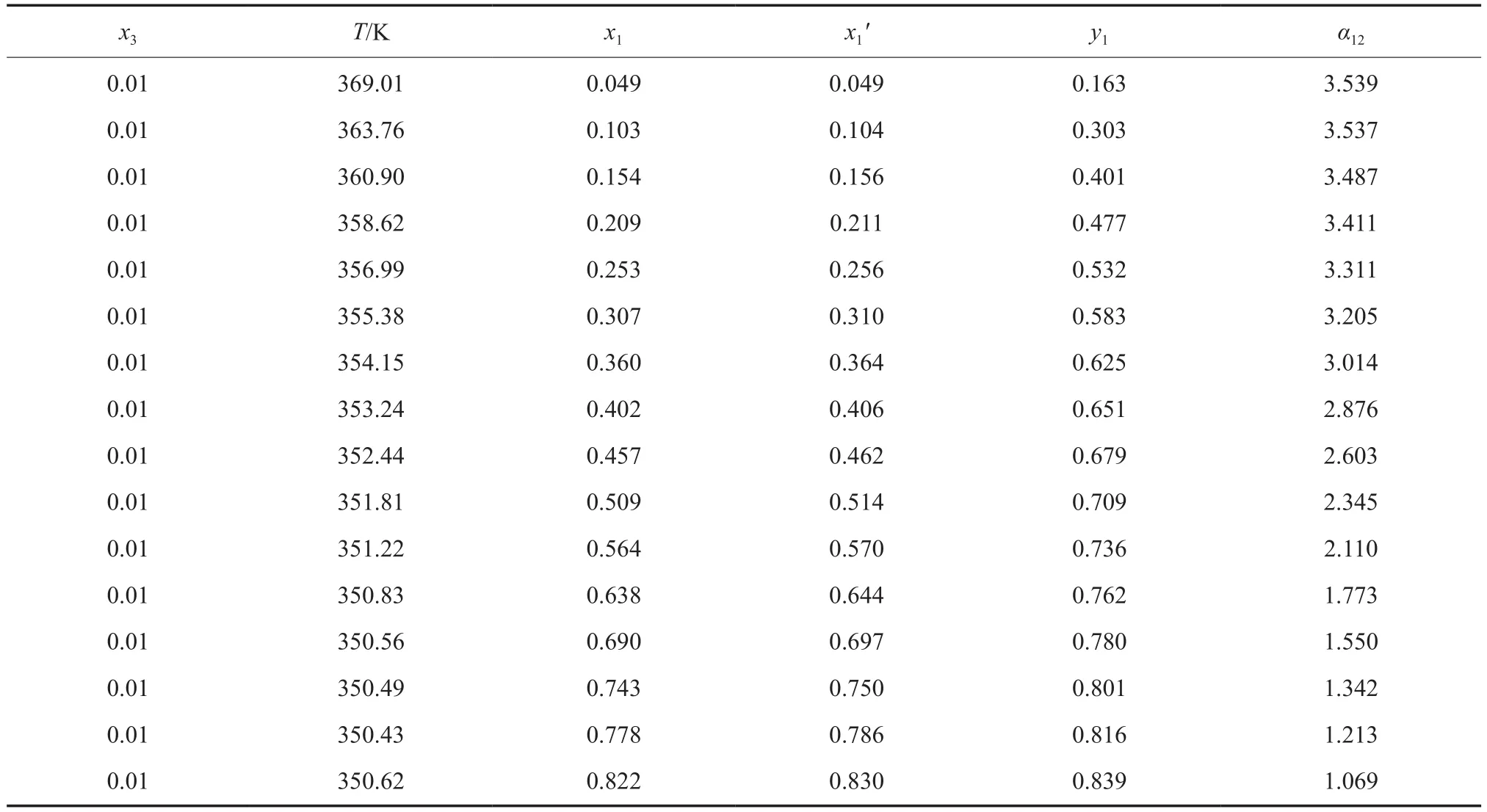
表 2 101.3 kPa 下苯(1)-正丙醇(2)-[N1,8,8,8][OAc](3)三元物系等压气液相平衡数据Table 2 Isobaric VLE data for the benzene(1)-n-propanol(2)-trioctylmethylammonium acetate([N1,8,8,8][OAc])(3) ternary system at 101.3 kPa
续表2
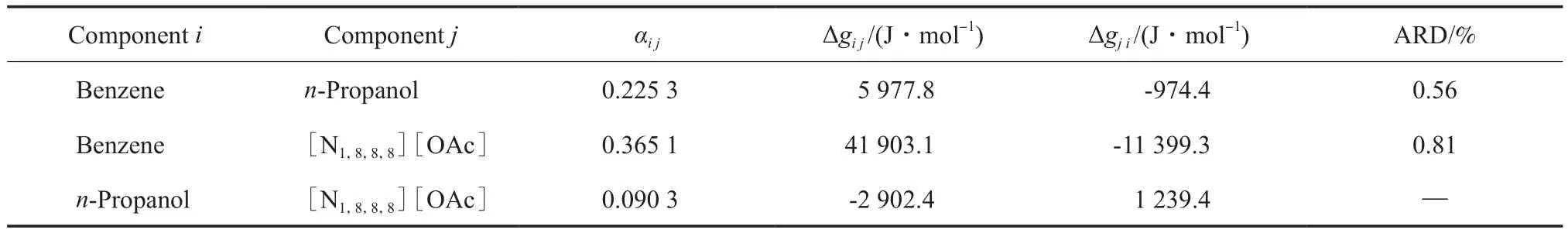
表3 采用NRTL模型所得的二元交互作用参数Table 3 Binary interaction parameters of NRTL model
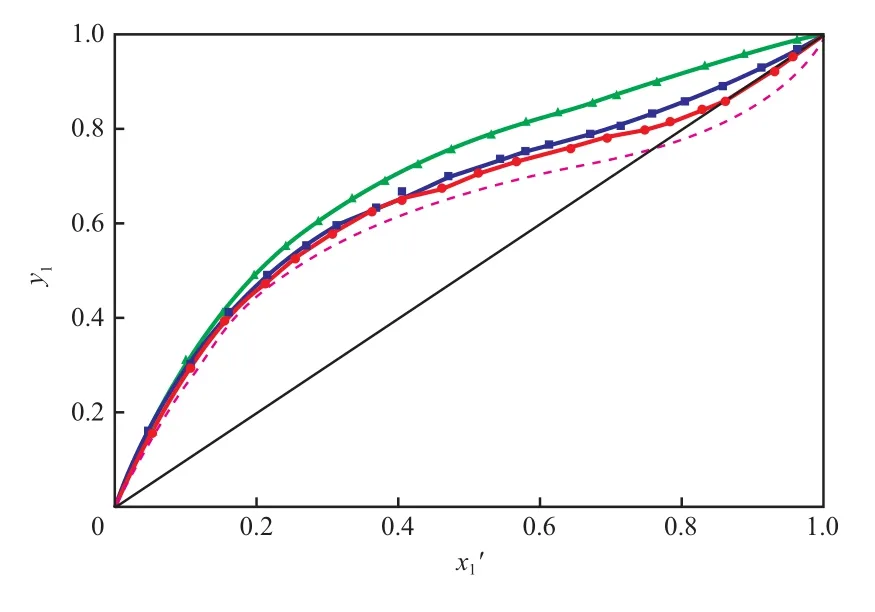
图 3 101.3 kPa 下苯(1)-正丙醇(2)-[N1,8,8,8][OAc](3)三元物系等压气液平衡曲线Fig.3 Isobaric VLE curves for the benzene(1)-n-propanol(2)-[N1,8,8,8][OAc](3) system at 101.3 kPa.
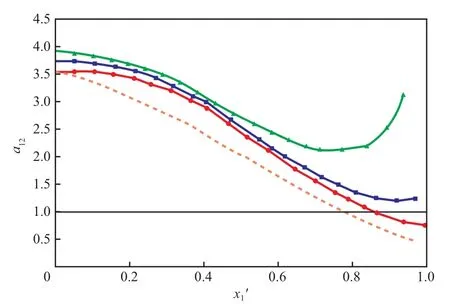
图 4 101.3 kPa 下[N1,8,8,8][OAc](3)对苯(1)-正丙醇(2)相对挥发度的影响Fig.4 Effect of [N1,8,8,8][OAc](3) on the relative volatility of benzene(1)-n-propanol(2) at 101.3 kPa.
由图 4 可知,[N1,8,8,8][OAc]的加入可显著提高苯对正丙醇的相对挥发度,且[N1,8,8,8][OAc]摩尔分数越大效果越明显。这种现象可通过三者之间的相互作用力来分析。[N1,8,8,8][OAc]具有较高的极性,能够与正丙醇形成氢键,强度大于正丙醇和苯之间的非极性相互作用。因而[N1,8,8,8][OAc]能够通过破坏丙醇-苯之间的非极性作用打破它们的共沸,并通过氢键作用限制正丙醇的挥发,从而增加了苯对正丙醇的相对挥发度。
3 结论
1)在常压下测定了[N1,8,8,8][OAc]摩尔分数分别为 0.01,0.02,0.05 时苯 + 正丙醇 +[N1,8,8,8][OAc]三元物系的气液相平衡数据。
2)[N1,8,8,8][OAc]能够通过限制正丙醇的挥发打破正丙醇-苯物系的共沸并提高苯对正丙醇的相对挥发度。[N1,8,8,8][OAc]的加入对苯-正丙醇共沸物系有显著的盐析效应,待分离物系的相对挥发度随着物系中[N1,8,8,8][OAc]摩尔分数的增大而增大,当[N1,8,8,8][OAc]的摩尔分数为 0.02时共沸现象完全消失,[N1,8,8,8][OAc]可作为苯-正丙醇共沸物系的萃取剂。
3)采用NRTL模型对气液相平衡数据进行关联,得出相关参数。并通过NRTL方程计算得到[N1,8,8,8][OAc]打破苯 + 正丙醇物系共沸的最小摩尔分数为0.014 4。
