维生素C提高体外培养的去分化脂肪细胞心肌分化效率*
2015-03-30李福海李宗庄张陈匀贵州省心血管病研究所贵州省人民医院心内科病理科贵州贵阳55000
李福海,李宗庄,蒋 智,易 韦,张陈匀△(贵州省心血管病研究所,贵州省人民医院心内科,病理科,贵州贵阳 55000)
维生素C提高体外培养的去分化脂肪细胞心肌分化效率*
李福海1,2,李宗庄1,2,蒋智1,2,易韦3,张陈匀1,2△
(1贵州省心血管病研究所,贵州省人民医院2心内科,3病理科,贵州贵阳550002)
[摘要]目的:采用维生素C处理体外培养的去分化脂肪(dedifferentiated fat,DFAT)细胞,以期进一步提高DFAT细胞的心肌分化效率。方法:用天花板贴壁培养法使大鼠成熟脂肪细胞去分化为DFAT细胞,并体外培养增殖至第3代,然后在培养基中添加维生素C或(和)乳鼠心脏细胞裂解液诱导DFAT细胞心肌分化。3周后,用倒置相差显微镜观察DFAT细胞的形态变化,用real-time PCR、免疫荧光和Western blot检测DFAT细胞的心肌特异性标志物cTnT、GATA-4及NKx2.5 mRNA和蛋白的表达。结果:大鼠脂肪细胞经天花板贴壁培养后形态转变为成纤维细胞样的DFAT细胞。DFAT细胞在普通培养条件下可自发表达少量心肌特异性标志物。经乳鼠心脏细胞裂解液诱导后,DFAT细胞体积增大、变长,可见肌管样结构,cTnT、GATA-4及NKx2.5 mRNA和蛋白的表达水平较普通培养的DFAT细胞显著升高。在维生素C的作用下,DFAT细胞cTnT、GATA-4及NKx2.5的表达水平进一步升高。未观察到自发性搏动细胞。结论:维生素C可促进DFAT细胞分化为心肌样细胞。
[关键词]去分化脂肪细胞;维生素C;乳鼠心脏细胞裂解液;诱导分化
[修回日期]2015-02-09
Vitamin C enhanced myocardial differentiation of dedifferentiated fat cells
LI Fu-hai1,2,LI Zong-zhuang1,2,JIANG Zhi1,2,YI Wei3,ZHANG Chen-yun1,2
(1Guizhou Institute for Cardiovascular Disease,2Department of Cardiology,3Department of Pathology,Guizhou Province People's Hospital,Guiyang 550002,China.E-mail: cyzhang5828@163.com)
[ABSTRACT]AIM: In order to observe the myocardial differentiation capacity of the dedifferentiated fat (DFAT) cells treated with vitamin C in vitro.METHODS: DFAT cells were dedifferentiated from the mature rat adipocytes with ceiling adherent culture.The DFAT cells of passage 3 were used in the study.Vitamin C and/or neonatal rat heart tissue lysate were added into the culture medium to induce myocardial differentiation for 3 weeks.The cell morphology was observed under microscope.The myocardial-specific markers,such as cTnT,GATA-4 and NKx2.5,were examined by the methods of immunofluorescence,PCR and Western blot.RESULTS: Mature rat adipocytes dedifferentiated into fibroblastlike DFAT cells after ceiling adherent culture.The DFAT cells spontaneously differentiated into cardiomyocyte-like cells under normal culture condition with a low incidence.After treated with neonatal rat heart cell lysate,the DFAT cells became cardiomyocyte-like cells that had bigger size,longer shape and myotubule-structure.The expression of cTnT,GATA-4 and NKx2.5 was remarkably increased at both mRNA and protein levels as compared with the normal cultured DFAT cells.The expression of cTnT,GATA-4 and NKx2.5 was further increased in DFAT cells after treating with vitamin C.No spontaneous beating cell was observed.CONCLUSION: Vitamin C enhances the differentiation of DFAT cells into cardiomyocyte-like cells.
[KEY WORDS]Dedifferentiated fat cells; Vitamin C; Neonatal rat heart cell lysate; Induced differentiation
急性心肌梗死已成为严重危害我国人民生命健康的重要疾病[1]。虽然药物及介入治疗有了长足进展[2],但这些方法不能再生心肌以代偿损失心肌的收缩力,限制了心功能的恢复。因此,心肌梗死患者最终难以避免的发展为充血性心力衰竭。干细胞可以分化为其它成熟细胞,如心肌细胞、内皮细胞、神经细胞等[3-5]。近年来研究发现干细胞移植到心脏梗死区可分化为心肌细胞以代偿心肌收缩力,改善心梗后心功能[6-8],为心肌梗死的治疗提供了新思路。胚胎干细胞、骨骼成肌细胞、诱导多能干细胞、间充质干细胞等种子细胞已经有广泛研究,但因来源有限、取材不便、免疫排斥、分化方向难以调控、心肌分化效率低、肿瘤形成等问题,使这些种子细胞难以广泛应用于临床,并且临床疗效不明确[9]。最近Matsumoto等[10]报道成熟脂肪细胞经天花板培养去分化后转变为具有多向分化潜能的去分化脂肪(dedifferentiated fat,DFAT)细胞。DFAT细胞具有取材方便、增殖能力强[11]、免疫原性低[10]、表型稳定[10]等特点,其在体外可分化为具有收缩功能的心肌细胞[12],是自体移植的理想种子细胞,可避免上述干细胞所面临的重重困难。如何提高细胞的心肌分化效率是今后细胞临床应用的重要问题之一。Behfar等[13]研究发现骨髓间充质干细胞心肌分化能力越强,移植治疗心肌梗死小鼠的疗效越好,维生素C可诱导胚胎干细胞[14]、诱导多能干细胞[15-16]、羊水干细胞[17]向心肌分化,但对DFAT细胞的作用尚无研究。通过本实验,我们首次报道在乳鼠心脏细胞裂解液(neonatal rat heart cell lysate,NRHCL)体外模拟心肌微环境的诱导条件下,维生素C对细胞心肌分化效率的作用。
材料和方法
1实验动物
4~6周龄的雄性Sprague Dawley (SD)大鼠及出生24 h内的SD乳鼠,由贵阳医学院实验动物中心提供,清洁级标准。
2实验方法与步骤
2.1成熟脂肪细胞的分离及去分化培养4~6周龄SD大鼠予腹腔注射10%水合氯醛溶液(3 mL/kg)诱导麻醉,在无菌条件下取出腹股沟处皮下脂肪组织,剪碎后加0.1% I型胶原酶(Sigma),在37℃恒温水浴箱振荡消化45 min,加含20%胎牛血清(HyClone)的高糖DMEM(HyClone)终止消化,细胞滤筛过滤,将滤液1 000 r/min离心5 min。收集悬浮于最上层的成熟脂肪细胞接种于25 cm2培养瓶,用完全培养基(含20%胎牛血清的高糖DMEM)充满培养瓶,将培养瓶翻转倒置于细胞培养箱中进行天花板培养(37℃、5% CO2、饱和湿度)。用倒置显微镜下动态观察细胞形态变化。7 d后可见脂肪细胞牢固贴于培养瓶底,翻正培养瓶,弃去培养液,每2天更换4 mL培养基继续培养。当细胞吐出脂滴由圆形变为长梭形说明脂肪细胞已去分化为DFAT细胞。当生长融合达70%~80%时,可传代培养,取第3~6代细胞进行后续实验。
2.2乳鼠心脏细胞裂解液的制备将出生24 h内的SD乳鼠断颈处死,迅速取出心脏,放入预先置于冰上的PBS液中去除心房、血管及结缔组织,用PBS液清洗3次后,将心室肌充分剪碎,加入含0.1%胰酶和0.1%I型胶原酶的消化液,在37℃培养箱振荡消化,吸管吹打、静置后,吸取上层细胞悬液加入完全培养基中吹打混匀。如此重复消化5~6次直至组织块消化完全。将收集的细胞悬液以1 000 r/min离心10 min,弃上清,用完全培养基重悬为2×109/L,于-70℃、4℃反复冻融3次获得心脏细胞裂解液,最后以3 000 r/min离心10分钟,用0.22 μm的滤器过滤后备用。
2.3体外诱导DFAT细胞向心肌细胞方向分化3 ~6代DFAT细胞制成5×108/L单细胞悬液接种于6孔板,待48 h细胞完全贴壁后,将完全培养基分别换为NRHCL、含10-4mol/L维生素C(Sigma)的完全培养基或含10-4mol/L的维生素C的NRHCL诱导心肌分化,每天换液1次,用倒置相差显微镜观察细胞形态的变化并拍照。
2.4诱导后DFAT细胞的免疫荧光检测取上述诱导心肌分化3周后的DFAT细胞制成细胞爬片,4%多聚甲醛固定15 min,0.5% Triton X-100透膜20 min,10%封闭血清封闭30 min,用1∶200小鼠抗大鼠心肌肌钙蛋白T(cardiac troponin T,cTnT; Santa Cruz),4℃孵育过夜,PBS漂洗3次,用1∶100 FITC标记羊抗小鼠IgG(博士德公司) 37℃避光孵育1 h,抗淬灭剂封片,用荧光显微镜观察并采集图像,每个爬片随机选取5个高倍视野拍摄照片,计数视野内cTnT阳性细胞数和总细胞数,计算cTnT阳性细胞百分比。
2.5 Real-time PCR检测诱导后DFAT细胞心肌特异性标记物NKx2.5、GATA-4和cTnT的mRNA表达
采用RNA提取试剂盒(康为世纪)提取诱导3周后上述4组细胞的总RNA,将mRNA逆转录成cDNA,以cDNA为模板进行real-time PCR,PCR条件为: 50℃2 min,95℃10 min;95℃15 s、60℃1 min行40个循环。ABI Step One Plus型荧光定量PCR仪采集待测基因及内参照β-actin扩增各循环荧光信号,以Applied Biosystems SDS 1.4软件进行荧光收集和资料分析。SDS 1.4软件分析其ΔΔCt值及荧光相对值(relative quantity,RQ)值,RQ=2-ΔΔCt。分析实验结果时以β-actin为内参照,计算目的基因的相对表达水平。
2.6诱导后DFAT细胞心肌特异性蛋白表达水平的Western blot检测提取试剂盒(上海生工)提取诱导3周后的上述4组细胞的总蛋白,BCA法行蛋白定量后,上样、SDS-PAGE分离蛋白,湿法转膜转移蛋白条带至PVDF膜上,封闭液室温封闭PVDF膜1 h,加I抗(1∶500)和II抗(1∶2 000)孵育后曝光、显影、定影。用扫描仪扫描曝光胶片,用Bandscan软件分析条带像素灰度值。以β-actin蛋白条带作为内参照,计算各组待测目标蛋白条带与β-actin蛋白条带总灰度的百分比值作为待测目标蛋白表达的相对水平。
3统计学处理
以上各部分实验均重复4次,数据采用均数±标准差(mean±SD)表示,用SPSS 17.0统计软件对数据行单因素方差分析。以P<0.05为差异有统计学意义。
结果
1成熟脂肪细胞去分化为DFAT细胞
培养2 d后,成熟大鼠脂肪细胞内含折光性高的单个圆形脂滴,漂浮于培养瓶顶壁,3~4 d后可见胞质中的单个圆形脂滴分裂成多个小脂滴,胞质向周围伸展,细胞由圆形变成椭圆形,胞质外可见细小的脂滴颗粒聚集,细胞突起延长,形成类似触角样结构。脂滴继续裂解变小,5~6 d后可见细胞逐渐脱去脂滴,形态变为不含脂滴或仅含少量脂滴的长梭形,并可观察到细胞分裂增殖。10 d后细胞已完全脱去脂滴,生长融合,去分化为成纤维样的DFAT细胞。细胞增殖第3~6代后细胞形态无明显变化,见图1。
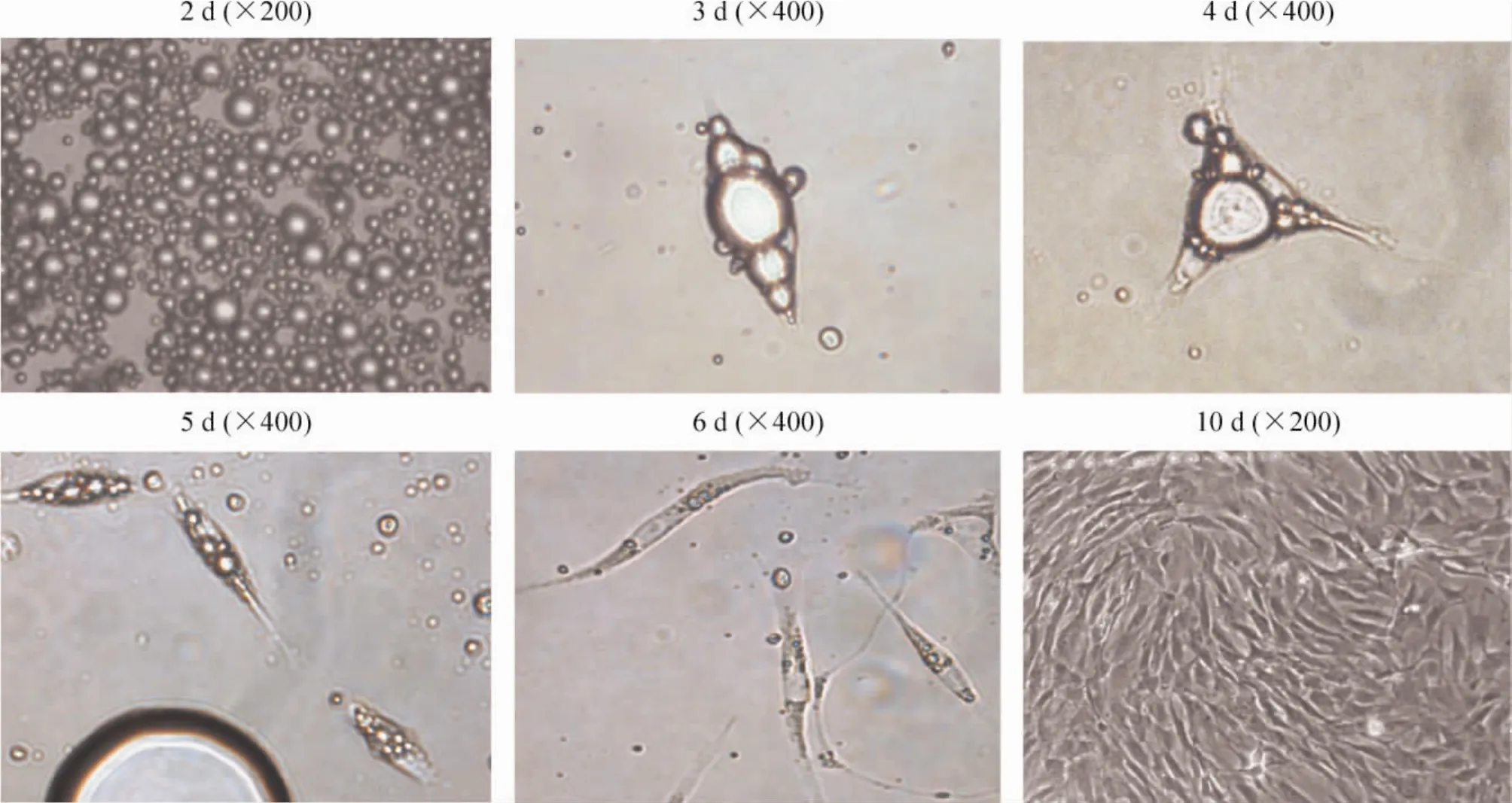
Figure 1.The morphological transformation of the mature rat adipocytes to DFAT cells during ceiling adherent culture.图1大鼠脂肪细胞经天花板培养去分化为DFAT细胞的形态变化
2 DFAT细胞经诱导分化后的形态变化
诱导1周后,细胞胞体伸展,呈长梭形,体积增大、形态变长。诱导2周后细胞生长旺盛,增殖明显,细胞排列多趋于一致、平行生长,多数细胞伸出分支状突起,并相互连接,呈聚集生长,上述现象在含维生素C的NRHCL组比单独维生素C和NRHCL组更明显。诱导3周后胞体更加饱满,立体感增强,细胞间相互连接增多形成细胞簇,可观察到肌管样结构,细胞形态近似于心肌,但均未观察到有发跳动的细胞,见图2。
3诱导3周后DFAT细胞的cTnT免疫荧光检测
细胞免疫荧光检测显示:诱导3周后,维生素C组、NRHCL组和含维生素C的NRHCL组均可观察到心肌特异性标志物cTnT阳性细胞;这些细胞轮廓清楚,cTnT定位于细胞质,经FITC标记后在荧光显微镜下显示为绿色荧光。对照组仅见非特异性着色,见图3。

Figure 2.The morphological transformation of the DFAT cells after inducing myocardial differentiation(×300).图2 DFAT细胞经诱导分化后的形态变化
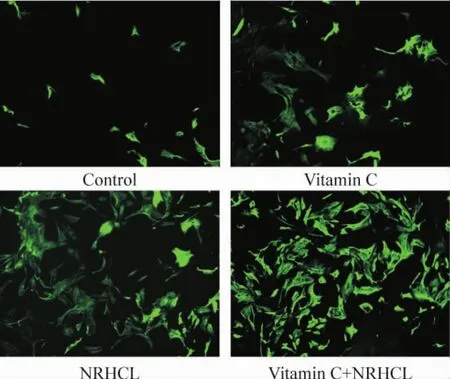
Figure 3.The cTnT expression (green) in DFAT cells after 3weeks of inducing myocardial differentiation (×200).图3诱导3周后DFAT细胞cTnT的表达
4诱导3周后DFAT细胞中心肌特异性标志物的表达
4.1诱导3周后DFAT细胞中cTnT mRNA和蛋白质的表达水平与对照组相比,经诱导处理3周后维生素C组和NRHCL组和含维生素C的NRHCL组细胞中cTnT mRNA和蛋白表达水平均升高(P<0.05),且含维生素C的NRHCL组细胞中cTnT mRNA和蛋白表达水平均高于维生素C组和NRHCL组(P<0.05)。NRHCL组cTnT mRNA表达水平高于维生素C组(P<0.05),但维生素C组、NRHCL组间cTnT蛋白表达水平的差异无统计学意义,见图4。
4.2诱导3周后DFAT细胞中GATA-4的mRNA和蛋白质表达水平与对照组相比,维生素C组、NRHCL组和含维生素C的NRHCL组细胞中GATA-4 mRNA和蛋白表达水平均升高(P<0.05),含维生素C的NRHCL组中GATA-4 mRNA和蛋白的表达水平均高于维生素C组和NRHCL组(P<0.05)。且NRHCL组GATA-4的mRNA和蛋白表达水平均高于维生素C组(P<0.05),见图5。
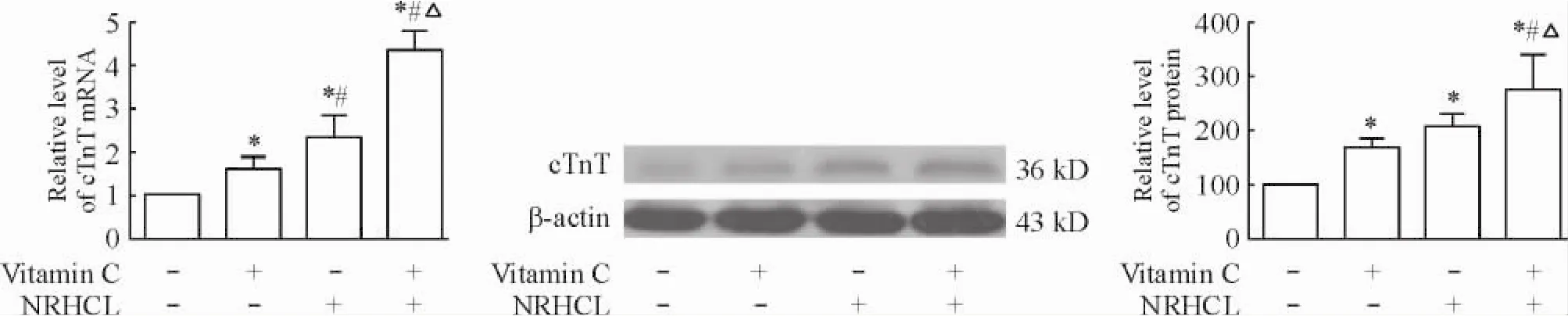
Figure 4.The expression of cTnT in DFAT cells after 3 weeks of induced myocardial differentiation.Mean±SD.n=4.*P<0.05 vs control group;#P<0.05 vs vitamin C group;△P<0.05 vs NRHCL group.图4诱导3周后DFAT细胞中cTnT mRNA和蛋白质相对表达水平
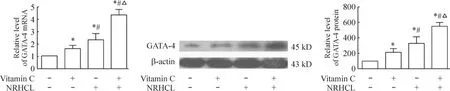
Figure 5.The expression of GATA-4 in the DFAT cells after 3 weeks of inducing myocardial differentiation.Mean±SD.n=4.*P<0.05 vs control group;#P<0.05 vs vitamin C group;△P<0.05 vs NRHCL group.图5诱导3周后DFAT细胞中GATA-4的mRNA和蛋白质相对表达水平
4.3诱导3周后DFAT细胞中NKx2.5 mRNA和蛋白质的表达水平与对照组相比,维生素C组、NRHCL组和含维生素C的NRHCL组细胞中NKx2.5 mRNA和蛋白的表达水平均升高(P< 0.05),含维生素C的NRHCL组中NKx2.5 mRNA和蛋白的表达水平均高于维生素C组和NRHCL组(P<0.05)。维生素C组、NRHCL组间NKx2.5 mRNA和蛋白的表达水平的差异均无统计学意义,见图6。

Figure 6.The expression of NKx 2.5 in the DFAT cells after 3 weeks of inducing myocardial differentiation.Mean±SD.n=4.*P<0.05 vs control group;#P<0.05 vs vitamin C group;△P<0.05 vs NRHCL group.图6诱导3周后DFAT细胞中NKx2.5的mRNA和蛋白质相对表达水平
讨论
我们分离并培养大鼠成熟脂肪细胞,用天花板贴壁培养法使其去分化为DFAT细胞,通过心脏细胞裂解液模拟心肌微环境DFAT细胞可再分化为心肌样细胞,表达cTnT、GATA-4和NKx2.5心肌细胞特异标志,并且维生素C可进一步促进DFAT细胞的心肌分化。
DFAT细胞缺乏特异性标志物,其鉴定基于培养初期脂肪细胞的形态学变化及后期心肌特异性标志物的检测[10,12,18]。我们参照Sugihara等[19]的天花板贴壁培养法,使圆形透亮的大鼠成熟脂肪细胞去分化为类似成纤维细胞形态的DFAT细胞,在维生素C或(和)心脏细胞裂解液作用下形态进一步发生转变,并表达心肌特异性标志物。我们的实验结果支持Matsumoto等[10]的研究,充分说明细胞不仅可以自我增殖,还具有心肌分化潜能。
干细胞移植治疗心肌梗死的临床实验均采用自体干细胞移植策略[20],其中骨髓间充质干细胞已经被广泛研究[21-22]。骨髓成分复杂,间充质干细胞仅占所有骨髓细胞的0.01%[23],为获取足量骨髓常需多点骨髓穿刺,创伤较大,且骨髓间充质干细胞增殖能力较弱,扩增时间较长,体外心肌分化效率不高。相比之下,细胞具有的特殊优势一是来源丰富,100 mg的脂肪组织至少可获得3×106个原代细胞[24],且脂肪组织经微创抽脂技术反复取材,患者更容易接受;二是细胞纯度高,原代细胞的纯度高达99.9%[12],体外培养时即呈现较强的心肌分化能力[25]。三是对供者年龄要求较低,据报道4~81岁供者的成熟脂肪细胞均可在体外培养中去分化为细胞[24]。根据细胞上述优势,可预先在体外定向分化为心肌前体细胞或心肌细胞,再移植修复梗死心肌,可有效克服骨髓间充质干细胞存在的问题。
干细胞的心肌分化由BMP、Wnt、Ras-Raf-MPAK、FGF等信号通路共同形成的复杂的三维多重生物网络系统所调控[26]。乳鼠心脏细胞裂解液可以体外模拟心肌生长微环境[27-28],最大限度地重现了心肌定向分化生长的生物调控网络环境,促使细胞心肌分化,但究竟是哪些成分有效目前尚无相关报道。心脏细胞裂解液的制备需反复冻融,我们推测可能是其中比较稳定的小分子物质,如microRNA。但microRNA家族庞大,调控机制复杂,我们尚未进行该方向的研究。
除心脏细胞裂解液外,诱导干细胞心肌分化的方法还有用化学试剂、细胞因子诱导、物理因素诱导、用基因工程技术干扰基因表达等。其中化学试剂如5-氮胞苷、DMSO等诱导效率低,且有细胞毒性,同样对人体有害,限制了临床应用;而细胞因子常需多种细胞因子组合多个时点联合诱导[29],且价格过于昂贵;物理因素诱导分化虽然效果确切,但设备技术要求高;基因工程技术存在潜在生物安全问题。维生素C是Takahashi等[14]从可应用于人体且具有诱导胚胎干细胞分化为心肌细胞的880种分化诱导化合物中筛选而出,经大量实验研究证实可诱导胚胎干细胞[14]、诱导多能干细胞[15-16]、羊水干细胞[17]分化为心肌样细胞。我们的实验首次证明了维生素C同样可诱导DFAT细胞心肌分化,维生素C的应用避免了化学诱导的细胞毒性及基因工程技术潜在的生物安全隐患,同时,具有更好的经济效益,其机制可能与维生素C激活MEK-ERK1/2信号有关[15]。
我们体外诱导心肌分化的细胞可表达心肌特异性标志物,但均未观察到自发的收缩活动,我们称这种转分化的具有部分心肌细胞表型的细胞为心肌样细胞,与Jumabay等[12]报道的有自发收缩的类心肌细胞不完全一致。我们推测心肌样细胞的心肌分化程度较低,与细胞种属来源、培养诱导分化条件等有关。
我们在国内率先分离培养出DFAT细胞,尽管分化程度不高,但首次证明了维生素C可诱导细胞心肌分化,并且在心脏细胞裂解液体外模拟心肌微环境的条件下,可进一步提高细胞的心肌分化效率。细胞来源广泛、细胞纯度高、增殖能力强、体外心肌分化效率高,是心肌再生治疗中理想的自体移植的种子细胞。我们的实验研究为细胞的自体移植策略奠定理论和实践基础,如何进一步提高细胞的心肌分化效率和分化程度是今后细胞临床应用的重要研究方向。
[参考文献]
[1]卫生部心血管病防治研究中心.中国心血管病报告[M].北京:中国大百科全书出版社,2011: 72-75.
[2]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南[J].中华心血管病杂志,2010,38(8) :675-690.
[3]夏文杰,项鹏,张丽蓉,等.丹参酮ⅡA定向诱导骨髓间质干细胞分化为神经元样细胞的研究[J].中国病理生理杂志,2003,19(7) :865-869.
[4]王秀丽,王常勇,虞星炬,等.体外诱导小鼠胚胎干细胞分化为心肌细胞的初步研究[J].中国病理生理杂志,2005,21(3) :441-445.
[5]Ringe J,Kaps C,Burmester GR,et al.Stem cells for regenerative medicine: advances in the engineering of tissues and organs[J].Naturwissenschaften,2002,89(8) : 338-351.
[6]Li CJ,Gao RL,Yang YJ,et al.Implantation of autologous bone marrow mononuclear cells into ischemic myocardium enhances coronary capillaries and systolic function in miniswine[J].Chin Med Sci J,2008,23(4) :234-238.
[7]Qi CM,Ma GS,Liu NF,et al.Transplantation of magnetically labeled mesenchymal stem cells improves cardiac function in a swine myocardial infarction model[J].Chin Med J (Engl),2008,121(6) :544-550.
[8]Li SR,Qi XY,Hu FL,et al.Mechanisms of improvement of left ventricle remodeling by trans-planting two kinds ofautologous bone marrow stem cells in pigs[J].Chin Med J (Engl),2008,121(23) :2403-2409.
[9]de Jong R,Houtgraaf JH,Samiei S,et al.Intracoronary stem cell infusion after acute myocardial infarction: a meta-analysis and update on clinical trials[J].Circ Cardiovasc Interv,2014,7(2) :156-167.
[10]Matsumoto T,Kano K,Kondo D,et al.Mature adipocytederived dedifferentiated fat cells exhibit multilineage potential[J].J Cell Physiol,2008,215(1) :210-222.
[11]Nobusue H,Endo T,Kano K.Establishment of a preadipocyte cell line derived from mature adipocytes of GFP transgenic mice and formation of adipose tissue[J].Cell Tissue Res,2008,332(3) :435-446.
[12]Jumabay M,Zhang R,Yao Y,et al.Spontaneously beating cardiomyocytes derived from white mature adipocytes [J].Cardiovasc Res,2010,85(1) :17-27.
[13]Behfar A,Yamada S,Crespo-Diaz R,et al.Guided cardiopoiesis enhances therapeutic benefit of bone marrow human mesenchymal stem cells in chronic myocardial infarction[J].J Am Coll Cardiol,2010,56(9) :721-734.
[14]Takahashi T,Lord B,Schulze PC,et al.Ascorbic acid enhances differentiation of embryonic stem cells into cardiac myocytes[J].Circulation,2003,107 (14) : 1912-1916.
[15]Cao N,Liu Z,Chen Z,et al.Ascorbic acid enhances the cardiac differentiation of induced pluripotent stem cells through promoting the proliferation of cardiac progenitor cells[J].Cell Res,2012,22(1) :219-236.
[16]Kensah G,Roa LA,Dahlmann J,et al.Murine and human pluripotent stem cell-derived cardiac bodies form contractile myocardial tissue in vitro[J].Eur Heart J,2013,34(15) :1134-1146.
[17]陈家欢,魏育蕾,彭莎,等.猪羊水干细胞特异向跳动心肌细胞诱导分化[J].生物工程学报,2011,27(8) : 1206-1214.
[18]Jumabay M,Matsumoto T,Yokoyama S,et al.Dedifferentiated fat cells convert to cardiomyocyte phenotype and repair infarcted cardiac tissue in rats[J].J Mol Cell Cardiol,2009,47(5) :565-575.
[19]Sugihara H,Yonemitsu N,Miyabara S,et al.Primary cultures of unilocular fat cells: characteristics of growth in vitro and changes in differentiation properties[J].Differentiation,1986,31(1) :42-49.
[20]Cao F,Sun D,Li C,et al.Long-term myocardial functional improvement after autologous bone marrow mononuclear cells transplantation in patients with ST-segment elevation myocardial infarction: 4 years follow-up[J].Eur Heart J,2009,30(16) :1986-1994.
[21]Herbots L,D’Hooge J,Eroglu E,et al.Improved regional function after autologous bone marrow-derived stem cell transfer in patients with acute myocardial infarction: a randomized,double-blind strain rate imaging study[J].Eur Heart J,2009,30(6) :662-670.
[22]陈运贤,欧瑞明,钟雪云,等.自体骨髓干细胞原位移植治疗急性心肌梗死的临床研究[J].中国病理生理杂志,2003,19(4) :452-454.
[23]黄榕翀,钱菊英,葛均波.干细胞移植治疗心肌梗死后心力衰竭[J].中国医师进修杂志,2006,29(10) :1-4.
[24]Sakuma T,Matsumoto T,Kano K,et al.Mature,adipocyte derived,dedifferentiated fat cells can differentiate into smooth muscle-like cells and contribute to bladder tissue regeneration[J].J Urol,2009,182(1) :355-365.
[25]Jumabay M,Matsumoto T,Yokoyama S,et al.Dedifferentiated fat cells convert to cardiomyocyte phenotype and repair infarcted cardiac tissue in rats[J].J Mol Cell Cardiol,2009,47(5) :565-575.
[26]Verma V,Purnamawati K,Manasi,et al.Steering signal transduction pathway towards cardiac lineage from human pluripotent stem cells: a review[J].Cell Signal,2013,25(5) :1096-1107.
[27]袁岩,陈连凤,张抒扬,等.心肌细胞裂解液对骨髓间充质干细胞向心肌细胞分化诱导作用的研究[J].中华心血管病杂志,2005,33(2) :170-173.
[28]吕学祥,曾秋棠.心肌细胞裂解液诱导骨髓间充质干细胞向心肌细胞的分化作用[J].临床心血管病杂志,2008,24 (3) :217-219.
[29]Kattman SJ,Witty AD,Gagliardi M,et al.Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines[J].Cell Stem Cell,2011,8(2) : 228-240.
通讯作者△Tel: 0851-5612525; E-mail: cyzhang5828@163.com
*[基金项目]贵州省科技厅科学技术基金资助项目(No.黔科合J字[2014]2112) ;贵州省卫生厅科学技术基金资助项目(No.gzwkj2013-1-006)
[收稿日期]2014-10-08
[文章编号]1000-4718(2015)06-1130-07
[中图分类号]R329.2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.029
