骨桥蛋白通过内质网应激诱导C2C12肌细胞胰岛素抵抗*
2015-03-30张叶敏李明欣汪长华连云港市第一人民医院病理科江苏连云港00武汉大学基础医学院病理生理学教研室湖北武汉43007
刘 华,陈 昊,唐 照,张叶敏,李明欣,汪长华△(连云港市第一人民医院病理科,江苏连云港00;武汉大学基础医学院病理生理学教研室,湖北武汉43007)
骨桥蛋白通过内质网应激诱导C2C12肌细胞胰岛素抵抗*
刘华1,陈昊1,唐照2,张叶敏2,李明欣2,汪长华2△
(1连云港市第一人民医院病理科,江苏连云港222002;2武汉大学基础医学院病理生理学教研室,湖北武汉430071)
[摘要]目的:探讨骨桥蛋白(osteopontin,OPN)对C2C12肌细胞胰岛素抵抗的影响及其可能的机制。方法:低血清培养辅以胰岛素处理诱导C2C12成肌细胞分化为C2C12肌细胞,蛋白免疫印迹检测蛋白质的表达,离心法分离细胞膜,葡萄糖摄取试剂盒定量葡萄糖摄取。结果: (1)骨桥蛋白以剂量依赖和时间依赖方式抑制胰岛素刺激的蛋白激酶B(Akt)的磷酸化,并抑制胰岛素所致的葡萄糖转运体4 (Glut4)膜位移和葡萄糖的摄取;而特异性的抗OPN受体CD44抗体预处理可逆转上述变化。(2) OPN可诱导C2C12肌细胞的内质网应激,并促进c-Jun氨基端激酶(JNK)的磷酸化。(3)内质网应激抑制剂4-苯基丁酸(4-PBA)可降低OPN所增加的JNK磷酸化,恢复胰岛素刺激所致的Glut4的膜位移以及葡萄糖摄取。结论:骨桥蛋白通过诱导C2C12肌细胞内质网应激导致胰岛素抵抗。本研究为揭示骨桥蛋白在胰岛素抵抗和糖尿病中的作用提供了新的实验依据和理论解释。
[关键词]骨桥蛋白;胰岛素抵抗;内质网应激; C2C12肌细胞
[修回日期]2015-01-26
Osteopontin-induced ER stress results in insulin resistance in C2C12 myocytes
LIU Hua1,CHEN Hao1,TANG Zhao2,ZHANG Ye-min2,LI Ming-xin2,WANG Changhua2
(1Department of Pathology,The First People’s Hospital of Lianyungang,Lianyungang 222002,China;2Department of Pathophysiology,Wuhan University School of Basic Medical Sciences,Wuhan 430071,China.E-mail: chwang0525@ whu.edu.cn)
[ABSTRACT]AIM: To investigate the potential role of osteopontin (OPN) in insulin resistance in C2C12 myocytes and its underlying mechanism.METHODS: C2C12 myoblasts were induced by low concentration of serum and insulin treatment to differentiate into myocytes.Western blot was performed to detect the protein abundance and phosphorylation using specific antibodies.Plasma membrane was isolated by centrifugation.Glucose uptake was measured by glucose uptake assay.RESULTS: OPN treatment suppressed insulin-stimulated protein kinase B (Akt) phosphorylation in a dose-and time-dependent manner,accompanied with decreased membrane translocation of glucose transporter type 4 (Glut4) and reduced glucose uptake.Neutralization of OPN specific receptor in skeletal muscle with CD44 antibody mitigated OPN-induced inhibitory impact on insulin action.Furthermore,OPN treatment resulted in endoplasmic reticulum (ER) stress and phosphorylation of c-Jun N-terminal kinase (JNK).Administration of ER stress inhibitor 4-phenylbutyrate (4-PBA) diminished the detrimental effects of OPN on JNK phosphorylation,Glut4 membrane translocation and glucose uptake.CONCLUSION: ER stress mediated OPN-induced insulin resistance in C2C12 myocytes.
[KEY WORDS]Osteopontin; Insulin resistance; Endoplasmic reticulum stress; C2C12 myocytes
骨桥蛋白(osteopontin,OPN)表达在多种细胞和组织中,如纤维细胞、巨噬细胞、T细胞、平滑肌细胞、骨骼肌细胞、内皮细胞、肝细胞、脂肪细胞等,具有多种生物学功能,在炎症、肥胖、糖尿病等的发生发展中具有重要作用[1]。OPN血浆含量的增高见于肥胖和糖尿病,增加的血浆OPN含量将导致器官的巨噬细胞浸润、炎症反应、胰岛素抵抗等[2-3]。敲除OPN或者利用抗OPN抗体中和OPN,可防止高脂饮食诱导的脂肪细胞和肝细胞炎症反应、肝细胞脂肪变、肝葡萄糖异生、系统胰岛素抵抗等发生,并最终降低血糖水平[4-6]。
骨骼肌是机体运动时葡萄糖消耗的主要器官之一,其葡萄糖代谢状态在糖尿病的发生中起至关重要的作用。骨骼肌的胰岛素敏感性降低将直接导致其葡萄糖代谢失调,引发血糖增加[7]。研究发现,骨骼肌细胞可产生OPN[1],并接受OPN的调节[8],OPN可影响骨骼肌细胞的再生、纤维化以及细胞大小等[8]。但迄今为止,OPN对骨骼肌胰岛素抵抗影响的报道并不多见。本研究发现: OPN以剂量和时间依赖方式直接诱导培养的C2C12肌细胞胰岛素抵抗,其机制与OPN诱导的内质网应激(endoplasmic reticulum stress,ERS)有关。
材料和方法
1材料与试剂
鼠源OPN蛋白、结晶牛胰岛素和抗tubulin抗体购于Sigma;抗蛋白激酶B (protein kinase B,Akt)抗体、抗磷酸化Akt(p-Akt)抗体、抗葡萄糖转运体4 (glucose transporter type 4,Glut4)抗体、抗葡萄糖调节蛋白78 (glucose-regulated protein 78,GRP78)抗体、抗C/EBP同源蛋白(C/EBP homologous protein,CHOP)抗体、抗磷酸化肌醇需求酶1α(inositol-requiring enzyme 1α,IRE1α)抗体、抗胰岛素受体底物1(insulin receptor substrate 1,IRS-1)抗体和抗磷酸化IRS-1抗体购于CST;抗碱性磷酸酶标记的II抗购自Santa Cruz;内质网应激抑制剂4-苯基丁酸(4-phenylbutyrate,4-PBA)购自Calbiochem;葡萄糖摄取测定试剂盒、抗钙黏蛋白(cadherin,Cad)抗体、抗CD44抗体、抗c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)和磷酸化JNK抗体购于Abcam。
2方法
2.1细胞培养与分化C2C12成肌细胞购于ATCC,常规培养于含10%胎牛血清(fetal bovine serum,FBS)、1%青霉素/链霉素(penicillin/streptomycin,P/S)的DMEM中。C2C12肌细胞分化按文献方法进行[9-10],基本步骤如下: 100%汇合的C2C12成肌细胞继续常规培养3 d;采用含1% P/S、0.1% FBS和50 nmol/L胰岛素的DMEM诱导分化4 d,然后更换常规培养液培养。1周后,80%~100%的细胞将形成肌管,并用于实验研究。
2.2葡萄糖摄取的测定采用葡萄糖摄取测定试剂盒测定,具体操作按说明书进行。
2.3蛋白免疫印迹实验蛋白的提取与定量按本实验室以前报告的方法进行[10]。蛋白定量后的细胞裂解液与等体积的2×SDS-PAGE上样缓冲液混合,煮沸变性蛋白,14 000×g离心1 min,取上清行SDSPAGE。蛋白免疫印迹的基本流程如下:恒压100 V电泳,恒压100 V、140 min、4℃电转移蛋白至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,1%牛血清白蛋白封闭1 h,Ⅰ抗4℃孵育过夜,Ⅱ抗室温孵育1 h,碱性磷酸酶(alkaline phosphatase,AP)显色,Image-Pro Plus软件分析结果。
3统计学处理
数据均采用均数±标准差(Mean±SD)表示。组间比较计量数据资料按student t检验,计数数据按x2检验。以P<0.05为差异有统计学意义。所有实验至少重复3次以上。
结果
1骨桥蛋白以剂量依赖和时间依赖形式诱导C2C12肌细胞胰岛素抵抗
为观察OPN对骨骼肌细胞胰岛素抵抗的剂量影响,C2C12肌细胞经无血清处理4 h,然后接受0.1、1、10 mg/L的OPN处理12 h,最后用10 nmol/L胰岛素处理10 min。1 mg/L和10 mg/L浓度的OPN可有效抑制胰岛素刺激的Akt在Thr308位点的磷酸化,表明该浓度的OPN可导致胰岛素抵抗。为观察OPN诱导胰岛素抵抗的时间效应,无血清处理的C2C12肌细胞分别接受1 mg/L OPN处理6 h、12 h、18 h,最后用10 nmol/L胰岛素处理10 min。结果表明:处理12 h以上可显著降低胰岛素刺激的Akt在Thr308位点的磷酸化。为观察OPN对葡萄糖摄取的影响,C2C12肌细胞经无血清处理4 h,然后接受1 mg/L OPN处理12 h,10 nmol/L胰岛素处理10 min,结果发现: OPN可降低Glut4向质膜的位移,并抑制胰岛素对葡萄糖的转移。这一结果表明OPN处理可降低C2C12肌细胞对胰岛素作用的敏感性,见图1。
2 CD44抗体可逆转OPN对胰岛素敏感性的影响
OPN通过与跨膜蛋白,如integrin和CD44结合发挥作用[11],而C2C12细胞主要表达CD44[12]。为进一步确定OPN诱导胰岛素抵抗的作用,经无血清处理4 h的C2C12肌细胞,接受10 mg/L抗CD44抗体预处理1 h[13],然后接受1 mg/L OPN处理12 h,最后用10 nmol/L胰岛素处理10 min。CD44抗体处理可以恢复胰岛素刺激的Akt磷酸化;同时,经CD44处理的C2C12肌细胞可对抗OPN对Glut4的质膜位移和葡萄糖摄取的不利影响。结果表明: OPN主要经CD44受体蛋白发挥作用,中和其受体蛋白可抵抗OPN诱导的骨骼肌细胞胰岛素抵抗,见图2。
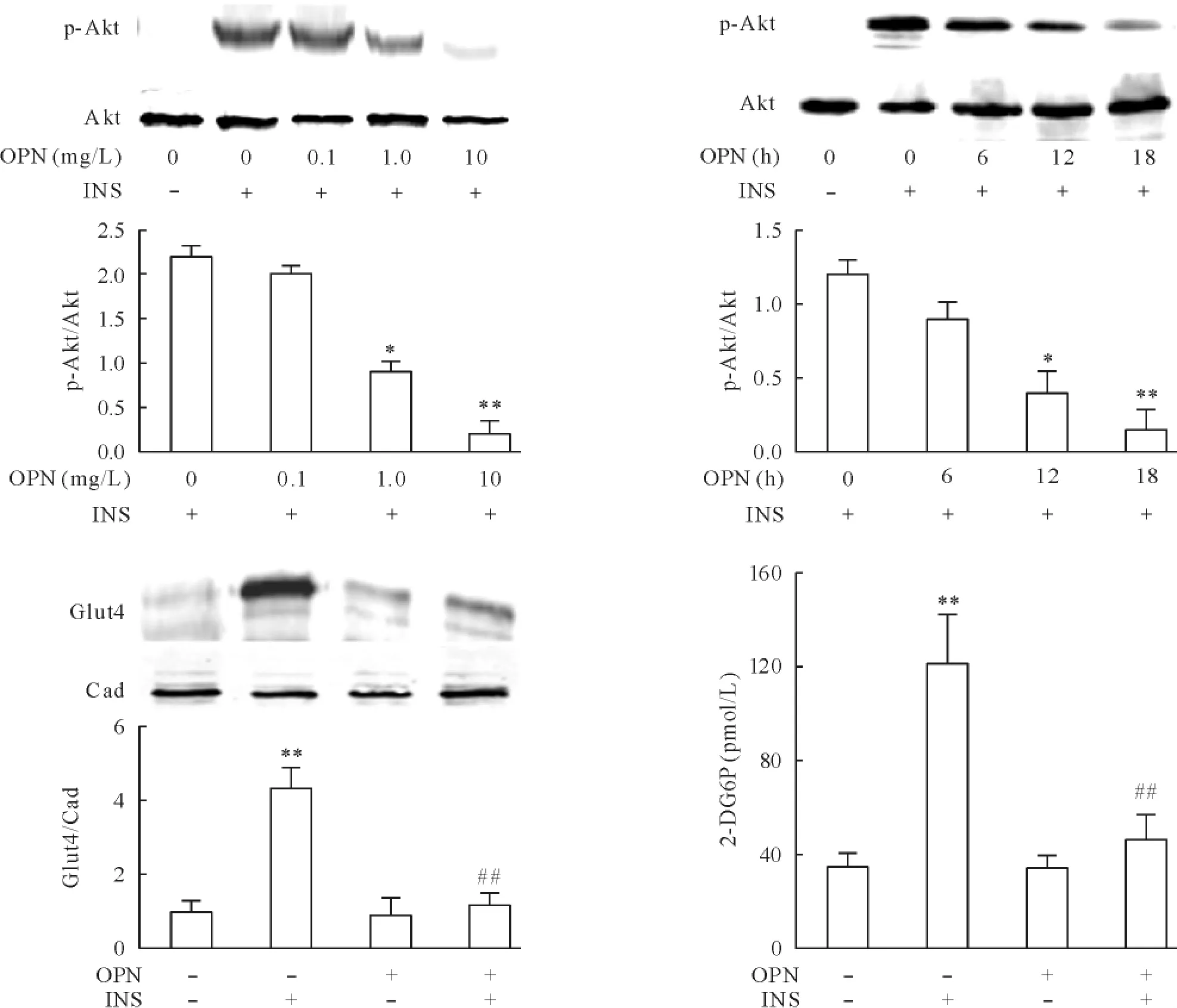
Figure 1.OPN induced insulin resistance in C2C12 myocytes.OPN: osteopontin; INS: insulin; Cad: cadherin.Mean±SD.n=4.*P<0.05,**P<0.01 vs control group;##P<0.01 vs INS group.图1骨桥蛋白诱导C2C12肌细胞胰岛素抵抗
3骨桥蛋白可诱导C2C12肌细胞内质网应激
内质网应激在胰岛素抵抗的发生中具有重要作用[14]。为研究OPN对内质网应激的可能影响,C2C12肌细胞经无血清处理4 h,然后接受1 mg/L OPN处理12 h。蛋白免疫印迹检测内质网应激标志蛋白的表达。OPN处理显著增加内质网应激标志蛋白GRP78、CHOP以及磷酸化的IRE1α的表达。当无血清处理的C2C12肌细胞经10 mg/L抗CD44抗体预处理1 h后,再接受1 mg/L OPN处理12 h,并不能增加上述内质网标志物的表达。这些结果提示: OPN可通过与CD44的结合诱导C2C12骨骼肌细胞的内质网应激,见图3。
4抑制内质网应激可减轻骨桥蛋白诱导的C2C12肌细胞胰岛素抵抗
为阐明内质网应激在OPN诱导C2C12肌细胞胰岛素抵抗中的介导作用,C2C12肌细胞经无血清处理4 h,然后同时接受1 mg/L的OPN和3 mmol/L的内质网应激抑制剂4-PBA处理12 h,以及10 nmol/L的胰岛素处理10min。结果发现,OPN可增加JNK和IRS-1丝氨酸307位点的磷酸化,而4-PBA处理可显著降低JNK和IRS-1丝氨酸307位点的磷酸化。此外,结果还显示: 4-PBA处理可逆转OPN所致的Akt在Thr308位点磷酸化的降低和IRS-1在丝氨酸307位点磷酸化的增加、Glut4膜位移减少以及葡萄糖摄取量的降低。结果提示内质网应激介导了OPN诱导的C2C12肌细胞胰岛素抵抗,见图4。
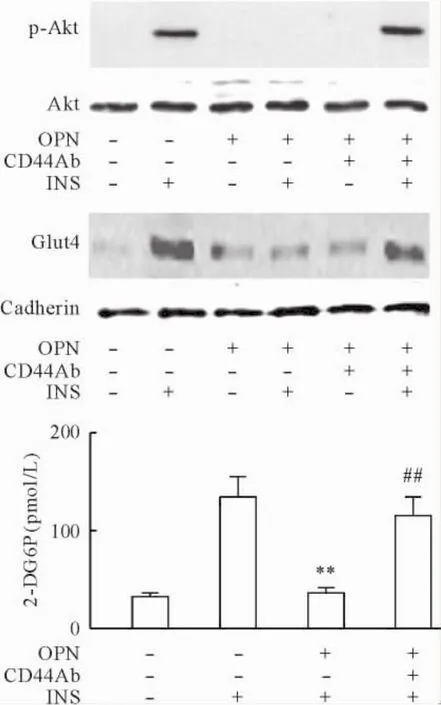
Figure 2.OPN-induced insulin resistance in C2C12 myocytes was prevented by neutralization with anti-CD44 antibody.OPN: osteopontin; Ab: antibody; INS: insulin.Mean±SD.n=4.**P<0.01 vs INS group;##P<0.01 vs OPN plus INS group.图2中和骨桥蛋白受体CD44可逆转其诱导的肌细胞胰岛素抵抗
讨论
OPN在胰岛素抵抗和糖尿病中的作用已有文献报道。OPN的高表达与胰岛素抵抗、糖尿病的发生发展密切相关,敲除或中和OPN可以起到降低系统胰岛素抵抗、降低血糖、改善糖尿病相关并发症的作用[4-6],并认为其机制与炎症反应等有关[2-3]。本研究的结果发现:骨桥蛋白以剂量依赖和时间依赖方式诱导C2C12肌细胞胰岛素抵抗,而且这一作用可被中和肌细胞上OPN受体CD44的抗体逆转。这一结果表明OPN可直接诱导肌细胞胰岛素抵抗的发生,这为OPN诱导胰岛素抵抗的机制提供了新的实验依据和理论解释。
胰岛素是由胰腺β细胞分泌的具有调节血糖作用的重要激素。胰岛素通过与其在细胞膜上的胰岛素受体结合而激活IRS-1/PI3K/Akt信号通路,使葡萄糖转移子4从胞浆向细胞膜上位移,葡萄糖借此从细胞外向细胞内转移,由此起到降低血糖的作用。在这一信号通路上的任何一个信号蛋白分子的含量降低或者功能活性下降均将导致胰岛素不能发挥正常的生理功能,即胰岛素敏感性降低或胰岛素抵抗[15]。导致胰岛素抵抗的机制有很多,内质网应激为其中的重要机制之一[14-15]。
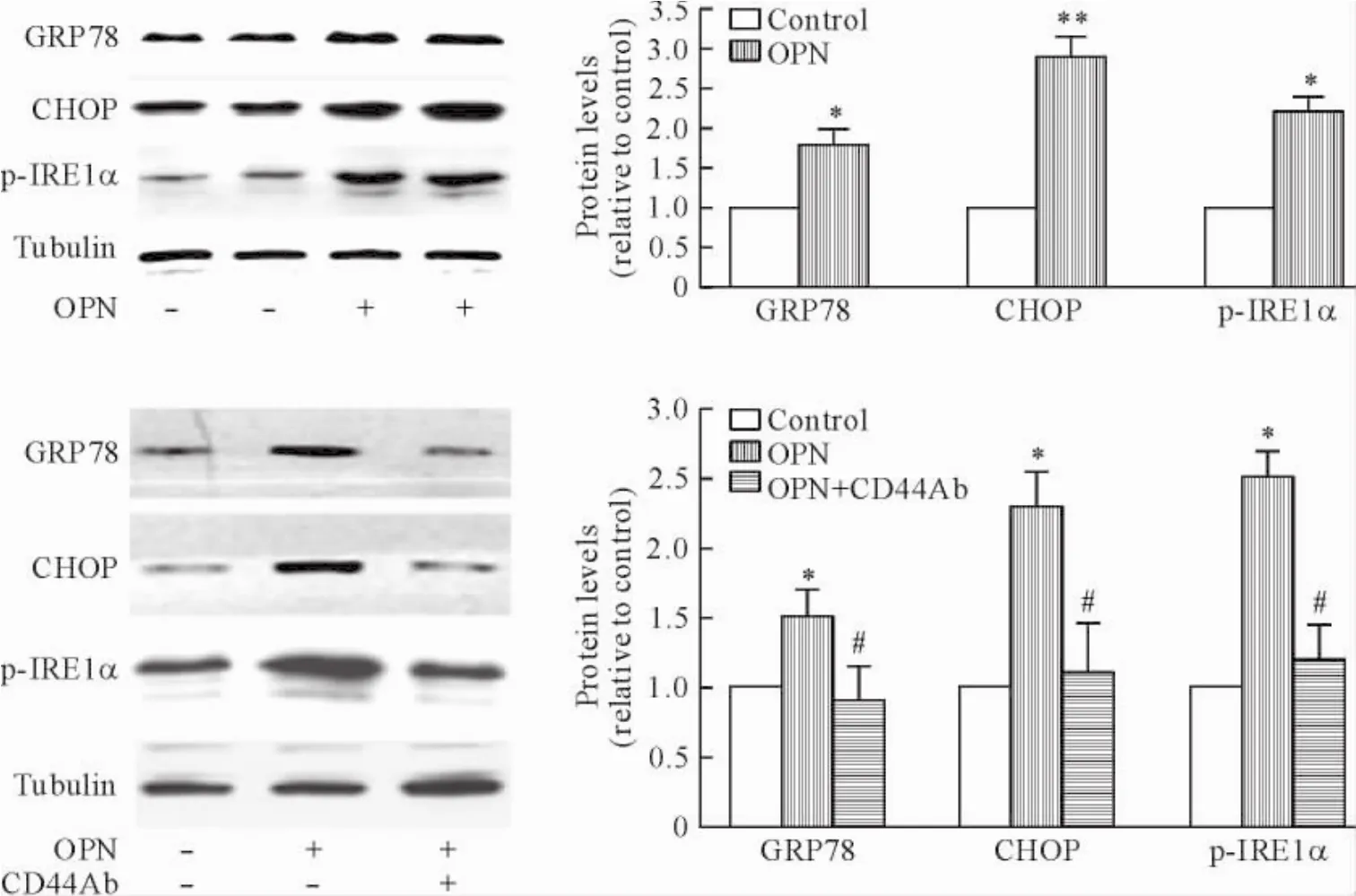
Figure 3.OPN induced ER stress in C2C12 myocytes.OPN: osteopontin; Ab: antibody.Mean±SD.n=4.*P<0.05,**P<0.01 vs control group;#P<0.05 vs OPN group.图3骨桥蛋白诱导C2C12肌细胞内质网应激
内质网为蛋白质合成、折叠、修饰的重要场所。当细胞内质网内未折叠或错误折叠的蛋白增加时,可导致内质网张力增加(即内质网应激),并由此引发内质网应激反应(即未折叠蛋白反应)。内质网应激反应可激活JNK的磷酸化,而活化的JNK将导致IRS-1丝氨酸磷酸化的增加、酪氨酸磷酸化的降低,并由此抑制PI3K/Akt信号通路,导致胰岛素抵抗的发生[14]。本研究结果发现: OPN可诱导C2C12肌细胞的内质网应激,并促进JNK磷酸化。而内质网应激抑制剂4-PBA可降低OPN所增加的JNK磷酸化,降低IRS-1丝氨酸位点的磷酸化,恢复胰岛素刺激所致的Akt磷酸化、Glut4的膜位移以及葡萄糖摄取。因此,有理由认为OPN诱导的肌细胞胰岛素抵抗通
过内质网应激介导。

Figure 4.ER stress inhibitor attenuated OPN-induced insulin resistance in C2C12 myocytes.OPN: osteopontin; INS: insulin.Mean ±SD.n=6.**P<0.01 vs INS group;##P<0.01 vs OPN plus INS group.图4内质网应激抑制剂减轻骨桥蛋白诱导的C2C12肌细胞胰岛素抵抗
总之,本研究结果表明OPN通过内质网应激诱导肌细胞胰岛素抵抗。该研究结果加深了对OPN在肥胖、胰岛素抵抗以及糖尿病中作用的认识,为抗糖尿病治疗提供了新的作用靶点。
[参考文献]
[1]Kahles F,Findeisen HM,Bruemmer D.Osteopontin: a novel regulator at the cross roads of inflammation,obesity and diabetes[J].Mol Metab,2014,3(4) :384-393.
[2]Schaller G,Aso Y,Schernthaner GH,et al.Increase of osteopontin plasma concentrations after bariatric surgery independent from inflammation and insulin resistance[J].Obes Surg,2009,19(3) :351-356.
[3]Nomiyama T,Perez-Tilve D,Ogawa D,et al.Osteopontin mediates obesity-induced adipose tissue macrophage infiltration and insulin resistance in mice[J].J Clin Invest,2007,117(10) :2877-2888.
[4]Kiefer FW,Neschen S,Pfau B,et al.Osteopontin defi-ciency protects against obesity-induced hepatic steatosis and attenuates glucose production in mice[J].Diabetologia,2011,54(8) :2132-2142.
[5]Chapman J,Miles PD,Ofrecio JM,et al.Osteopontin is required for the early onset of high fat diet-induced insulin resistance in mice[J].PLoS One,2010,5(11) : e13959
[6]Kiefer FW,Zeyda M,Gollinger K,et al.Neutralization of osteopontin inhibits obesity-induced inflammation and insulin resistance[J].Diabetes,2010,59(4) :935-946.
[7]Poelkens F,Lammers G,Pardoel EM,et al.Upregulation of skeletal muscle inflammatory genes links inflammation with insulin resistance in women with the metabolic syndrome[J].Exp Physiol,2013,98(10) :1485-1494.
[8]Pagel CN,Wasgewatte Wijesinghe DK,Taghavi Esfandouni N,et al.Osteopontin,inflammation and myogenesis: influencing regeneration,fibrosis and size of skeletal muscle[J].J Cell Commun Signal,2014,8(2) :95-103.
[9]何志义,梁毅,梁秋丽,等.香烟对小鼠C2C12成肌细胞分化的影响[J].中国病理生理杂志,2010,26(5) : 881-884.
[10]Sun S,Liu Y,Lu J,et al.The inhibitory effect of PKCθ on adiponectin expression is mediated by ERK in 3T3-L1 adipocytes[J].J Endocrinol Invest,2011,34(1) :8-15.
[11]Vetrone SA,Montecino-Rodriguez E,Kudryashova E,et al.Osteopontin promotes fibrosis in dystrophic mouse muscle by modulating immune cell subsets and intramuscular TGF-beta[J].J Clin Invest,2009,119(6) : 1583-1594.
[12]Mylona E,Jones KA,Mills ST,et al.CD44 regulates myoblast migration and differentiation[J].J Cell Physiol,2006,209(2) :314-321.
[13]Raheja LF,Genetos DC,Yellowley CE.Hypoxic osteocytes recruit human MSCs through an OPN/CD44-mediated pathway[J].Biochem Biophys Res Commun,2008,366(4) :1061-1066.
[14]Ozcan U,Cao Q,Yilmaz E,et al.Endoplasmic reticulum stress links obesity,insulin action,and type 2 diabetes [J].Science,2004,306(5695) :457-461.
[15]Ozawa K,Miyazaki M,Matsuhisa M,et al.The endoplasmic reticulum chaperone improves insulin resistance in type 2 diabetes[J].Diabetes,2005,54(3) :657-663.
通讯作者△Tel: 027-68759846; E-mail: chwang0525@ wuh.edu.cn
*[基金项目]国家自然科学基金资助项目(No.30770758/H0178)
[收稿日期]2014-12-25
[文章编号]1000-4718(2015)06-1075-06
[中图分类号]R363.2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.019
