蚯蚓活性组分对四氯化碳诱导小鼠内质网应激所致急性肝损伤的保护作用
2017-04-05赵亚飞高杨吴欣芳王建刚段冷昕
赵亚飞+高杨+吴欣芳+王建刚+段冷昕
[摘要]該研究旨在探讨蚯蚓活性组分(EWAs)对四氯化碳(CCl4)诱导小鼠内质网应激(ERS)所致急性肝损伤的保护作用。腹腔注射10%CCl4制备内质网应激所致急性肝损伤模型;血清生化指标检测ALT,AST,SOD,GSHPX酶活性及MDA含量变化;计算肝、脾指数;HE染色观察肝脏病理学变化;TUNEL法检测肝组织细胞凋亡情况;免疫组织化学法检测ERS标志性蛋白GRP78和CHOP表达情况;Western blot法检测ERS相关蛋白的表达水平。结果显示,与模型组小鼠相比,EWAs的高、中、低剂量组血清学各项指标均有显著改善(P<005或P<001),肝脏病变范围减小,且损伤程度明显减轻,小鼠肝脏指数和脾脏指数均有明显变化(P<005或P<001);各剂量给药组的肝组织细胞凋亡指数明显下降(P<005或P<001);肝组织中ERS相关蛋白GRP78和CHOP表达水平显著降低(P<005或P<001),各剂量给药组均能显著下调GRP78和CHOP以及CHOP上游信号通路PERKeIF2αATF4的蛋白表达(P<005或P<001)。综上,EWAs对ERS所致的小鼠急性肝损伤具有显著保护作用,其机制可能通过抑制氧化应激和ERS,从而减轻肝脏损伤,并可下调ERS标志性凋亡蛋白CHOP表达,抑制细胞凋亡实现的。
[关键词]蚯蚓活性组分; 内质网应激; 肝损伤; GRP78; CHOP
[Abstract]To study the protective effect of earthworm active ingredients(EWAs) against endoplasmic reticulum stress(ERS)induced acute liver injury in mice. The model of liver injury was induced through intraperitoneal injection of 10%CCl4. Serum glutamicpyruvic transaminase(ALT), glutamicoxaloacetic transaminase(AST), superoxide dismutase(SOD) and glutathione peroxidase(GSHPX) activity and malondialdehyde(MDA) concentration were detected by colorimetric method. Histological examination was performed through hematoxylineosin staining and light microscopy, and apoptosis was detected using terminal transferase dUTP nick end labeling. The expressions of ERS related proteins, including glucose regulated protein 78(GRP78), protein kinase Rlike ER kinase(PERK), eukaryotic transcription initiation factor 2α(eIF2α), active transcription factor4(ATF4) and CCAAT/enhancer binding homologous protein(CHOP), were measured by immunohistochemistry and Western blot. According to the results, compared with the model group,serological indexes in the high, middle and low doses of EWAs were significantly improved (P<0.05 or P<0.01), the extent of liver lesion was decreased and the degree of injury was significantly reduced, and that the liver index and the spleen index of mice were significantly changed(P<0.05 or P<0.01). In liver tissue, the expressions of GRP78 and CHOP were significantly decreased(P<0.05 or P<0.01). The protein expressions of GRP78, CHOP and its upstream signaling pathway PERKeIF2ATF4 were significantly decreased in each dose group(P<0.05 or P<0.01). In summary, EWAs has a significant protective effect on ERSinduced acute liver injury, and its mechanism may be correlated with the inhibition of oxidative stress and ERS, and downregulation of ERS marker protein CHOP expression, andinhibition of apoptosis.
[Key words]EWAs; ERS; liver injury; GRP78; CHOP
肝脏疾病是影响人类健康最为常见的疾病之一,从传统中药或食物中寻找有效部位或有效成分治疗肝脏疾病已成为目前研究的热点[1]。蚯蚓是一种平肝潜阳的传统中药,《神农本草经》上记载该药性味咸、寒,归肝、脾、膀胱经。现代研究发现蚯蚓具有调节免疫系统、肝脏和肾脏功能、心血管系统、抗肿瘤和抗氧化作用等[2]。本课题组前期研究发现,蚯蚓活性组分(earthworm active ingredients,EWAs)对衣霉素诱导的内质网应激(endoplasmic reticulum stress,ERS)所致的L02细胞(人正常肝细胞系)损伤具有显著的保护作用,可以促进受损细胞的增殖,减轻ERS,抑制ERS所介导的细胞凋亡[3]。本研究旨在探讨EWAs对四氯化碳(CCl4)诱导小鼠ERS所致急性肝损伤是否有保护作用及其可能作用机制。
1材料
11药品与试剂EWAs是本实验室由新鲜冰冻蚯蚓(赤子爱胜蚯蚓)获得[4],储存于-20 ℃,黄白色絮状物,易溶于水,含多肽(75%),多糖(17%),维生素D和无机盐(如钙和磷);谷丙转氨酶(ALT)、谷草转氨酶(AST)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSHPX)、超氧化物歧化酶(SOD)试剂盒均购于南京建成生物工程研究所;TUNEL试剂盒(美国Roche公司);兔IgG免疫组化试剂盒(博士德生物工程有限公司);双链RNA活化蛋白激酶样内质网激酶(protein kinase Rlike ER kinase,PERK)、活化转录因子 4(active transcription factor4,ATF4)抗体(美国Santa Cruz公司);真核转录起始因子2α(eukaryotic transcription initiation factor 2α,eIF2α),CCAAT/增强子结合蛋白(CCAAT/enhancer binding homologousprotein,CHOP)抗体(美国Proteintech Group公司);葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)抗体(美国Abcam公司)。
12动物清洁级健康昆明种小鼠,雄性,由华中科技大学同济医学院实验动物中心提供,许可证号SCXK(鄂)20100007。
2方法
21急性肝损伤模型建立及给药方案将50只健康雄性小鼠随机分为5组,正常组、模型组、EWAs低剂量组(EWAsL,3 mg·kg-1·d-1)、EWAs中剂量组(EWAsM,6 mg·kg-1·d-1)、EWAs高剂量组(EWAsH,12 mg·kg-1·d-1)。实验前适应性喂养1周。正常组和模型组每天皮下注射等体积生理盐水,给药组皮下注射不同剂量EWAs,连续10 d。末次给药8 h后,除正常组外,其余组腹腔注射10%CCl4[5]大豆油溶液(001 mL·g-1),禁食不禁水,24 h后,摘眼球取血,脱臼处死,摘取肝脏及脾脏,称重。
22生化指标检测摘眼球取血,离心(3 000 r·min-110 min),取血清,按照相关试剂盒说明测定ALT,AST,MDA,GSHPX和SOD含量。
23肝脏、脾脏指数计算肝脏指数(mg·g-1)=肝脏质量(mg)/体重(g),脾脏指数(mg·g-1)=脾脏质量(mg)/体重(g)。
24HE及免疫組织化学染色取肝脏组织相同部位固定于10%甲醛溶液中,石蜡包埋,4 μm切片,HE染色后,光学显微镜下观察组织病理变化。免疫组织化学染色程序:脱蜡,水化,3%H2O2室温孵育10 min,热抗原修复每次10 min(重复3次),5%BSA封闭30 min(37 ℃恒温箱),一抗4 ℃过夜孵育:GRP78(1∶250),CHOP(1∶50),PBS洗3遍(每次5 min),二抗孵育30 min(37 ℃恒温箱),PBS洗,DAB显色,苏木精复染45 s,脱水,透明,封片,拍照。利用Image Pro Plus 60软件对染色结果进行分析处理。
25肝组织细胞凋亡检测采用TUNEL法检测肝脏细胞的凋亡情况,以细胞核呈棕褐色为阳性染色。肝组织切片厚度4 μm,脱蜡、水化;蛋白酶K通透30 min(37 ℃恒温箱);PBS漂洗3次,加TUNEL反应混合液(TdT荧光素标记的dUTP 1∶9)进行标记反应,37 ℃恒温箱中孵育30 min;DAB显色,脱水,透明,封片。结果处理:在光学显微镜(×400)下随机选取5个不同的视野,分别计数其中的总的细胞数和凋亡细胞数,然后计算凋亡率。凋亡率=凋亡细胞数/细胞总数×100%。
26Western blot法检测肝组织GRP78和CHOP 及其上游通路PERKeIF2αATF4表达情况称取肝脏组织1 g,加入1 mL细胞裂解液,研磨提取总蛋白,冰浴30 min,4 ℃离心(12 000 r·min-110 min)取上清,测定蛋白含量(BCA法)。取100 μg蛋白样品进行SDSPAGE电泳,转膜(400 mA,90 min),5%脱脂奶粉室温封闭1 h,一抗4 ℃过夜孵育:GRP78(1∶1 000),CHOP(1∶500),PERK(1∶200),eIF2α(1∶200)和ATF4(1∶200),二抗孵育1 h(室温),暗室中ECL发光液显色,扫描结果。用GelPro Analyzer分析其灰度值,经βactin结果校正后,比较各组相对灰度值。
27统计学分析采用SPSS 170统计软件进行统计学分析,结果用±s表示,不同组间采用单因素方差分析,P<005为有统计学意义。
3结果
31EWAs对ERS所致急性肝损伤小鼠血清学指标影响与正常组相比,模型组小鼠血清中ALT和AST水平及其MDA含量显著升高(P<001),SOD和GSHPX活性显著降低(P<001)。与模型组相比,EWAs低、中、高各剂量组小鼠血清中ALT和AST水平及其MDA含量均明显降低(P<005或P<001),SOD和GSHPX活性显著升高(P<001),且具有剂量依赖性,见表1。
32EWAs对ERS所致急性肝损伤小鼠肝脏指数和脾脏指数影响模型组较正常组肝脏指数明显增高(P<001),脾脏指数显著减小(P<001),与模型组相比,高、中、低剂量组各项指标均有显著改善,具有统计学意义(P<005或P<001),见表2。
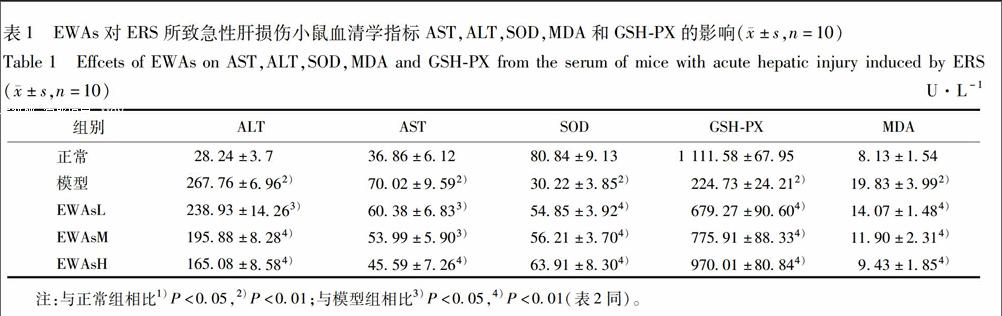
33EWAs对ERS所致急性肝损伤小鼠肝组织病理学变化影响正常组小鼠肝组织中肝细胞围绕中央静脉呈放射状排列,肝小叶结构正常,模型组小鼠肝脏肿大,胞质疏松,出现明显的片状坏死和气球样变,高、中、低给药组小鼠肝脏病变范围减小,且损伤程度随着药物浓度的增大而逐步减轻,见图1。
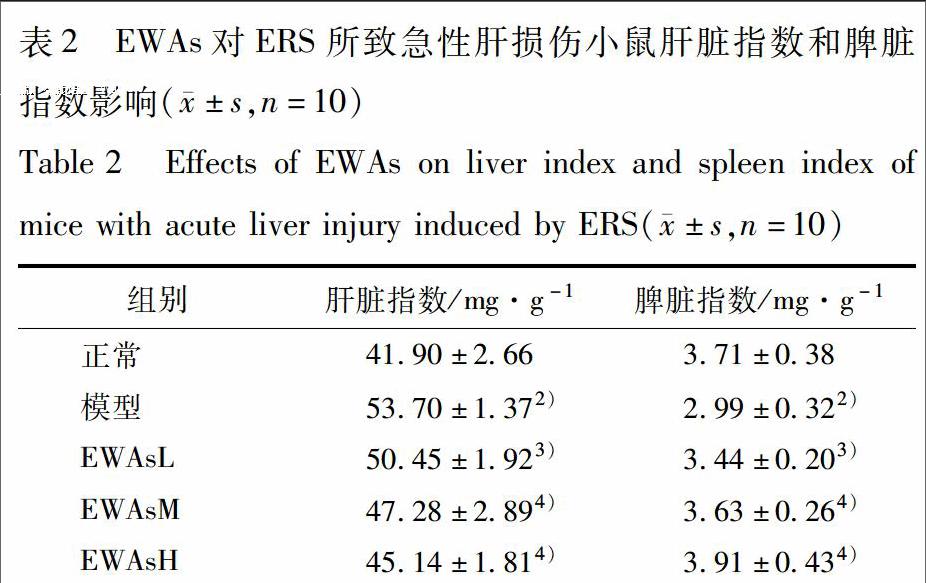
34EWAs对ERS所致急性肝损伤小鼠肝脏细胞凋亡情况的影响正常组小鼠肝脏细胞无明显凋亡,而模型组小鼠肝脏细胞大量凋亡,凋亡指数明显增高(P<001)。与模型组相比,各给药组小鼠肝脏细胞凋亡指数均显著降低(P<005或P<001),见图2。
35EWAs对ERS所致急性肝损伤小鼠肝组织中GRP78和CHOP表达情况影响模型组ERS标志性蛋白GRP78和CHOP表达水平显著升高(P<001),中、高剂量组中GRP78蛋白显著降低(P<001),见图3,CHOP表达显著下调(P<001),见图4。
36EWAs对ERS所致急性肝损伤小鼠肝组织中ERS相关蛋白表达水平影响模型组ERS标志性蛋白GRP78,CHOP及上游信号通路PERKeIF2αATF4表达水平显著升高(P<001),各给药组的ERS相关蛋白因子PERK,GRP78和eIF2α表达水
A正常组;B模型组;CEWAsL;DEWAsM;EEWAsH(图2~5同)。
与正常组相比1)P<005,2)P<001;与模型组相比3)P<005,4)P<001(图3~5同)。
平均降低,呈一定剂量依赖性,具有统计学意义(P<005或P<001),中、高剂量组中ATF4和CHOP蛋白表达显著降低(P<001),见图5。
4讨论
研究发现EWAs作为一种新型的保肝药物,其主要成分是相对分子质量在20 kDa以下的小肽类物质,因此选择皮下注射的给药方式。根据EWAs的急性毒性实验结果确定该给药方式下的高、中、低给药剂量。预先给EWAs 10 d,腹腔注射CCl4建立内质网应激所致急性肝损伤模型,继续给药1 d,24 h处死小鼠,取样。病理学结果显示高剂量组未使肝脏损伤恢复到正常水平,可能是损伤后给药时间过短。
CCl4是一种诱导肝脏损伤的经典化学物质,所致的肝细胞损伤使细胞膜结构和功能发生改变,产生活性氧攻击内质网[6],导致过氧化和错误折叠蛋白质在内质网腔中堆积,诱导ERS[7],降低抗氧化
能力,导致自由基增加,从而破坏细胞结构和功能,最终导致细胞死亡[8]。本实验中,模型组小鼠血清中 ALT,AST,MDA含量均显著升高,而SOD,GSHPX酶活性明显降低,提示小鼠体内抗氧化能力明显下降,可能发生了氧化应激,出现了急性的肝组织损伤。而给予EWAs治疗的小鼠各项指标均有了显著改善,这也提示EWAs在动物体内具有显著的抗氧化作用,可能通过减轻氧化应激损伤发挥其保护作用。
正常生理情况下,GRP78作为一种重要分子伴侣结合蛋白,与内质网膜上感受态蛋白PERK、激活作用转录因子6(activating transcription factor 6,ATF6)、肌醇酶1α(inositolrequiring enzyme1α,IRE1α)相結合,形成复合物,使感受态蛋白处于未活化状态。致病因子作用下,GRP78从感受态蛋白上解离,识别和结合内质网腔积累的未折叠蛋白,启动一系列细胞内信号转导反应,诱导ERS[9]。强烈
或长时间的ERS,使机体内GRP78高度表达,因此GRP78的表达水平可以作为ERS发生的标志之一[10]。ERS发生时,GRP78从感受态蛋白上解离,从而使PERK,ATF6和IRE1这3个膜感受态蛋白活化,进而激活由这3个蛋白介导的信号通路,启动下游凋亡因子CHOP的表达[11],其中PERKeIF2αATF4途径是启动CHOP表达所必须的[12],且活性强于其他通路[13]。本实验中,重点探讨了CCl4诱导的小鼠肝细胞ERS时,GRP78和CHOP[14]以及其上游的PERKeIF2αATF4通路蛋白表达情况,结果发现,模型组小鼠肝组织中GRP78和CHOP蛋白水平明显升高,且CHOP上游的PERKeIF2αATF4通路蛋白表达也均显著上调,提示模型组小鼠肝组织可能发生了ERS时CHOP介导的细胞凋亡,TUNEL实验结果也证明有大量肝脏组织细胞凋亡。而EWAs给药组的各项指标均有了明显的改善,且表现出一定的剂量依赖性,因此,EWAs对CCl4诱导小鼠ERS所致急性肝损伤的保护作用可能与其下调PERKeIF2αATF4通路蛋白表达,继而减少CHOP表达,抑制CHOP介导的细胞凋亡,减轻ERS有关。
综上,本研究初步探讨了蚯蚓活性组分对CCl4诱导小鼠ERS所致急性肝损伤的保护作用及可能作用机制,为深入研究急性肝损伤发生机制提供了新的参考,也为蚯蚓活性组分最终作为一类保肝药物在临床上应用奠定了实验基础。
[参考文献]
[1]Chen Wei,He Ying,Jiang Dingwen,et alProtective effect of Fomes fomentarius extracts on CCl4induced acute liver injury in mice[J]Lishizhen Med Mater Med Res,2013,24(3):605
[2]祝未名中药地龙的活性成分与药理作用研究[J]海峡药学, 2013,25(4):25
[3]Wang Q, Duan L X, Xu Z S,et alThe protective effect of the earthworm active ingredients on hepatocellular injury induced by endoplasmic reticulum stress[J]Biomed Pharmacother, 2016,82:304
[4]河南科技大学 一种蚯蚓提取物及其提取方法和应用:中国, 2012100146536[P] 20120116
[5]黎永华,陶力内质网应激在小鼠急性肝损伤中的作用机制[J]广东医学,2015,36(1):35
[6]Marumoto Y,Terai S, Urata Y,et al Continuous high expression of XBP1 and GRP78 is important for the survial of bone marrow cells in CCl4treated cirrhotic liver[J]Biochem Biophys Res Commun, 2008, 367(3):546
[7]Ryusuke Akihara,Takujiro Homma, Jaeyong Lee, et alAblation of aldehyde reductase aggravates carbon tetrachlorideinduced acute hepatic injury involving oxidative stress and endoplasmic reticulum stress[J]Biochem Biophy Res Commun,2016,478(2): 765
[8]Afzal M,Khan R,KazmiI,et alHepatoprotective potential of new steroid against carbon tetrachlorideinduced hepatic injury[J].Mol Cell Biochem,2013, 2: 355
[9]Parmar V M, Schroder M Sensing endoplasmic reticulum stress[J]Adv Exp Med Biol, 2012, 738:153
[10]Schnthal A H Pharmacological targeting of endoplasmic reticulum stresssignaling incancer[J]Biochem Pharmacol, 2013,85: 653
[11]Rozpdek W, Pytel D,Mucha B The role of the PERK/eIF2α/ATF4/CHOP signaling pathway in tumor progression during endoplasmic reticulum stress[J]Author Manuscript, 2016,16(6): 533
[12]Yang ShuangYan, Wei FuLan, Hu LiHua,et alPERKeIF2αATF4 pathway mediated by endoplasmic reticulum stress response is involved in osteodifferentiation of human periodontal ligament cells under cyclic mechanical force[J]Cell Signal, 2016,28:880
[13]Rao J, Zhang C, Wang P,et alC/EBP homologous protein (CHOP) contributes to hepatocyte death via the promotion of ERO1α signalling in acute liver failure[J]Biochem, 2015, 466(2):369
[14]Chen L, Ren F, Zhang H, et al Inhibition of glycogen synthase kinase 3β ameliorates DGalN/LPSinduced liver injury by reducing endoplasmic reticulum stresstriggered apoptosis[J] PLoS ONE, 2012,7(9):e45202
[責任编辑张宁宁]
