iPSC-MSCs对CoCl2诱导的PC12细胞损伤时线粒体功能的影响*
2015-03-30孙占朋胡春林荆小莉魏红艳廖晓星中山大学附属第一医院急诊科广东广州510080
杨 焰,李 慧,孙占朋,胡春林,荆小莉,魏红艳,廖晓星,李 欣(中山大学附属第一医院急诊科,广东广州510080)
iPSC-MSCs对CoCl2诱导的PC12细胞损伤时线粒体功能的影响*
杨焰,李慧,孙占朋,胡春林,荆小莉,魏红艳,廖晓星,李欣△
(中山大学附属第一医院急诊科,广东广州510080)
[摘要]目的:观察诱导性多能干细胞来源的间充质干细胞(iPSC-MSCs)对氯化钴(CoCl2)诱导的PC12细胞损伤的影响,并探讨其可能机制。方法:用CoCl2处理PC12细胞建立化学损伤模型,加入iPSC-MSCs共培养。用细胞计数试剂盒-8(CCK-8)比色法检测细胞存活率,Annexin V/PI双染流式细胞术检测细胞凋亡比率,JC-1染色流式细胞术检测细胞线粒体膜电位,免疫荧光观察iPSC-MSCs向PC12细胞转移线粒体的情况。结果:用CoCl2(400 μmol/L)处理PC12细胞24 h可使其凋亡明显增多,线粒体膜电位明显下降。与iPSC-MSCs共培养能减轻PC12细胞的凋亡,使其膜电位恢复。iPSC-MSCs可以与PC12细胞间形成隧道纳米管并向PC12细胞转移线粒体。结论: iPSC-MSCs可以减轻CoCl2诱导的PC12细胞损伤,机制可能与其向PC12细胞转移线粒体有关。
[关键词]氯化钴; PC12细胞;细胞凋亡;诱导性多能干细胞;线粒体
[修回日期]2015-03-30
Effects of iPSC-MSCs on mitochondria of PC12 cells injured by CoCl2
YANG Yan,LI Hui,SUN Zhan-peng,HU Chun-lin,JING Xiao-li,WEI Hong-yan,LIAO Xiao-xing,LI Xin
(Department of Emergency,The First Affiliated Hospital of Sun Yat-sen University,Guangzhou 510080,China.E-mail: xlidoct@ qq.com)
[ABSTRACT]AIM: To investigate the effects of induced pluripotent stem cells-derived mesenchymal stem cells (iPSC-MSCs) on cobalt chloride (CoCl2) -induced injuries of PC12 cells and its possible mechanism.METHODS: PC12 cells were exposed to CoCl2to set up a chemical-induced cellular injury model and were cocultured with iPSC-MSCs.The cell viability was tested by CCK-8 assay.The apoptosis was measured by flow cytometry using Annexin V/PI staining.The mitochondrial membrane potential (MMP) was analyzed by flow cytometry using JC-1 staining.Immunofluorescence was employed to observe mitochondrial transfer from iPSC-MSCs to PC12 cells.RESULTS: Apoptosis of PC12 cells was increased and MMP of PC12 cells was decreased after exposed to CoCl2at concentration of 400 μmol/L for 24 h.Coculture of PC12 cells with iPSC-MSCs reduced the apoptosis and recovered the MMP of the PC12 cells.Tunneling nanotubes were formed between iPSC-MSCs and PC12 cells,through which the iPSC-MSCs transferred the mitochondria to the PC12 cells.CONCLUSION: iPSC-MSCs protect PC12 cells from CoCl2-induced injuries,which may be associated with the mitochondrial transfer from iPSC-MSCs to PC12 cells.
[KEY WORDS]Cobalt chloride; PC12 cells; Apoptosis; Induced pluripotent stem cells; Mitochondria
缺血缺氧性脑损伤患者远期神经功能缺损严重影响其生活质量,甚至导致患者死亡[1]。目前已有应用干细胞治疗缺血缺氧性脑损伤的报道。多数学者认为其治疗作用机制可能涉及干细胞的旁分泌、转分化、减轻局部组织炎症反应以及促进血管生成等方面[2-3]。2012年Islam等[4]在Nature Medicine上首次报道,骨髓间充质干细胞可以与Ⅱ型肺泡上皮细胞间形成隧道纳米管(tunneling nanotubes,TNTs),并通过这些纳米管转移线粒体到Ⅱ型肺泡上皮细胞,使受损肺泡恢复生物学活性,减轻脓毒症所致的小鼠急性肺损伤。早前报道骨髓间充质干细胞可向心肌细胞转移线粒体[5],而关于干细胞能否转移线粒体到神经元进而治疗缺血缺氧性脑损伤未见相关报道。为此,我们在体外建立CoCl2诱导PC12细胞化学缺氧损伤模型,加入诱导性多能干细胞来源的间充质干细胞(induced pluripotent stem cells-derived mesenchymal stem cells,iPSC-MSCs)与之共培养,观察iPSC-MSCs是否可向PC12细胞转移线粒体,探讨iPSC-MSCs保护PC12细胞减轻损伤的作用及其可能机制。
材料和方法
1细胞培养
PC12细胞购自中科院上海细胞库,转染了绿色荧光蛋白(green fluorescent protein,GFP)的iPSCMSCs(GFP-iPSC-MSCs)及N1-iPSC-MSCs由香港大学连其周教授提供。PC12细胞及GFP-iPSC-MSCs置于含10%胎牛血清(Gibco)的DMEM高糖培养基(HyClone)中培养,N1-iPSC-MSCs置于含10%胎牛血清、1% MEM非必需氨基酸(Gibco)和1% GlutaMAX Supplement(Gibco)的DMEM高糖培养基中培养。选取对数生长期细胞进行实验。
2实验分组
根据是否使用CoCl2诱导损伤及iPSC-MSCs干预处理将PC12细胞分为3组: (1)正常对照(control)组; (2) CoCl2组:根据CoCl2(Sigma)处理浓度将PC12细胞分为0 μmol/L、200 μmol/L、400 μmol/L 和600 μmol/L CoCl2共4组,每组5例; (3) CoCl2+ GFP-iPSC-MSCs组。各组PC12细胞均以每孔1.5× 105接种于6孔板,接种24 h后正常对照组继续以普通培养基培养,CoCl2组及CoCl2+ GFP-iPSC-MSCs组以含400 μmol/L CoCl2的培养基培养24 h,继之CoCl2组更换为不含CoCl2的培养基继续培养24 h,CoCl2+ GFP-iPSC-MSCs组每孔加入1.5×105GFP-iPSC-MSCs细胞共培养24 h。
3实验方法
3.1细胞存活率测定使用细胞计数试剂盒-8 (Cell Counting Kit-8,CCK-8; Dojindo)检测细胞存活率。PC12细胞以每孔1×104接种于96孔板,各组设置5个复孔。培养24 h后根据实验需要各组分别加入含不同浓度CoCl2的培养基处理24 h。终止培养后向每孔中加入10 μL的CCK-8溶液,37℃孵育1.5 h,用酶标仪测定每孔在450 nm波长处的吸光度A值。取各组5个复孔的平均值,按下列公式计算存活率:存活率(%)=(实验组A值-空白组A值)/(正常对照组A值-空白组A值)×100%。实验重复5次。
3.2流式细胞术(AnnexinV-APC/PI双染)检测细胞凋亡PC12细胞以每孔1.5×105接种于6孔板,按不同实验分组对各组细胞进行处理。消化收集各组细胞,洗涤2遍。加入500 μL的binding buffer重悬后加入5 μL Annexin V-APC染液(凯基生物),混匀后再加入5 μL PI染液(凯基生物)。室温下避光反应15 min,用流式细胞仪(Beckman-Gallios)进行检测。实验重复3次。
3.3流式细胞术(JC-1染色)检测线粒体膜电位用终浓度2 μmol/L的分子探针Cell Trace Violet对PC12进行染色标记。将标记后的PC12细胞以每孔1.5×105接种于6孔板,按不同实验分组对各组细胞进行处理。消化收集各组细胞,用1 mL PBS重悬,每管加入浓度为1 μmol/L的JC-1(Abcam)染料2 μL,37℃孵育30 min。洗涤1次,弃上清,用300 μL PBS重悬细胞,上流式细胞仪检测。实验重复3次。
3.4免疫荧光染色观察线粒体转移以10 μmol/L终浓度的分子探针CFSE对PC12进行染色标记,以终浓度200 nmol/L分子探针MitoTracker Red对N1-iPSC-MSCs进行染色标记。分别消化收集2种细胞,以每种细胞每孔1×104接种于含多聚赖氨酸爬片的24孔板中进行共培养。24 h后收集细胞爬片。PBS 洗3遍,加入4%多聚甲醛固定细胞10 min,PBS洗3遍,DAPI染色后封片,置于荧光显微镜下观察摄片。
4统计学处理
实验数据经SigmaPlot 12.3软件进行统计学分析,数据用均数±标准差(mean±SD)表示,用单因素方差分析进行多组比较,用LSD-t检验进行两两比较,以P<0.05为差异有统计学意义。
结果
1 CoCl2呈浓度依赖性地降低PC12细胞的存活率
CCK8-结果显示随着CoCl2浓度的增加,24 h后PC12细胞的存活率逐渐下降(P<0.01)。200 μmol/L、400 μmol/L和600 μmol/L浓度CoCl2处理PC12细胞24 h后,PC12细胞的存活率分别为82.7%±9.2%、49.9%±9.0%和33.0%±9.7%。本实验选取400 μmol/L作为CoCl2的损伤浓度,见图1。

Figure 1.The effect of different concentrations of CoCl2on viability of the PC12 cells.Mean±SD.n=5.**P<0.01 vs control group.图1 CoCl2对PC12细胞存活率的影响
2 iPSC-MSCs对CoCl2诱导PC12细胞凋亡的抑制作用
FL1通道(GFP)阴性细胞群为PC12细胞,对其设门进行流式细胞术分析。结果显示,使用400 μmol/L CoCl2处理PC12细胞24 h可使其凋亡率显著增高达到34.6%±7.0%(P<0.01)。在CoCl2处理PC12细胞后加入GFP-iPSC-MSCs与其共培养,能减轻CoCl2所诱导的PC12细胞凋亡,使其凋亡率下降至28.1%±2.0%。与400 μmol/L CoCl2处理组比较,差异显著(P<0.05),说明iPSC-MSCs能抑制CoCl2诱导的PC12细胞凋亡,见图2。
3 iPSC-MSCs对抗CoCl2对PC12细胞线粒体膜电位的损伤
FL9通道(CellTrace Violet)阳性细胞群为PC12细胞,对其设门进行流式细胞术分析。结果显示,使用400 μmol/L CoCl2处理PC12细胞24 h可使其膜电位高的细胞显著减少,达56.2%±10.4% (P<0.01)。在CoCl2处理PC12细胞后加入GFP-iPSCMSCs与其共培养可使PC12细胞中膜电位高的细胞比例恢复至72.7%±1.2%,与400 μmol/L CoCl2处理组比较,差异显著(P<0.01)。提示iPSC-MSCs可逆转CoCl2所致的PC12细胞线粒体膜电位变化,见图3。
4 iPSC-MSCs可以通过细胞间接触向PC12细胞转移线粒体
如图4所示,CFSE标记的PC12细胞发出绿色荧光,MitoTracker Red标记N1-iPSC-MSCs的线粒体使其呈红色,DAPI标记细胞核呈蓝色。共培养24 h后可见N1-iPSC-MSCs与PC12细胞之间形成很长的隧道纳米管,在绿色荧光的PC12细胞胞浆中出现了颗粒样的红色荧光,提示N1-iPSC-MSCs将部分线粒体转移至PC12细胞中,见图4。
讨论
本文再次证实,化学性缺氧模拟剂CoCl2能使PC12细胞存活率降低,该作用呈剂量依赖性[6]。当使用400 μmol/L CoCl2处理PC12细胞24 h后,细胞凋亡增多,线粒体膜电位降低。这些结果均与文献报道一致[7]。已有文献报道,骨髓间充质干细胞能减轻CoCl2所致的PC12细胞损伤[8],我们在使用iPSC-MSCs与受损的PC12细胞共培养后观察到了同样的作用。
脑缺血缺氧损伤后细胞可通过线粒体凋亡通路、死亡受体通路以及内质网通路发生凋亡,而其中线粒体凋亡通路是主要途径[9]。Bcl-2家族蛋白可对此凋亡过程进行调控,而该调控过程与线粒体密不可分[10]。因此,线粒体在脑缺血缺氧损伤后的病理生理过程中处于重要地位,以恢复线粒体功能为靶目标的治疗也受到越来越多学者的关注[11]。
在体外实验中已有学者证实,骨髓间充质干细胞可以转移线粒体到心肌细胞[5]、肺泡上皮细胞[12]、血管内皮细胞[13],使细胞凋亡减少,细胞氧化呼吸功能恢复,ATP生成增多。在我们的实验中,我们同样也观察到iPSC-MSCs可以与PC12细胞之间形成很长的TNTs,向PC12细胞转移线粒体,使PC12细胞的线粒体膜电位恢复,凋亡减少。
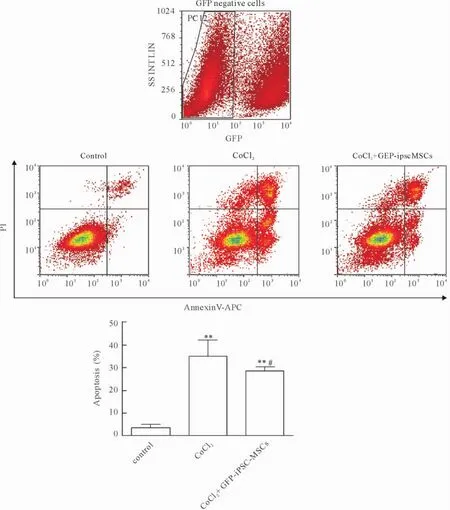
Figure 2.iPSC-MSCs protected PC12 cells against CoCl2-induced apoptosis.Mean±SD.n=3.**P<0.01 vs control group;#P<0.05 vs CoCl2group.图2 iPSC-MSCs抑制CoCl2诱导的PC12细胞凋亡
在本实验中,受损PC12细胞线粒体膜电位的恢复可能与iPSC-MSCs转移正常的线粒体到其胞浆中,使JC-1的释放减少有关。此外,转移的线粒体可能可以为受损的PC12细胞提供ATP,恢复受损细胞的能量代谢,进而减少细胞凋亡。
决定干细胞向靶细胞转移线粒体的关键因素之一是2种细胞间可以形成连接通道供线粒体通过。在脓毒症所致小鼠的急性肺损伤模型中,受损肺泡表达Cx43增多,促进了干细胞在局部的滞留,肺泡上皮细胞与骨髓间充质干细胞之间形成隧道纳米管TNTs,继而干细胞向肺泡上皮细胞转移线粒体发挥保护作用[4]。在脑损伤时,Cx43的表达同样是增高的[14]。据此我们可以推测,脑损伤时Cx43表达的增加也可以促进干细胞在局部停留并与神经元形成接触,发挥干细胞线粒体转移的保护作用。我们的合作者连其周教授课题组发现,相对于骨髓来源的间充质干细胞而言,iPSC-MSCs转移线粒体的效率更高,治疗作用更强[15]。因此,相对于使用骨髓间充质干细胞治疗脑损伤而言,iPSC-MSCs可能是一个更好的选择。目前已有学者[16]通过修饰骨髓间充质干细胞使其表达Miro1增高,提高线粒体转移的效率和保护作用。Cx43也可能成为修饰iPSC-MSCs提高其转移线粒体效率治疗脑损伤的潜在靶点之一。

Figure 3.iPSC-MSCs recovered MMP of PC12 cells exposed to CoCl2.Mean±SD.n=3.**P<0.01 vs control group;#P<0.05 vs CoCl2group.图3 iPSC-MSCs对抗CoCl2对PC12细胞线粒体膜电位的损伤
综上所述,本研究首次证实iPSC-MSCs与PC12细胞间可以形成TNTs并转移线粒体。这一作用可能是iPSC-MSCs恢复受损PC12细胞的线粒体膜电位,使其凋亡减少的机制之一。通过修饰iPSC-MSCs提高其线粒体转移效率可能成为缺血缺氧性脑损伤治疗研究的一个新的方向。

Figure 4.iPSC-MSCs transferred mitochondria to the PC12 cells.图4 iPSC-MSCs通过TNTs转移线粒体至PC12细胞
[参考文献]
[1]Laver S,Farrow C,Turner D,et al.Mode of death after admission to an intensive care unit following cardiac arrest [J].Intensive Care Med,2004,30(11) :2126-2128.
[2]Doeppner TR,Hermann DM.Stem cell-based treatments against stroke: observations from human proof-of-concept studies and considerations regarding clinical applicability [J].Front Cell Neurosci,2014,8:357.
[3]Meier C,Rosenkranz K.Cx43 expression and function in the nervous system-implications for stem cell mediated regeneration[J].Front Physiol,2014,5:106.
[4]Islam MN,Das SR,Emin MT,et al.Mitochondrial transfer from bone-marrow-derived stromal cells to pulmonary alveoli protects against acute lung injury[J].Nat Med,2012,18(5) :759-765.
[5]Plotnikov EY,Khryapenkova TG,Vasileva AK,et al.Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture[J].J Cell Mol Med,2008,12(5A) :1622-1631.
[6]Lee M,Kang H,Jang SW.CoCl2induces PC12 cells apoptosis through p53 stability and regulating UNC5B[J].Brain Res Bull,2013,96:19-27.
[7]廖新学,阮经文,兰爱平,等.p38 MAPK-iNOS-NO通路介导化学性缺氧对PC12细胞的损伤作用[J].中国病理生理杂志,2010,26(12) :2410-2414.
[8]莫世静,童秀珍,钟茜,等.骨髓间充质干细胞通过上调EPO表达减轻缺氧损伤引起的PC12细胞凋亡[J].中国病理生理杂志,2013,29(1) :62-69.
[9]Niizuma K,Yoshioka H,Chen H,et al.Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia[J].Biochim Biophys Acta,2010,1802 (1) :92-99.
[10]Xing B,Chen H,Zhang M,et al.Ischemic postconditioning inhibits apoptosis after focal cerebral ischemia/reperfusion injury in the rat[J].Stroke,2008,39(8) : 2362-2369.
[11]Gonzalez-Lima F,Barksdale BR,Rojas JC.Mitochondrial respiration as a target for neuroprotection and cognitive enhancement[J].Biochem Pharmacol,2014,88(4) : 584-593.
[12]Spees JL,Olson SD,Whitney MJ,et al.Mitochondrial transfer between cells can rescue aerobic respiration[J].Proc Natl Acad Sci U S A,2006,103(5) :1283-1288.
[13]Liu K,Ji K,Guo L,et al.Mesenchymal stem cells rescue injured endothelial cells in an in vitro ischemia-reperfusion model via tunneling nanotube like structure-mediated mitochondrial transfer[J].Microvasc Res,2014,92: 10-18.
[14]Rami A,Volkmann T,Winckler J.Effective reduction of neuronal death by inhibiting gap junctional intercellular communication in a rodent model of global transient cerebral ischemia[J].Exp Neurol,2001,170(2) :297-304.
[15]Li X,Zhang Y,Yeung SC,et al.Mitochondrial transfer of induced pluripotent stem cell-derived mesenchymal stem cells to airway epithelial cells attenuates cigarette smokeinduced damage[J].Am J Respir Cell Mol Biol,2014,51(3) :455-465.
[16]Ahmad T,Mukherjee S,Pattnaik B,et al.Miro1 regulates intercellular mitochondrial transport&enhances mesenchymal stem cell rescue efficacy[J].EMBO J,2014,33(9) :994-1010.
通讯作者△Tel: 020-87755766; E-mail: xlidoct@ qq.com
*[基金项目]国家自然科学基金资助项目(No.81272062; No.81471832; No.81372022) ;广东省自然科学基金资助项目(No.S2013010016799) ;广东省科技计划(No.2012B031800286) ;中山大学青年教师重点培育项目(No.13ykzd11)
[收稿日期]2014-12-26
[文章编号]1000-4718(2015)06-1036-06
[中图分类号]363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.013
