转录因子c-Jun调控成骨细胞Mepe基因表达的研究*
2015-03-30张娟娟刘宗霞潍坊医学院口腔学院口腔医学研究所山东潍坊261053
张娟娟,刘宗霞,孙 岩(潍坊医学院口腔学院口腔医学研究所,山东潍坊261053)
转录因子c-Jun调控成骨细胞Mepe基因表达的研究*
张娟娟,刘宗霞,孙岩△
(潍坊医学院口腔学院口腔医学研究所,山东潍坊261053)
[摘要]目的:探讨转录因子c-Jun对Mepe基因的转录调控作用,并寻找c-Jun在Mepe启动子上的特异性结合位点。方法:利用免疫组织化学方法定位c-Jun与Mepe在小鼠骨组织的表达;采用real-time PCR的方法检测c-Jun的表达量改变对Mepe mRNA表达的影响;应用双萤光素酶报告基因检测系统及定点突变技术分析c-Jun对Mepe基因启动子转录活性的影响。结果:转录因子c-Jun在小鼠骨细胞胞核中呈阳性表达,而Mepe在小鼠骨细胞的胞浆中有表达; real-time PCR显示c-Jun过表达后,Mepe mRNA的表达显著增加(P<0.05) ;双萤光素酶报告基因检测系统检测显示,在成骨细胞中转染pCMV-3Tag-1-c-Jun的实验组Mepe启动子的转录活性升高(P<0.05) ;定点突变c-Jun的潜在结合位点后,Mepe启动子的转录活性显著下降(P<0.05)。结论:转录因子c-Jun可通过Mepe启动子上潜在的c-Jun结合位点上调成骨细胞中该基因的转录。
[关键词]转录因子c-Jun;细胞外基质磷酸化糖蛋白;成骨细胞
[修回日期]2015-01-26
Transcriptional factor c-Jun regulates Mepe gene expression in osteoblasts
ZHANG Juan-juan,LIU Zong-xia,SUN Yan
(Institute of Stomatology,School of Dental Medicine,Weifang Medical University,Weifang 261053,China.E-mail: yansw2005 @ aliyun.com)
[ABSTRACT]AIM: To study the relationship between transcriptional factor c-Jun and Mepe gene expression,and to identify the specific binding site of c-Jun on the promoter of Mepe.METHODS: The expression of c-Jun and Mepe in mouse bone tissue was detected by immunolocalization assay.The mRNA expression of Mepe was determined by real-time PCR when the expression of c-Jun was changed.The techniques of dual luciferase analysis and site-specific mutagenesis were used to measure the effects of c-Jun on the transcriptional activity of Mepe.RESULTS: c-Jun was detected in the nucleus of osteocytes,while Mepe was observed in osteocyte cytoplasm.The results of real-time PCR showed that overexpression of c-Jun directly resulted in significantly higher up-regulation of Mepe mRNA.Compared with control group,the transcriptional activity of Mepe promoter was increased in osteoblasts which was transfected with pCMV-3Tag-1-c-Jun.Mutation of c-Jun potential binding sites decreased the transcriptional activity of Mepe promoter.CONCLUSION: Mepe gene transcription can be up-regulated by c-Jun which binds to the specific sites of Mepe promoter in osteoblasts.
[KEY WORDS]Transcription factor c-Jun; Matrix extracellular phosphoglycoprotein; Osteoblasts
2000年,Rowe等[1]对大鼠骨相关肿瘤基因进行筛选时,发现了一个明显差异表达的新基因,即细胞外基质磷酸化糖蛋白(matrix extracellular phosphoglycoprotein,Mepe)。Mepe蛋白主要在矿化的成骨细胞中表达,与骨骼及牙的形成和发育密切相关,同时也是调节体内磷酸盐平衡的重要生物分子[2]。随着研究的深入,发现Mepe在成骨细胞分化与骨发育再生、牙髓干细胞增殖分化、参与细胞DNA损伤应答、凋亡调节及肿瘤的发生中发挥着重要的作用,逐渐成为研究热点。
激活剂蛋白-1(activator protein-1,AP-1)是一类立早基因编码的核转录因子,其组成成员包括c-Fos家族的c-Fos、FosB、Fra-1、Fra-2与c-Jun家族的c-Jun、JunB、JunD,它们是成骨细胞、成软骨细胞和牙源性细胞株所必须的转录因子。c-Jun在细胞的正常生长、癌性转化和细胞凋亡过程中起着重要作用[3]。本研究通过观察c-Jun对Mepe基因启动子转录活性的影响,为进一步研究AP-1家族调控成骨细胞发育及骨相关疾病的发生奠定基础。
材料和方法
1动物
成年昆明小鼠,雌雄不限,40~50 g,由潍坊医学院实验动物中心提供;小鼠MC3T3-E1成骨细胞系由本实验室保存。
2主要试剂
兔抗鼠c-Jun和Mepe多克隆抗体(Abcam) ;鼠ABC免疫组化检测试剂盒(vector) ; DAB显色试剂盒(北京中山金桥) ;小量质粒提取试剂盒、胶回收试剂盒和基因组DNA抽提试剂盒(上海生物工程有限公司) ; pMD18-T Simple Vector、T4 DNA Ligase、Prime STAR HS DNA Polymerase、RNAiso Plus、Prime-ScriptRT reagent Kit、MutanBEST Kit(TaKaRa) ; HindⅢ、Xho I、EcoRⅡ、XhoⅡ限制性内切酶、Trans-FastTMTransfection Reagent和Dual-Luciferase双萤光素酶报告基因检测试剂盒(Promega) ;α-MEM培养基和胰蛋白酶(HyClone) ;胎牛血清(杭州四季青公司) ;引物合成及测序由TaKaRa完成。
3主要方法
3.1免疫组化法检测c-Jun和Mepe在小鼠下颌骨中的表达取出生后5 d的小鼠脱颈处死,分离下颌骨,立即置于4%的中性甲醛溶液中4℃固定16 h,经10% EDTA(pH 8.0)溶液4℃脱矿7 d,常规制作石蜡切片。组织切片常规脱蜡入水,0.01 mol/L柠檬酸钠(pH 6.0) 95℃处理40 min抗原修复,3% H2O2/甲醇去除内源性过氧化物酶活性; 1∶50羊血清37℃、30 min封闭非特异结合蛋白,滴加1∶20的兔抗鼠c-Jun或MepeⅠ抗,4℃孵育过夜;滴加1∶200 HRP标记的羊抗兔抗体室温结合2 h;加AB液,37℃孵育30 min,DAB显色,常规封片,阴性对照组以PBS代替Ⅰ抗,显微镜下观察结果并拍照。以细胞深染成颗粒状棕黄色为阳性表达。
3.3 Real-time PCR检测过量表达和RNA干扰c-jun 对Mepe mRNA表达的影响根据Ambion提供的在线设计软件(http://www.ambion.com/techlib/misc/siRNA_finder.html)设计用于干扰c-jun表达的siRNA-c-Jun,其正义链为5’-CAGAGCAUGACCUUGAACCTT-3’,反义链为5’-GGUUCAAGGUCAUGCUCUGTT-3’,由TaKaRa合成。用含10%胎牛血清的α-MEM培养基培养小鼠成骨细胞传至5代以上,细胞计数达2×109cells/L时铺6孔板,细胞丰度为70%~80%时进行瞬时转染,操作步骤参照TransFastTMTransfection Reagent说明书进行。实验组转染100 ng pCMV-3Tag-1-c-Jun或siRNA-c-Jun,对照组转染100ng pCMV-3Tag-1或siRNA-control,过表达组转染24 h,RNA干扰组转染36 h后提取总RNA,逆转录为cDNA,进行RT-PCR检测c-Jun和Mepe mRNA表达的变化(引物序列见表1)。反应条件为94℃4 min;94℃10 s,60℃15 s,72℃25 s,80℃15 s,40个循环;72℃5 min。每个样本设3个复孔,重复3次。Ct值由IQ5TMPCR仪自动读出,结果进行2-ΔΔ Ct分析。
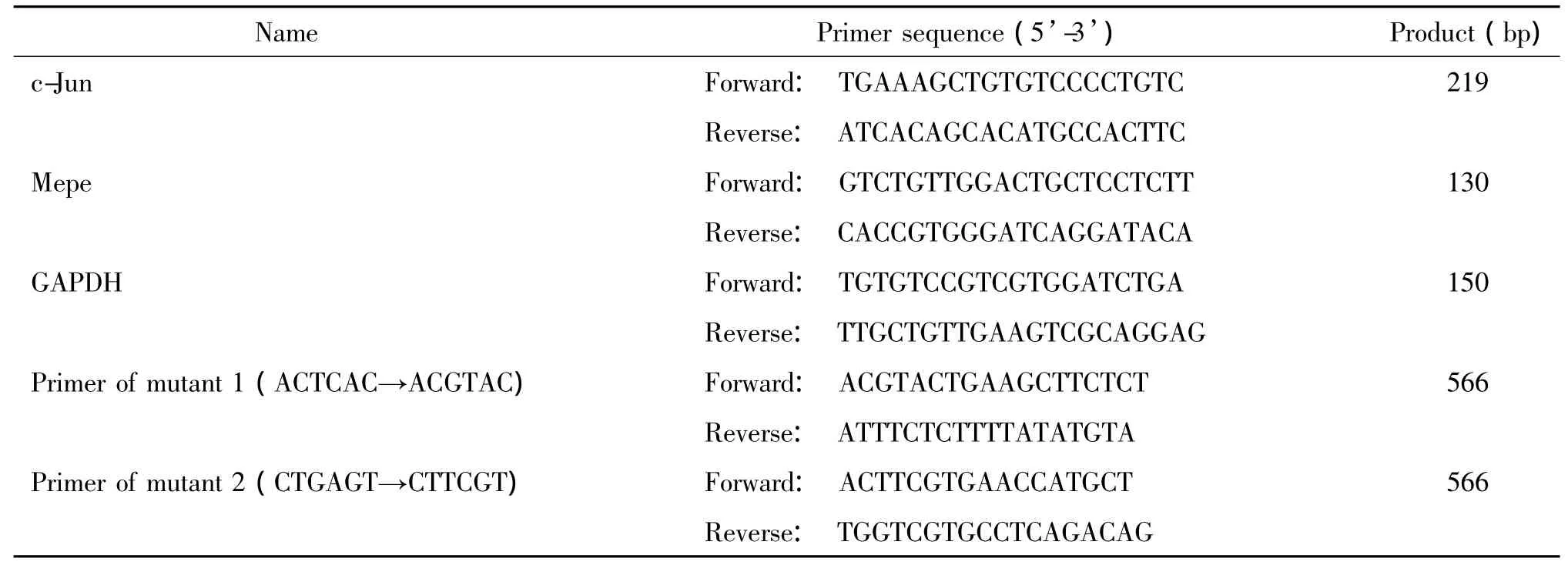
表1 引物序列Table 1.The sequences of the primers
3.4双萤光素酶报告基因检测系统检测c-Jun过表达对不同长度Mepe基因启动子的转录活性影响成骨细胞按6×107/m2接种于24孔板,继续培养24 h后用于瞬时转染。用50 ng重组质粒pCMV-3Tag-1-c-Jun转染小鼠成骨细胞,以pCMV-3Tag-1作为阴性对照,pRL-TK作为内参照。本实验共分5组,每组3个复孔。每组分别加入不同长度Mepe基因启动子重组质粒pGL3-Mepe-P-121-+ 23 (144 bp)、pGL3-Mepe-P-183-+ 23(206 bp)、pGL3-Mepe-P-343-+ 23 (366 bp)、pGL3-Mepe-P-543-+ 23 (566 bp)、pGL3-Mepe-P-1124-+23(1 147 bp)各300 ng(由本实验室保存)。转染后无血清培养基培养1 h后,补加含有胎牛血清的培养液至500 μL继续转染30 h后收板,进行萤光素酶活性检测。参照Dual-Luciferase双萤光素酶报告基因检测系统(Promega)说明书进行检测: PBS洗涤细胞后,每孔加入100 μL PLB裂解15 min,取20 μL细胞裂解液加入50 μL LARⅡ混匀后立即检测萤火虫萤光素酶(firefly luciferase)发光的数值(U1)。之后加入50 μL Stop&GloTM试剂混匀,立即检测海肾萤光素酶(Renilla luciferase)发光的数值(U2)。样品U1/U2之值即为报告基因的萤光素酶相对活性,每个样品的3组数据取平均值后进行统计学分析。
3.5 Mepe基因启动子上c-Jun结合位点的定点突变及其突变体的构建利用生物信息工具,对Mepe基因上游启动子序列-3 126/+ 198区域进行调控元件和转录因子结合位点分析,发现c-Jun的2个潜在结合位点。设计定点突变引物(表1),由TaKaRa合成,以实验室的重组质粒pMD18-T Simple-Mepe-566为模板,按照TaKaRa MutanBEST Kit说明书进行定点突变,获得突变体pMD18-T Simple-Mepe-566mut。用Xho I和HindⅢ双酶切后再亚克隆到pGL3-Basic载体中,并送TaKaRa公司测序鉴定。构建成功的萤光素酶表达载体突变体命名为pGL3-Mepe-566mut1、pGL3-Mepe-566mut2和pGL3-Mepe-566mut(2个位点均突变),同时将野生型PGL3-Mepe-566命名为PGL3-Mepe-566WT。
3.6萤光素酶报告基因检测系统检测转录因子c-Jun过表达时对野生型和突变型Mepe基因启动子转录活性的影响将重组质粒pCMV-3Tag-1-c-Jun瞬时转染小鼠成骨细胞,空质粒pCMV-3Tag-1作为阴性对照,pRL40质粒作为内参照,将实验分为5组: Basic组:300 ng pGL3-Basic+200 ng pCMV-3Tag-1-c-Jun或200 ng pCMV-3Tag-1; WT组:300 ng pGL3-Mepe-566WT+200 ng pCMV-3Tag-1-c-Jun或200 ng pCMV-3Tag-1; Mut1组: 300 ng pGL3-Mepe-566mut1+ 200 ng pCMV-3Tag-1-c-Jun或200 ng pCMV-3Tag-1; Mut2组:300 ng pGL3-Mepe-566mut2+200 ng pCMV-3Tag-1-c-Jun或200 ng pCMV-3Tag-1; Mut组: 300 ng pGL3-Mepe-566mut+ 200 ng pCMV-3Tag-1-c-Jun或200 ng pCMV-3Tag-1。每组3个复孔,相同条件下重复3次,用双萤光素酶报告基因检测试剂盒检测萤光素酶活性。
4统计学处理
实验数据用均数±标准差(mean±SD)表示。采用SPSS16.0统计软件进行数据分析,对RT-PCR结果用配对t检验进行比较分析,以P<0.05为差异有统计学意义。
结果
1 c-Jun与Mepe在小鼠下颌骨中的表达
免疫组织化学结果显示,作为转录因子的c-Jun在出生后5 d小鼠颌骨的成骨细胞胞核中呈阳性表达,同时还发现在成釉细胞的胞核中也呈阳性表达,Mepe在小鼠成骨细胞的胞浆中有表达,尤其在嵌入骨陷窝中的钙化骨细胞内表达量高,以PBS代替Ⅰ抗的对照组呈阴性,见图1。

Figure 1.The expression of c-Jun and Mepe in the mouse jawbone detected by immunohistochemistry.A: c-Jun was detected in the nucleus of osteocytes (×200) ; B: Mepe was observed in osteocyte cytoplasm (×400).图1免疫组织化学染色显示c-Jun和Mepe在小鼠颌骨中的表达
2小鼠c-jun基因的克隆及重组质粒pCMV-3Tag-1-c-Jun的构建及鉴定
小鼠c-jun基因PCR扩增产物,经琼脂糖凝胶电泳显示,扩增的条带大小与目的片段大小一致(1 005 bp) ;重组质粒pCMV-3Tag-1-c-Jun经EcoRⅡ和XhoⅡ分别单酶切鉴定,得到大小分别为248 bp、4 957 bp与555 bp、4 650 bp的条带,与预测结果一致,见图2;初步鉴定正确的重组质粒pCMV-3Tag-1-c-Jun由TaKaRa公司测序分析,并进行Blast比对,结果显示所得基因序列与GenBank中小鼠c-jun基因序列完全一致,无碱基的点突变及移码发生。
3 c-jun的RNA干扰及过表达对Mepe基因表达的影响
成骨细胞中转染c-Jun siRNA 36 h后,real-time PCR检测结果表明,c-Jun mRNA表达水平下降约80%,差异显著(P<0.05),说明沉默效果较好。Mepe mRNA在c-Jun siRNA组表达水平下降约75%,而在转染过表达载体pCMV-3Tag-1-c-Jun组表达水平上升约5倍,差异显著(P<0.05),这表明转录因子c-Jun在调控小鼠Mepe转录过程中发挥作用,见图3。
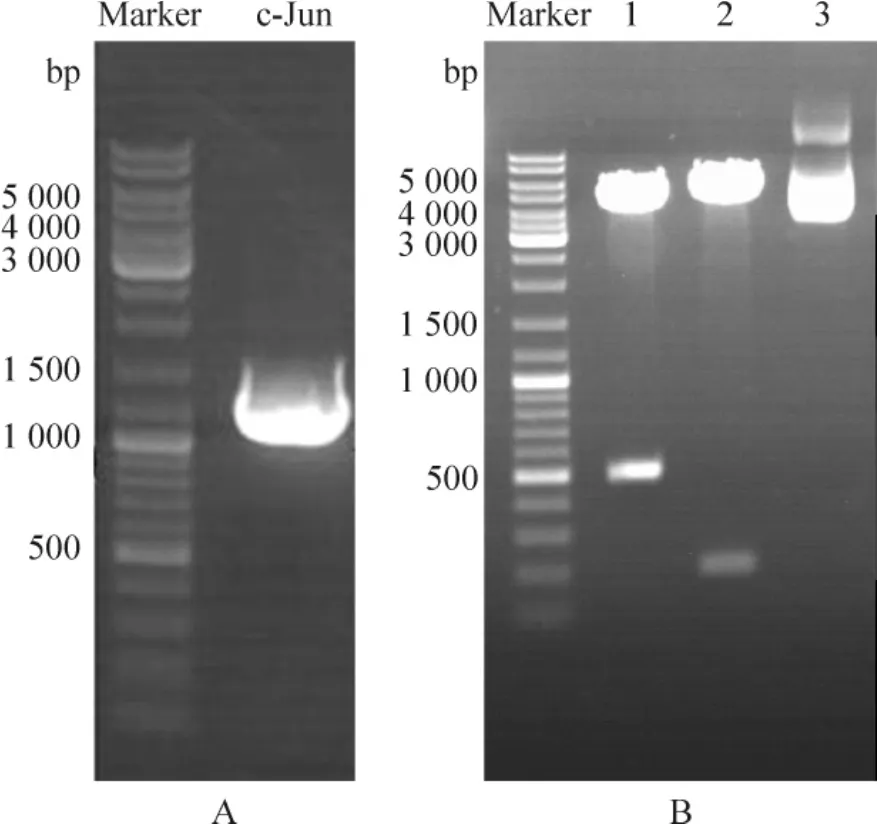
Figure 2.Gene clone of c-jun and construction of overexpression vector pCMV-3Tag-1-c-Jun.A: the PCR result of c-Jun; B: enzyme digestion identification of recombinant plasmid pCMV-3Tag-1-c-Jun.1: the plasmid pCMV-3Tag-1-c-Jun digested by XhoⅡ(4 650 bp and 555 bp fragments) ; 2: the plasmid pCMV-3Tag-1-c-Jun digested by EcoRⅡ(4 957 bp and 248 bp fragments) ; 3: the plasmid pCMV-3Tag-1-c-Jun without digestion.图2 c-jun基因的克隆及过表达载体pCMV-3Tag-1-c-Jun的构建
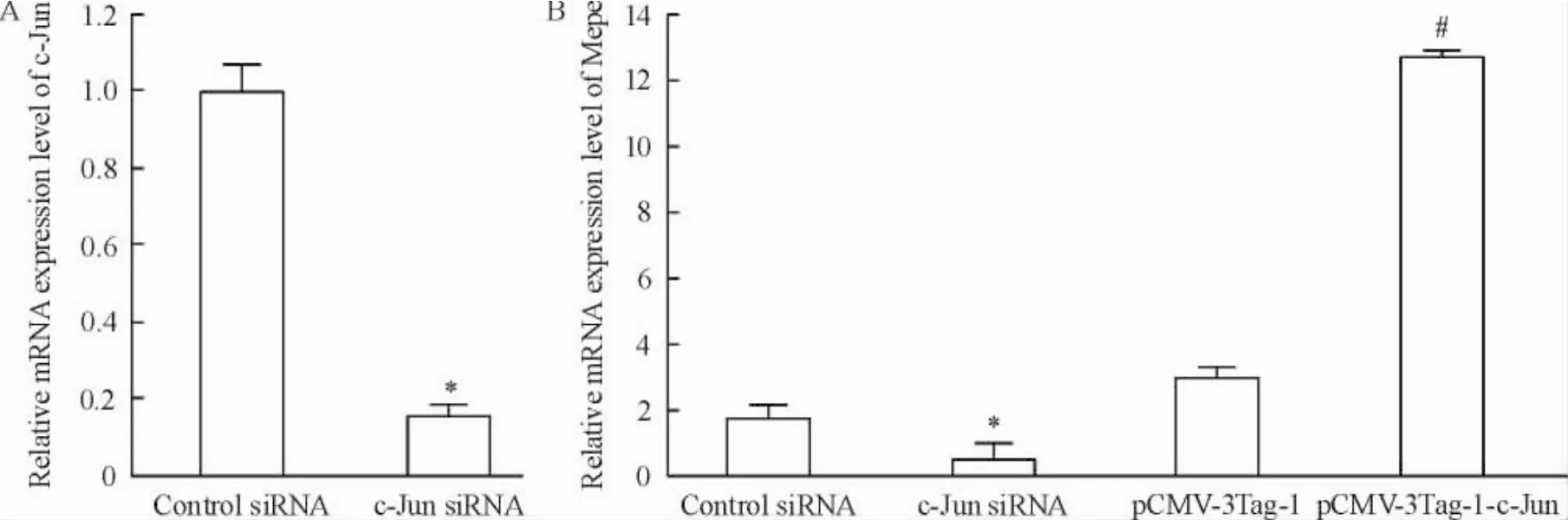
Figure 3.The mRNA expression of c-Jun and Mepe detected by real-time PCR.Mean±SD.n=9.*P<0.05 vs control siRNA group;#P<0.05 vs pCMV-3Tag-1 group.图3 Real-time PCR检测c-Jun和Mepe mRNA的表达变化
4 c-Jun对不同长度小鼠Mepe基因启动子转录活性的影响
将转录因子c-Jun过表达载体pCMV-3Tag-1-c-Jun与不同长度的Mepe基因启动子pGL3-Mepe共转染30 h后,收集细胞检测萤光素酶活性。结果显示过表达c-Jun明显上调Mepe启动子的萤光素酶活性(P<0.05),并且对pGL3-Mepe-144与pGL3-Mepe-566上调幅度均较大(P<0.05),两者之间差异无显著性(P>0.05)。由此推断Mepe启动子-121~+23与-543~-343区域存在c-Jun的特异性结合位点,可上调Mepe的转录,见图4。
5 Mepe基因启动子特征性序列定点突变体的构建及鉴定
通过转录因子结合位点分析找到Mepe基因启动子-105/-99与-491/-486区域存在潜在的2 个c-Jun结合位点(图5A)。根据设计的基因突变引物,以pMD18-T Simple-Mepe-566为模板,将特征性序列1的ACTGAGT突变为ACTTCGT,特征性序列2 的ACTCAC突变为ACGTAC,构建Mepe基因突变体真核表达载体pGL3-Mepe-566mut1、pGL3-Mepe-566mut2和pGL3-Mepe-566mut(2个位点均突变)。突变体质粒经酶切鉴定正确,由TaKaRa公司序列分析,并进行BLAST比对,结果显示Mepe基因启动子在预期位点发生突变,见图5。
6 c-Jun对野生型和突变型Mepe基因启动子转录活性的影响
双萤光素酶检测结果显示:转染过表达载体c-Jun后,pGL3-Mepe-566WT的萤光素酶活性上升约2 倍(P<0.05),pGL3-Mepe-566mut1与pGL3-Mepe-566mut2的萤光素酶活性上升约1倍(P<0.05),pGL3-Mepe-566mut的荧萤素酶活性无显著变化(P>0.05),与pGL3-Mepe-566WT相比较pGL3-Mepe-566mut1与pGL3-Mepe-566mut2的萤光素酶活性均下降了约40% (P<0.05),而pGL3-Mepe-566mut的萤光素酶活性下降了约75% (P<0.05),这证明了转录因子c-Jun可通过与Mepe基因启动子的特征性序列ACTGAGT与ACTCAC这2个结合位点相互作用,调控Mepe基因的表达,见图6。
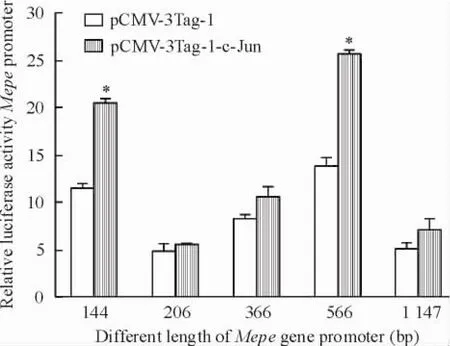
Figure 4.The change of Mepe promoter relative luciferase activities after transfected with pCMV-3Tag-1-c-Jun.Mean ±SD.n=9.*P<0.05 vs pCMV-3Tag-1 group.图4成骨细胞转染pCMV-3Tag-1-c-Jun对不同长度Mepe基因启动子萤光素酶活性的影响
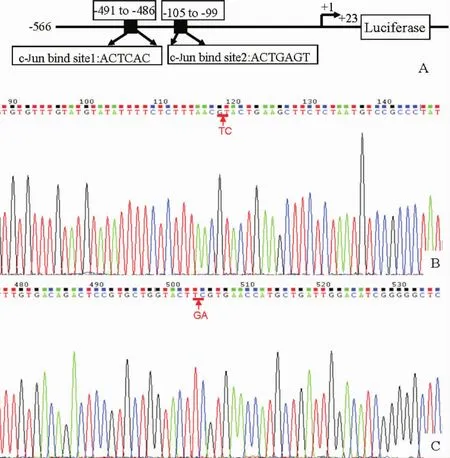
Figure 5.The schematic diagram for two potential c-Jun-binding sites in Mepe promoter (A) and the results of sequencing identification for recombinant plasmid pGL3-Mepe-566mut1 (B) and pGL3-Mepe-566mut2 (C).图5 Mepe基因启动子上潜在的2个c-Jun结合位点示意图及重组质粒pGL3-Mepe-566mut1和pGL3-Mepe-566mut2的测序鉴定结果
讨论
Mepe是短整联蛋白黏合性配体互动糖蛋白(small integrin-binding ligand N-linked glycolproteins,SIBLINGs)蛋白家族的新成员,又名成骨细胞/骨细胞因子45(osteoblast/osteocyte factor 45,OF45)或osteoregulin,主要表达于骨组织、牙齿组织及肾近球小管中,与体内钙磷平衡及牙体硬组织的形成矿化密切相关[4-6]。小鼠Mepe基因与人类此基因在蛋白水平上具有44%的同一性和54%的相似性,都含有信号肽、RGD元件、SGDG元件以及ASARM元件;二者cDNA序列具有74%~79%的同一性。Mepe蛋白调节钙磷酸盐代谢功能以及成骨细胞的分化方面具有双重性[7]。最近的研究表明Mepe中不同的结构域对矿化起不同的作用,ASARM片段可以抑制钙化,而AC100片段则促进钙化[8-9]。Mepe过表达小鼠表现为骨形成和矿化减少,但是破骨细胞数目和活性却是降低的。Nagel等[10]在体外实验中观察到Mepe 和AC-100均能有效促进前成骨细胞的合成代谢,从而刺激骨髓基质细胞的增殖和分化。
原癌基因c-jun和c-fos是AP-1家族成员,其蛋白编码产物能通过亮氨酸拉链形成同源二聚体或异源二聚体,与许多基因的启动子上AP-1特征性序列结合,参与基因转录的调控,影响细胞的增殖和凋亡[11-12]。已知的受AP-1调控的骨特异性基因有骨钙素、Ⅰ型胶原、碱性磷酸酶等。c-Jun和c-Fos直接影响着成骨细胞和破骨细胞的分化、成熟和功能稳定[13-14]。研究证实c-Fos不表达或过表达均可导致骨发育异常[15],提示c-Fos在骨形成和调控成骨细胞特异基因的表达中具有重要作用。c-jun编码产物为核内F78结合蛋白,是调节成骨细胞增殖分化的基因之一,在成骨细胞增殖期高度表达,分化期低表达或无表达[16]。
目前关于c-Jun和Mepe的关系目前还尚不明确,故本实验对成骨细胞中c-Jun在Mepe基因表达、转录调控中的作用进行了研究。本实验首先通过免疫组化的方法观察到小鼠成骨细胞胞核中有c-Jun的表达,Mepe在小鼠成骨细胞的胞浆中有表达,尤其在嵌入骨陷窝中的钙化骨细胞内表达量高,这为进行下一步深入的研究提供了依据。通过过量表达和基因沉默c-jun的表达后发现,Mepe的mRNA表达随c-Jun表达量的变化而变化,这表明c-Jun很可能参与了调控Mepe在成骨细胞中的表达,并且具有能够上调Mepe基因表达的重要作用。共转染c-Jun过表达载体pCMV-3Tag-1-c-Jun与不同长度的Mepe基因启动子后,通过萤光素酶活性检测发现过表达c-Jun明显上调Mepe启动子的萤光素酶活性,并且对Mepe启动子144 bp与566 bp上调幅度均较大。进一步通过对Mepe启动子近端区域进行转录因子结合位点分析显示,在-105/-99与-491/-486区域存在2个可能的c-Jun结合位点,对这2个位点进行定点突变发现,这2个潜在的c-Jun结合位点的单个或同时突变均能显著能降低Mepe启动子的转录活性,这表明c-Jun可能是通过直接与特异性结合位点ACTGAGT与ACTCAC结合来调控Mepe基因的转录。
[参考文献]
[1]Rowe PS,de Zoysa PA,Dong R,et al.MEPE,a new gene expressed in bone marrow and tumors causing osteomalacia[J].Genomics,2000,67(1) :54-68.
[2]Petersen DN,Tkalcevic GT,Mansolf AL,et al.Identification of osteoblast/osteocyte factor 45 (OF45),a bonespecific cDNA encoding an RGD-containing protein that is highly expressed in osteoblast and osteocyte[J].J Biol Chem,2000,275(46) :36172-36180.
[3]Tan SD,Bakker AD,Semeins CM,et al.Inhibition of osteocyte apoptosis by fluid flow is mediated by nitric oxide [J].Biochem Biophys Res Commun,2008,369 (4) : 1150-1154.
[4]Staines KA,Mackenzie NC,Clarkin CE,et al.MEPE is a novel regulator of growth plate cartilage mineralization [J].Bone,2012,51(3) :418-430.
[5]Mastrangelo F,Quaresima R,Grilli A,et al.A comparison of bovine bone and hydroxyapatite scaffolds during initial bone regeneration: an in vitro evaluation[J].Implant Dent,2013,22(6) :613-622.
[6]Gooi JH,Pompolo S,Karsdal MA,et al.Calcitonin impairs the anabolic effect of PTH in young rats and stimulates expression of sclerostin byosteocytes[J].Bone,2010,46(6) :1486-1497.
[7]Cavalli L,Mazzotta C,Brandi ML.Phosphatonins: physiological role and pathological changes[J].Clin Cases Miner Bone Metab,2012,9(1) :9-12.
[8]Rowe PS.Regulation of bone-renal mineral and energy metabolism: the PHEX,FGF23,DMP1,MEPE ASARM pathway[J].Crit Rev Eukaryot Gene Expr,2012,22 (1) :61-86.
[9]Salmon B,Bardet C,Khaddam M,et al.MEPE-derived ASARM peptide inhibits odontogenic differentiation of dental pulp stem cells and impairs mineralization in tooth models of X-linked hypophosphatemia[J].PLoS One,2013,8(2) : e56749.
[10]Nagel DE,Khosla S,Sanyal A,et al.A fragment of the hypophosphatemic factor,MEPE,requires inducible cyclooxygenase-2 to exert potent anabolic effects on normal human marrow osteoblast precursors[J].J Cell Biochem,2004,93(6) :1107-1114.
[11]Takai H,Araki S,Mezawa M,et al.AP1 binding site is another target of FGF2 regulation of bone sialoprotein gene transcription[J].Gene,2008,410(1) :97-104.
[12]刘丽华,戚本玲,吴钦钦,等.c-Jun对硫氧还蛋白还原酶1启动子转录的调控作用[J].中国病理生理杂志,2012,28(4) :700-707.
[13]徐纯峰,李鹏,董伟,等.核因子κB受体活化因子配体对唑来膦酸诱发的破骨细胞生成及NF-κB p50 和c-Jun基因表达抑制的挽救效应[J].生物医学工程杂志,2014,31(2) :385-388,399.
[14]Matsuo N,Tanaka S,Gordon MK,et al.CREB-AP1 protein complexes regulate transcription of the collagen XXIV gene (Col24a1) in osteoblasts[J].J Biol Chem,2006,281(9) :5445-5452.
[15]Wang Y,Wang H,Ye Q,et al.Co-regulation of LPS and tensile strain downregulating osteogenicity via c-fos expression[J].Life Sci,2013,93(1) :38-43.
[16]Huang YF,Lin JJ,Lin CH,et al.c-Jun N-terminal kinase 1 negatively regulates osteoblastic differentiation induced by BMP2 via phosphorylation of Runx2 at Ser104 [J].J Bone Miner Res,2012,27(5) :1093-1105.
通讯作者△Tel: 0536-8462451; E-mail: yansw2005@ aliyun.com
*[基金项目]山东省自然科学基金资助项目(No.ZR2012HQ036) ;山东省自然科学基金资助项目(No.ZR2013HQ019) ;山东省高等学校科技计划项目(No.J12LL51)
[收稿日期]2014-12-09
[文章编号]1000-4718(2015)06-1026-06
[中图分类号]R336
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.011
