辐照骨髓淋巴细胞对成骨细胞的影响
2014-09-28丁巧灵徐小雅金慰芳高建军
邹 琼 丁巧灵 徐小雅 周 轶 金慰芳 高建军
(复旦大学放射医学研究所 上海 200032)
Arron等[1]于 2000年首次提出骨免疫学的概念,描述了骨骼系统与免疫系统之间的相互作用,免疫失调可导致骨代谢异常。近来许多研究显示,骨免疫参与了类风湿关节炎、骨质疏松、Paget骨病、骨溶解等诸多骨科疾病的发生与发展,揭示了免疫系统对骨代谢的重要调节作用[2]。
成骨细胞起源于未分化的间充质中的多潜能干细胞,在生长因子、激素和细胞因子的共同作用下,通过激活转录因子RUNX2、ATF4和Osterix等调控间充质干细胞向成骨细胞分化。碱性磷酸酶(Alkaline phosphatase, ALP)是成骨细胞分化和功能的重要标志之一,在基质矿化中起着关键性的作用。ALP活性高低一定程度上可以反映出细胞的成骨分化活性。骨钙素(Osteocalcin, OCN)是分化晚期成骨细胞分泌的骨蛋白,其水平与成骨细胞活性呈正相关。骨保护素(Osteoprotegerin, OPG)和(Ligand of receptor activator of NF-KB, RANKL)是通过成骨细胞和骨髓基质细胞表达的,可以相互竞争性结合破骨细胞膜上的RANK。OPG和RANKL比值的改变可以影响破骨细胞的分化,活化和凋亡。本研究通过细胞增殖分化以及ALP、0CN、0PG和RANKL基因表达,研究辐照淋巴细胞对成骨细胞的影响。
1 材料与方法
1.1 主要仪器和试剂
二氧化碳培养箱,环流热空气消毒箱购自德国Heraeus公司;倒置相差显微镜购自日本 Nikon公司;Mx3000P实时定量 PCR系统购自美国Stratagene公司;酶标仪 Elx800购自美国 Bio-Tek公司;培养瓶/板/皿/Transwell购自英国Corning公司;RPMI1640培养液和胎牛血清购自美国GIBCO公司;PNPP购自美国Amresco公司;二甲基噻唑二苯基四唑溴盐购自上海思吉生物制品有限公司;TRIZOL 试剂,M-MLV RT Kits试剂盒,Platinum®SYBR® Green qPCR SuperMix- UDG试剂盒购自美国Invitrogen 公司;HISTOPAQUE®1083购自美国SIGMA公司。
1.2 淋巴细胞和成骨细胞分离培养
(100±10)g SD大鼠,氯胺酮(0.2mL/100g)麻醉,颈动脉放血处死,取双侧股骨和胫骨,用注射器将骨髓冲出,200目滤器过滤至15mL,于离心管中1500 r·min-1离心5 min收集细胞,取另一15mL离心管加入3mL HISTOPAQUE®1083,3mL PBS重悬细胞液沿管壁缓慢加入离心管,最后沿管壁加入1mL RPMI1640 培养液,2000 r·min-1离心 30 min,吸取两分界层中的单个核细胞,6mL RPMI1640培养液1000 r·min-1离心5 min两次,8mL 10% FBS RPMI1640培养液重悬,计数后接种于培养瓶,置5% CO2培养箱、37 ℃下培养。24 h后弃除贴壁单核细胞,取全部培养液离心后重悬细胞置 5% CO2培养箱、37 ℃下培养。
新生(<24 h)SD大鼠,用 70%的酒精浸泡消毒10 min,机械取下头盖骨,置PBS内清除结缔组织后剪成1mm2大小,0.25% Trypsin 37 ℃下预消化20 min,弃消化液,再将骨片置0.1% CollagenaseⅡ振荡消化1 h 2次,合并两次消化液,1000 r·min-1离心10 min弃上清,细胞沉淀用10% FBS MEM重悬,计数后接种于培养瓶,置5% CO2培养箱、37 ℃下培养。
1.3 淋巴细胞和成骨细胞辐照共培养
取第二继代成骨细胞分别以 1×103/孔密度接种于96孔共培养板,1×105/皿接种于6孔共培养板;淋巴细胞以 1×104/孔接种于共培养条,5×105/皿接种于共培养皿。淋巴细胞培养3 d,成骨细胞汇合后,以137Cs γ射线放射源分别进行6 Gy照射,照射剂量率为0.783 Gy·min-1,照后两种细胞马上共培养,分组为0 Gy成骨细胞+0 Gy淋巴细胞(0OB0L),0 Gy成骨细胞+6 Gy淋巴细胞(0OB6L),6 Gy成骨细胞+6 Gy淋巴细胞(6OB6L),共培养6 h后取淋巴细胞与正常二代成骨细胞共培养。
1.4 辐照淋巴细胞对成骨细胞增殖和分化的影响
共培养3 d后弃培养液用PBS清洗,每孔加入无血清MEM培养液100 L及MTT 10 L,37 ℃ 5%CO2培养箱孵育4 h,加入20%的SDS100 L,37 ℃放置2 h,经酶标仪570nm波长测吸光度,结果以A570表示。另一组培养3 d后用PBS清洗,每孔加入 50 mmol·L-1DEA100 L,3 mmol·L-1PNPP 50 L 37 ℃孵育 30 min,加入 0.2 mmol·L-1氢氧化纳 50 L终止反应,在酶标仪405nm波长测吸光度,结果以A405表示。
1.5 成骨细胞相关基因的表达
共培养 2 h后弃培养液,每皿细胞均加入TRIZOL 0.5mL,氯仿异丙醇法提取RNA,DEPC水溶解,紫外分光光度计测定260nm和280nm处的吸收值,计算 RNA溶液浓度和纯度。按试剂盒方法进行逆转录和Realtime PCR。引物序列,ALP:forward 5’ TCCCAAAGGCTTCTTCTTGC3’, reverse 5’ATGGCCTCATCCATCTCCAC3’(108 bp,NM_013059.1); OCN: forward 5’CTGAGTCTGACAAAGCCTTC3’, revrers 5’CCATAGATGCGCTTGTAGGC3’(205 bp,NM013414.1), OPG: forward 5’ATACAGACAGCTGGCACACG3’, reverse 5’TGCTTTCGATGACGTCTCAC3’(266 bp, U94330);RANKL: forward 5’ ACCAGCATCAAAATCCCAAG 3’, reverse 5’ GGACGCTAATTTCCTCACCA 3’(132 bp, AF187319); GAPDH: forward 5’AAACCCATCACCATCTTCCA 3’, reverse 5’GTGGTTCACACCCATCACAA 3’(198 bp,DQ403053)。产物经融解曲线单峰验证,于T阶段采集信号获得 Ct值,计算各测试基因与内参基因GAPDH比值作相对分析。
1.6 统计分析
2 结果
2.1 辐照骨髓淋巴细胞抑制成骨细胞分化
辐照淋巴细胞与相关成骨细胞共培养6 h后,对正常成骨细胞的分化明显抑制,ALP活性检测结果显示:0OB6L组较 0OB0L组下降15.98%(p<0.01);6OB6L组较 0OB0L组下降28.53%(p<0.001);6OB6L组较 0OB6L组下降14.93%(p<0.05) (见图1)。对正常成骨细胞的增殖无明显影响,统计学无差异(见图2)。
2.2 辐照骨髓淋巴细胞抑制成骨细胞 ALP和OCN的表达
辐照淋巴细胞与相关成骨细胞共培养6 h后,对正常成骨细胞ALP和OCN的mRNA表达明显抑制,相应溶解曲线只有一个峰(见图3-5)。Real time PCR 的结果显示:0OB6L组ALP的mRNA水平较0OB0L组下降20.96%(p<0.01),6OB6L组较0OB0L组下降达39.33%(p<0.001),6OB6L组ALP水平又较0OB6L组下降23.25%(p<0.05)(见图6);0OB6L组OCN的mRNA水平较0OB0L组下降19.02%(p<0.05),6OB6L组较 0OB0L组下降达40.49%(p<0.001),6OB6L组OCN水平又较0OB6L组下降26.52%(p<0.05)(见图7)。

图1 成骨细胞分化效应Fig.1 Effects on the differentiation of osteoblast
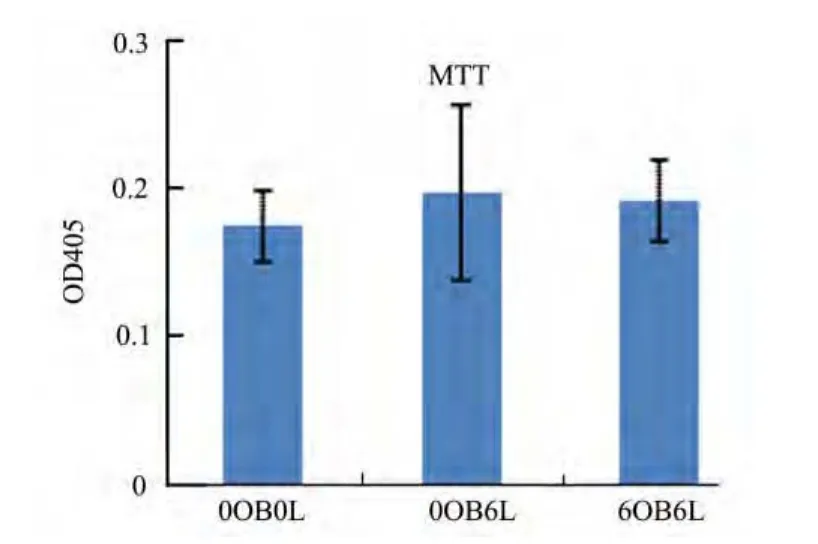
图2 成骨细胞增殖效应Fig.2 Effects on the proliferation of osteoblast

图3 GAPDH溶解曲线Fig.3 Melting curves of GAPDH

图4 ALP溶解曲线Fig.4 Melting curves of ALP
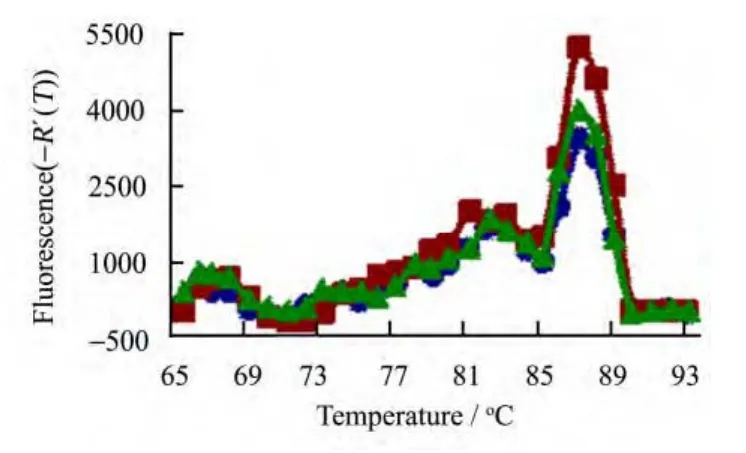
图5 OCN溶解曲线Fig.5 Melting curves of OCN
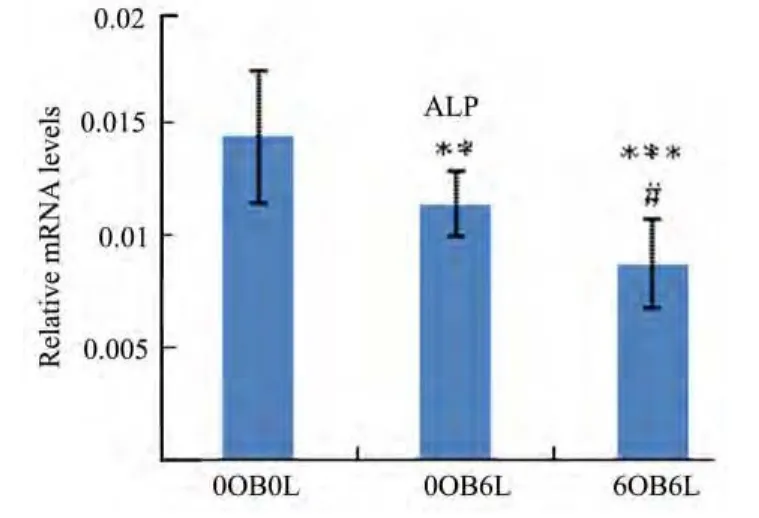
图6 ALP的mRNA表达Fig.6 The relative mRNA expression of ALP
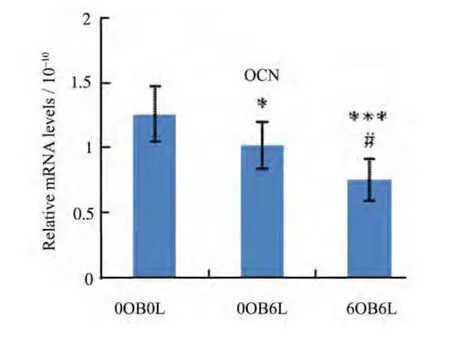
图7 OCN的mRNA的表达Fig.7 The relative mRNA expression of OCN
2.3 辐照骨髓淋巴细胞促进成骨细胞RANKL表达,RANKL/OPG比值上升
辐照淋巴细胞与相关成骨细胞共培养6 h后,对正常成骨细胞RANKL的mRNA表达明显促进,OPG 的表达无明显影响(见图 8),RANKL/OPG比值明显升高,相应溶解曲线只有一个峰(见图 9和图10)。
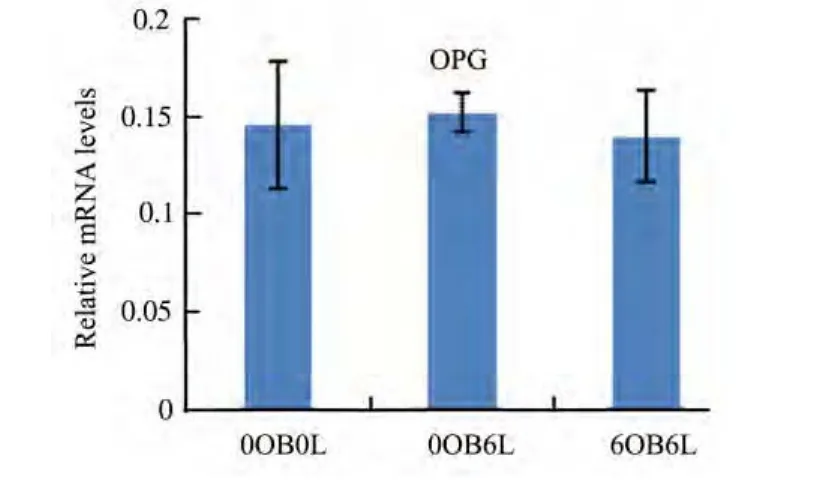
图8 OPG的mRNA的表达Fig.8 The relative mRNA expression of OPG
图9 OPG溶解曲线Fig.9 Melting curves of OPG
图10 RANKL溶解曲线Fig.10 Melting curves of RANKL
Real time PCR 的结果显示:0OB6L组RANKL的mRNA水平较0OB0L组上升42.45%(p<0.05),6OB6L组较 0OB0L组上升 121.04%(p<0.001),6OB6L组 RANKL水平又较 0OB6L组上升55.17%(p<0.001) (见图 11);0OB6L 组 RANKL/OPG的比值较0OB0L组上升40.04%(p<0.001),6OB6L组较 0OB0L组上升 138.07%(p<0.001),6OB6L组又较0OB6L组上升70.00%(p<0.001)(见图12)。

图11 RANKL的mRNA的表达Fig.11 The relative mRNA expression of RANKL
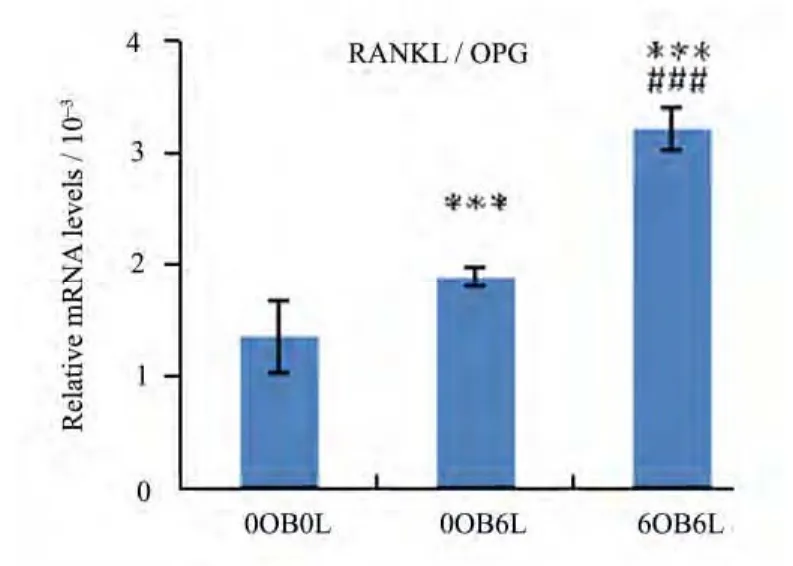
图12 RANKL/OPG的比值结果以±s, n=4;***p<0.001, 与0OB0L组比较,###, p<0.001, 与0OB6L组比较Fig.12 The ratio of RANKL/OPG Date are presented as±s, n=4;***p<0.001, compared with 0OB0L, ###, p<0.001, compared with 0OB6L
3 讨论
骨髓是造血器官,也是各种免疫细胞的发源地,骨髓中各阶段细胞不断在完成更新、增殖、分化和成熟等发育过程。其原始阶段细胞为多能干细胞,可以形成红细胞、粒细胞、巨噬细胞等,以及B淋巴细胞和T淋巴细胞。骨髓造血干细胞的分化需要特殊的骨微环境,骨微环境主要由各种骨基质细胞组成,最主要的是间充质干细胞,而成骨细胞系对维持正常的造血功能,特别是为淋巴细胞的发育提供了不可或缺的支持作用。Runx2和Osterix是间充质干细胞向成骨细胞分化早期的转录因子,这两种因子的失表达会导致成骨细胞数目严重减少,骨组织缺失,并且伴随骨髓造血功能低下,淋巴细胞缺失[3-7]。Zhu等[8]又发现体外培养的头盖骨成骨细胞能充分支持造血干细胞向B淋巴细胞分化发育的全过程,确认了成骨细胞与B淋巴细胞前体的相互作用。成骨细胞在整个分化过程中是否对淋巴细胞的发育都有作用,相关的研究表明,只有分化早期的成骨细胞具有支持淋巴细胞分化的作用,而分化成熟的成骨细胞对淋巴细胞分化无明显影响[9-10]。本研究采用的骨髓淋巴细胞大多为早期不成熟淋巴细胞,因此我们选取早期头盖骨成骨细胞与其共培养,从而使成骨细胞支持骨髓淋巴细胞的分化。
近来许多研究显示,骨免疫参予了类风湿关节炎、骨质疏松、Paget骨病、骨溶解等诸多骨科疾病的发生与发展,揭示免疫系统对骨代谢的重要调节作用[2]。这种调节作用主要表现为免疫细胞和骨细胞间通过许多细胞因子(如肿瘤坏死因子TNF-α,白介素 IL-1、3、6、7、11、15、17和 RANKL/RANK/OPG系统)及其受体相互作用。T淋巴细胞对成骨细胞和破骨细胞的刺激或抑制作用与T淋巴细胞亚群、细胞因子和局部因素密切相关。T淋巴细胞激活后产生RANKL、TNF-α和M-CSF,这些因子可促进破骨细胞前体的分化和破骨细胞活化,导致病理性骨吸收增强[11-14]。B淋巴细胞也可表达RANKL,但研究显示 B淋巴细胞分泌的 RANKL主要是促进B淋巴细胞的增殖和分化。同时细胞学研究表明前B淋巴细胞在RANKL和M-SCF刺激下可分化成破骨样细胞[15-16]。这样,免疫系统的两大主要细胞可通过细胞因子影响骨代谢。
以往大部分的研究结果都集中在免疫细胞对破骨细胞的影响,很少有关免疫细胞对成骨细胞的影响。本研究通过辐照刺激淋巴细胞,与早期成骨细胞共培养后作用于正常成骨细胞,发现辐照共培养淋巴细胞抑制成骨细胞的分化,碱性磷酸酶活性明显降低,ALP和OCN的表达也明显降低。0OB6L组和 6OB6L组较 0OB0L组碱性磷酸酶活性下降15.98%(p<0.01)和28.53%(p<0.001),ALP基因表达下降 20.96%(p<0.01)和 39.33%(p<0.001),OCN 基因表达下降19.02%(p<0.05)和40.49%(p<0.001)。同时我们发现6OB6L组较0OB6L组对成骨细胞分化的抑制作用更明显,具有统计学意义。以往的研究表明,早期的成骨细胞对淋巴细胞的分化极其重要,但是辐射刺激的淋巴细胞与成骨细胞的相互作用可能并非如生理状态,其相互作用的结果使淋巴细胞抑制正常成骨细胞的分化。辐照共培养的淋巴细胞促进了成骨细胞RANKL的表达,RANKL/OPG比值明显增高。0OB6L组和 6OB6L组较 0OB0L组RANKL/OPG比值上升40.04%(p<0.001)和138.07%(p<0.001),6OB6L组又较 0OB6L组上升 70.00%(p<0.001)。RANKL是破骨细胞分化和活化的重要因子,RANKL/OPG比值的升高可以显著促进破骨细胞前体的分化和破骨细胞活化,导致骨吸收增强。
辐照骨髓淋巴细胞抑制成骨细胞分化,其机制可能是通过抑制成骨细胞ALP和OCN的表达;同时辐照淋巴细胞促进成骨细胞 RANKL的表达,RANKL/OPG比值升高,间接促进破骨细胞分化和活化。
1 Arron J R, Choi Y. Bone versus irrmmune system [J].Nature, 2000, 408(6812): 535-536.
2 Schettg. Osteoimmunology in rheumatic diseases [J].Arthritis Research & Therapy, 2009, 11(1): 210.
3 Komori T, Yaqi H, Nomura S, et al. Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblast [J]. Cell, 1997,89(5): 755-764.
4 Otto F, Thormell A P, Crompton T, et al. Cbfa1-a candidate gene for cleidocranial dysplasia syndrome, is essential for osteoblast differentiation and bone development [J]. Cell, 1997, 89(5): 765-771.
5 Nakashima K, Zhou X, Kunkelg, et al. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation [J]. Cell,2002, 108(1): 17-29.
6 Zhou X, Zhang Z, Feng J Q, et al. Multiple functions of Osterix are required for bone growth and homeostasis in postnatal mice [J]. Proceedings of the National Academy Sciences USA, 2010, 107(29): 12919-12924.
7 Deguchi K, Yaqi H, Inada M, et al. Excessive extramedullary hematopiiesis in Cbfa1-deficient mice with a congenital lack of bone marrow [J]. Biochemical and Biophysical Research Communication, 1999, 255(2):352-359.
8 Zhu J, Garrett R, Jung Y, et al. Ostoblast support B-lymphocyte commitment and differentiation from hematopoietic stem cells [J]. Blood, 2007, 109(9): 3706-3712.
9 Ducy P, Desbois C, Boyce B, et al. Increased bone formation in osteocalcin deficient mice [J]. Nature, 1996,382(6590): 448-452.
10 Cheng Y H, Chitteti B R, Streicher D A, et al. Impact of maturational status on the ability of osteoblasts to enhance the hematopoietic function of stem and progenitor cells[J]. Journal of Bone and Mineral Research, 2011, 26(5):1111-1121.
11 Walsh M C, Kim N, Kadono Y, et al. Osteoimmunology:interplay between the immune system and bone metabolism [J]. Annual Review of Immunology, 2006, 24:33-63.
12 Takayanagi H. Osteoimmunology: shared mechanisms and crosstalk between the immune and bone systems [J].Nature Reviews Immunology, 2007, 7(4): 292-304.
13 Teitelbaum S L. Bone resorption by osteoclasts [J].Science, 2000, 289(5484):1504-1508.
14 Suda T, Takahashi N, Udagawa N, et al. Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families [J]. Endocrine Reviews, 1999, 20(3): 345-357.
15 Blin-Wakkach C, Wakkach A, Rochet N, et al.Characterization of a novel bipotent hematopoietic progenitor population in normal and osteopetrotic mice [J].Journal of Bone and Mineral Research, 2004, 19(7):1137-1143.
16 Katavic V, Grcevic D, Lee S K, et al. The surface antigen CD45R identifies a population of estrogen-regulated murine marrow cells that contain osteoclast precursors [J].Bone, 2003, 32(6): 581-590.
