microRNA-494通过TLR-4通路抑制成骨细胞分化及基质矿化的分子机制
2018-11-02匡嘉兵张克良许闫严
匡嘉兵,徐 昊,张克良,沈 波,许闫严
(武汉市普爱医院暨华中科技大学同济医学院附属普爱医院,西院骨一科,武汉 430030)
microRNAs(miRNAs)是一类长度约为22个核苷酸、保守、进化的非编码单链RNA小分子[1]。miRNA存在于果蝇、小鼠、人类和植物等基因组中,均为内源性表达[2]。研究已经证实,miRNAs在多数肿瘤中表达失调,包括结直肠癌、淋巴瘤、乳腺癌、肝细胞癌等[3]。此外,研究发现miR-494会参与脑缺血、神经变性病、多发性硬化、脑肿瘤以及脊髓病变等多种生理疾病中[4-6]。骨质疏松症是世界上常见的病症,发病率极高。成骨细胞在骨代谢中起着重要的作用,参与骨吸收和骨重建的过程[7]。当机体的骨吸收大于骨重建时,就会表现出骨量减少、骨流失以及骨显微结构被破坏的现象[8]。成骨细胞是骨代谢的主要功能细胞,细胞的增殖和分化能力决定着最终的成骨量[9]。Toll样受体(toll-like receptor,TLR)广泛存在于人类和动物的多种细胞中,属于I型跨膜蛋白,参与机体的初级免疫过程,并调节机体的多种生理功能,例如骨细胞的代谢和干细胞的增殖等[10]。此外,TLR介导的炎症因子的分泌对早期的骨修复起着重要的作用。人的TLR共分为5个亚科、10个亚型。成骨细胞表面主要表达TLR-3和TLR-4[11]。本研究即探讨TLR-4受体在成骨细胞分化及基质矿化的可能分子机制。
1 材料和方法
1.1 实验材料
小鼠成骨细胞株 MC3T3-E1购自于中国科学院上海细胞库,DMEM培养基、胰酶、胎牛血清和青链霉素双抗均购自于美国Gibco公司。四甲基偶氮唑蓝(MTT)、β-甘油磷酸钠和TritonX-100均购于自美国Sigma公司。碱性磷酸酶(alkaline phosphatase,ALP)试剂盒和BCA蛋白浓度测定试剂盒购于碧云天生物科技有限公司。Von Kossa染色试剂盒购自于湖北百奥斯生物技术有限公司。TLR-4抗体、β-actin抗体、辣根酶标记山羊抗小鼠抗体购自于美国CST公司。
1.2 实验方法
1.2.1 miR-494 mimic转染小鼠成骨细胞株MC3T3-E1
miR-494 mimic及其阴性对照均购自于锐博生物科技有限公司。使用含10%血清的DMEM培养基培养小鼠成骨细胞株MC3T3-E1,在37℃,5% CO2培养箱中培养。将MC3T3-E1细胞分为miR-494 mimic转染组和阴性对照组。miR-494 mimic转染组:向培养中加入化学合成的miR-494 mimic和脂质体;阴性对照组:向培养液中加入无义序列miR-494 mimic和脂质体。
1.2.2 qRT-PCR检测miR-494在小鼠成骨细胞株MC3T3-E1中的表达
采用Trizol提取法提取细胞中的总RNA,按照Micro RNA 反转录试剂盒说明书对总RNA进行反转录。反转录体系为20 μL:1 μL总RNA,4 μL 5×Reaction Mix,2 μL 10×Super Script Enzyme Mix,加入双蒸水将体系补足至20 μL,混匀后离心。反应条件为:37℃60 min,95℃5 min,置于4℃保存备用。按照qRT-PCR试剂盒说明书进行转录扩增,反应体系为20 μL。使用SYBR Green染料法进行测定,每个样本设置4个复孔。按照试剂盒说明书的反应条件进行扩增。miR-494的相对表达量用2-△△CT法进行计算。
1.2.3 MTT法检测小鼠成骨细胞株MC3T3-E1转染前后的增殖活性
将小鼠成骨细胞株MC3T3-E1调整至适宜浓度后,接种于96孔板。实验分为阴性对照组和miR-494 mimic转染组,每组设置6个复孔。孵育细胞48 h,实验重复 3 次。培养结束后,每孔加入20 μLMTT溶液,培养4 h,弃上清液,加入150 μL DMSO,37℃下振荡10 min,使用酶标仪测定570 nm处测定吸光度值。
1.2.4 小鼠成骨细胞株MC3T3-E1转染前后ALP活性的测定
阴性对照组和miR-494 mimic转染组的细胞培养结束后,将细胞经胰酶消化后转移至离心管,使用PBS溶液反复冻融细胞后,按照ALP测定试剂盒说明书操作,用来评价小鼠成骨细胞的分化能力。
1.2.5 小鼠成骨细胞株MC3T3-E1转染前后骨钙素(osteocalcin,OC)活性的测定
将小鼠成骨细胞株MC3T3-E1接种于96孔板,分组同上。培养4 d后,使用骨钙素放射免疫分析试剂盒测定小鼠成骨细胞株MC3T3-E1中骨钙素的活力。
1.2.6 小鼠成骨细胞株MC3T3-E1转染前后矿化结节数的测定
本实验采用Vonkossa钙化染色法测定小鼠成骨细胞株MC3T3-E1转染前后的矿化结节数。将小鼠成骨细胞株MC3T3-E1接种于96孔板,分组同上。培养18 d后,使用Vonkossa钙化液对细胞进行换液,之后采用Vonkossa钙化染色法对细胞进行染色。各样本的矿化结节形成情况使用HPIAS-100高清晰度彩色病理图文报告分析系统计算。
1.2.7 Western blot检测转染前后TLR-4蛋白的表达差异
将小鼠成骨细胞株MC3T3-E1接种于6孔板,分组同上。培养结束后,弃去培养液,用裂解液充分裂解细胞后,离心取上清液。使用BCA蛋白浓度试剂盒对提取的总蛋白进行定量。使用上样缓冲液,在沸水浴中使蛋白变性。SDS-PAGE凝胶电泳选取5%的浓缩胶和10%的分离胶,在150 Ma下转膜3 h,使用5%的脱脂奶粉封闭2 h。分别使用TLR-4抗体(1∶1000)和β-actin(1∶500)4℃下孵育过夜。使用二抗(1∶5000)在室温下孵育2 h。使用灰度值软件对蛋白条带进行定量计算。
1.3 统计学处理
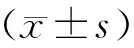
2 结果
2.1 qRT-PCR检测miR-494在小鼠成骨细胞株MC3T3-E1中的表达
如表1所示,qRT-PCR结果显示miR-494在小鼠成骨细胞株MC3T3-E1中的表达量极显著的低于miR-494 mimic转染组(P<0.05),说明miR-494 mimic转染小鼠成骨细胞株MC3T3-E1成功,使miR-494在小鼠成骨细胞株MC3T3-E1中过表达。

表1 miR-494在小鼠成骨细胞株MC3T3-E1中的表达(n=16)
注:与阴性对照组相比,*P<0.05。Note. Compared with negative control group,*P<0.05.
2.2 MTT法检测小鼠成骨细胞株MC3T3-E1转染前后的增殖活性
本实验对miR-494 mimic转染小鼠成骨细胞株MC3T3-E1后,MTT法检测转染0 h、48 h后细胞增殖率的变化。如表2所示,miR-494 mimic转染组的细胞增殖率较阴性对照组显著降低(P<0.05),证实miR-494抑制小鼠成骨细胞株MC3T3-E1的增殖。
2.3 小鼠成骨细胞株MC3T3-E1转染前后ALP活性的测定
本实验检测了小鼠成骨细胞株MC3T3-E1转染前后ALP的活性。结果如表3所示,与阴性对照组相比,miR-494 mimic转染小鼠成骨细胞株MC3T3-E1后,细胞中ALP的活性显著受到抑制(P<0.05)。这说明miR-494会使小鼠成骨细胞株MC3T3-E1中的ALP活力降低。
2.4 小鼠成骨细胞株MC3T3-E1转染前后骨钙素(OC)活性的测定
在成骨细胞分化中期,骨钙素的含量会上升。本实验测定了miR-494 mimic转染后,小鼠成骨细胞株MC3T3-E1中骨钙素的含量。结果如表4所示,与阴性对照组相比,miR-494 mimic转染小鼠成骨细胞株MC3T3-E1后,细胞中OC的活性显著受到抑制(P<0.05)。这说明miR-494会使小鼠成骨细胞株MC3T3-E1中的OC活力降低。
2.5 小鼠成骨细胞株MC3T3-E1转染前后矿化结节数的测定
矿化结节是成骨细胞晚期分化的重要标志。因此,本实验通过检测小鼠成骨细胞株MC3T3-E1中矿化结节的数目,反映miR-494对成骨细胞晚期分化的程度。结果如表5所示,阴性对照组中的成骨细胞形成了圆形矿化结节,且边界清晰。miR-494 mimic转染组细胞形成的矿化结节数显著低于阴性对照组(P<0.05)。说明miR-494会抑制成骨细胞形成矿化结节。
2.6 小鼠成骨细胞株MC3T3-E1转染前后TLR-4蛋白的表达差异
本实验测定了miR-494 mimic转染细胞后,细胞中TLR-4蛋白的表达差异。结果如表6所示,Western blot检测结果表明,与阴性对照组相比,miR-494 mimic转染组细胞中TLR-4蛋白表达量显著升高(P<0.05)。说明miR-494会增加小鼠成骨细胞株MC3T3-E1中TLR-4蛋白的表达量,即miR-494可能通过TLR-4通路抑制成骨细胞分化及基质矿化。
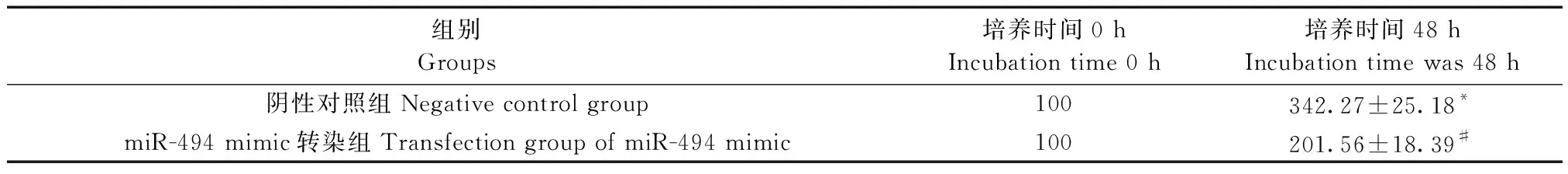
表2 小鼠成骨细胞株MC3T3-E1转染前后的增殖率(n=16,%)
注:与阴性对照组培养0 h相比,*P<0.05;与阴性对照组培养48 h相比,#P<0.05。Note. Compared with negative control group (Incubation time 0 h),*P<0.05. Compared with negative control group (Incubation time was 48 h),#P<0.05.

表3 小鼠成骨细胞株MC3T3-E1转染前后ALP活性(n=16)
注:与阴性对照组相比,*P<0.05。Note. Compared with negative control group,*P<0.05.

表4 小鼠成骨细胞株MC3T3-E1转染前后OC活性(n=16)
注:与阴性对照组相比,*P<0.05。Note. Compared with negative control group,*P<0.05.

表5 小鼠成骨细胞矿化结节形成情况比较(n=16)
注:与阴性对照组相比,*P<0.05。Note. Compared with negative control group,*P<0.05.

表6 小鼠成骨细胞TLR-4蛋白的表达差异(n=16)
注:与阴性对照组相比,*P<0.05。Note. Compared with negative control group,*P<0.05.
3 讨论
骨质疏松是临床常见的骨科疾病,会出现骨骼密度降低、脆性增加、骨折或腰背疼痛等现象[12]。骨骼的矿化是维持人体骨骼正常状态的关键,这一过程主要由成熟的成骨细胞分泌细胞外基质,与体内的无机盐共同完成,从而实现骨骼的正常代谢[13]。因此,起源于骨髓基质间质细胞的成骨细胞,主要参与增殖、分化以及基质钙化[14]。MC3T3-E1来源于C57BL/6小鼠的颅盖骨细胞,具有成骨细胞的生物学特性,因此作为成骨细胞研究中的体外模型[15]。
在本研究中,miR-494 mimic转染结果显示,与阴性对照组相比,小鼠成骨细胞株MC3T3-E1转染后的miR-494的mRNA的表达量显著升高,说明miR-494 mimic转染小鼠成骨细胞株MC3T3-E1,成功使miR-494过表达。MTT法检测结果表明:miR-494 mimic转染组的细胞增殖率较阴性对照组显著降低,证实miR-494抑制小鼠成骨细胞株MC3T3-E1的增殖。
ALP是成骨细胞膜上所分泌的一种钙结合转运蛋白,能够促进细胞的成熟和钙化[16]。ALP在细胞内的表达量可以作为衡量成骨细胞分化程度的指标,应用十分广泛。ALP的活性会随着成骨细胞不断成熟而呈上升趋势,当骨细胞的增殖和分化受到抑制时,成骨细胞的矿化作用受阻,ALP的活性降低[17]。在本实验中,miR-494 mimic转染组细胞中的ALP活性显著低于阴性对照组,说明miR-494会使小鼠成骨细胞株MC3T3-E1的早期分化能力降低。骨钙素是维持骨组织正常钙化的必需因子,ALP和骨钙素(OC)分别是成骨细胞分化早期和分化中期的标志物[18]。本实验结果表明,与阴性对照组相比,miR-494 mimic转染组MC3T3-E1细胞中骨钙素的活力显著降低。上述结果提示miR-494具有抑制成骨细胞MC3T3-E1中期分化的作用。
矿化结节是衡量骨细胞晚期分化程度的指标,是成骨细胞分化成熟的阶段,是成骨功能的形态表现[19]。Von Kossa钙化染色法的原理是:将矿化基质中的碳酸盐和磷酸盐转化为碳酸银和磷酸银,然后将银离子还原成银后进行测定。Von Kossa钙化染色法可以通过矿化结节的数目,反映成骨细胞的钙化程度。本实验证实,与阴性对照组相比,miR-494 mimic转染组MC3T3-E1细胞中矿化结节的数目显著降低。说明miR-494会抑制MC3T3-E1细胞的矿化。
TLR-4是细胞膜上一种重要的跨膜受体,不仅参与机体内细胞的增殖、分化及凋亡,还参与骨代谢功能的调控[20]。研究证实,TLR-4受体上调会抑制骨细胞的增殖和分化。在成骨细胞中,TLR-4通路是参与调控细胞增殖和分化的重要通路之一[21-22]。因此,本研究通过Western blot检测了小鼠成骨细胞中TLR-4的蛋白表达,初步探讨miR-494对成骨细胞的潜在作用机制。结果表明,miR-494可上调成骨细胞中TLR-4的蛋白表达,该作用可能是miR-494抑制成骨细胞增殖和分化的潜在机制。
综上所述,miR-494能够通过TLR-4通路抑制小鼠成骨细胞株MC3T3-E1的增殖活力,降低细胞中ALP、OC的活力,减少成骨细胞中的矿化结节数,抑制成骨细胞分化及基质矿化。
