自噬对成骨细胞调控作用的研究进展
2018-12-19郭健民章岚
郭健民 章岚
1. 山东体育学院研究生教育学院,山东 济南 250102 2.上海体育学院运动科学学院,上海 200438
自噬是细胞的一种自我消化行为,是真核细胞吞噬自身细胞质蛋白或细胞器的主要代谢过程[1]。在这个过程中细胞质内容物被包被进囊泡,并与溶酶体相融合形成自噬溶酶体,其中的内容物被降解以满足细胞新陈代谢和更新细胞器的需求[2]。自噬在所有的细胞中均可发生,诱导细胞应激的因素如缺氧、热量限制、氧化应激的积累等均可诱导自噬。自噬主要有三种类型:大自噬、小自噬和分子伴侣自噬[3],我们通常所说的自噬是指大自噬。一般情况下自噬分为四个主要步骤:启动、延伸、成熟和降解。Beclin-1、LC3(microtubuleassociated protein 1 A/1B light chain 3)、p62以及自噬相关基因(autophagy-related gene,ATG)参与自噬的主要过程,并被作为常用的自噬标志物[4]。自噬在正常和应激情况下均可调控细胞死亡、控制细胞生长和分化,已有的研究表明自噬可能是通过细胞器和蛋白质的转换,来改变细胞分化和发育过程中结构的变化,但其作用机制尚未完全明确[1]。
成骨细胞是由多能间充质干细胞分化而来的单核细胞,间充质干细胞也可以分化为成纤维细胞、软骨细胞、成肌细胞、脂肪细胞,该分化过程受相关信号转导通路的调控[5]。成骨细胞是骨形成的主要功能细胞,主要负责骨基质的合成、分泌和矿化。成骨细胞可以产生细胞外基质蛋白和基质矿化调节因子,以此参与早期的骨形成和晚期的骨重建。成骨细胞主导的骨形成主要包括成骨细胞的增殖、分化和矿化三个过程,该过程受到严格的调控,若调控异常会导致包括骨质疏松在内的骨疾病发生[6]。最新研究表明自噬相关基因介导间充质干细胞向成骨细胞分化的过程,同时在成骨细胞的活性、增殖、凋亡、分化以及骨基质的矿化中发挥关键性的调控作用(表1)。此外自噬还可通过调控成骨细胞功能活性,在骨质疏松和骨折愈合中发挥关键性作用。
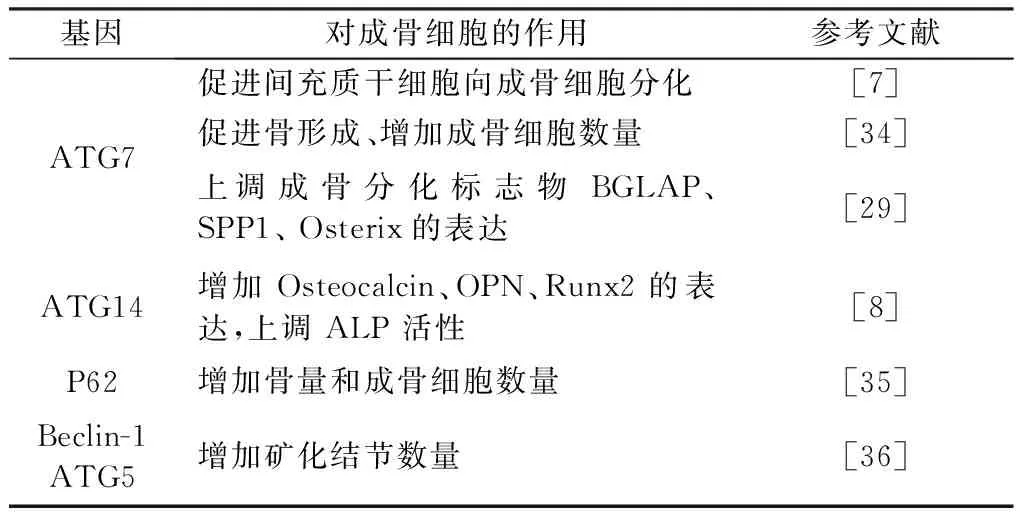
表1 自噬相关基因对成骨细胞的影响Table 1 The effect of autophagy-related genes on osteoblasts
1 自噬对成骨细胞形成的调控
成骨细胞来源于间充质干细胞,主要负责骨形成和发育[7]。间充质干细胞向成骨细胞的分化受到相关的成骨分化因子Runx2(runt-related transcription factor 2)、PPARγ2(peroxisome proliferator-activated receptor γ2)、Osterix、BMP(bone morphogenetic protein)等的调控[5],最新研究发现自噬在该分化过程中呈现不同的水平,并通过影响成骨相关因子的表达参与调控该过程。Homma等[8]研究发现在hMSCs(human mesenchyymal stem cells)向成骨细胞分化的过程中LC3B的表达显著增加,而通过敲除ATG7抑制hMSCs自噬后,在14 d时钙化结节的数量显著减少,这表明自噬可促进间充质干细胞向成骨细胞分化。此外Huang等[9]的研究也发现在间充质干细胞向成骨细胞分化的过程中,miR-211和ATG14的表达均显著增加,使用siRNA抑制miR-211或ATG14的表达后,成骨分化标志物Osteocalcin、OPN(osteopontin)、Runx2的表达以及ALP(alkaline phosphatase)的活性均下降,该研究还发现抑制miR-211的表达后,ATG14蛋白和mRNA的表达也会相应的减少,这表明自噬相关基因介导了间充质干细胞向成骨细胞分化的过程,而microRNA作为调控自噬相关基因的上游也参与其中。Ichimura等[10]研究发现长时间使用艾滋病蛋白Nef干预间充质干细胞,会抑制细胞的增殖、诱导其衰老,并且会抑制LC3、Beclin-1的表达,增加P62的表达,同时还会使成骨分化标志物Runx2和Osteocalcin的表达降低,进而抑制间充质干细胞向成骨细胞分化,而使用雷帕霉素激活细胞自噬可有效的反转Nef对间充质细胞的损害,这表明在应激情况下自噬也参与间充质干细胞向成骨细胞分化的过程。
2 自噬对成骨细胞功能的影响
2.1 自噬对成骨细胞活力、凋亡、增殖的影响
自噬是细胞的一种自我保护机制,在不同的应激状况下适度激活自噬可有效的保护成骨细胞的活性和功能,但过度激活自噬或抑制自噬均会对细胞产生不利影响。地塞米松是一种常见的糖皮质激素,常作为抗炎药和免疫抑制药物用于各种疾病的治疗。长期或者过量使用糖皮质激素会导致骨质疏松和股骨头坏死[11-12],而最新研究表明地塞米松过度激活成骨细胞自噬,这可能是导致上述疾病的主要原因。Kang等[13]研究发现使用0.1、1、10 μmol/L的地塞米松干预MC3T3-E1成骨细胞24 h后,可诱导细胞自噬,增加成骨细胞凋亡、降低细胞活性,同时加入地塞米松和自噬抑制剂3-MA(3-Methyladenine)后,成骨细胞活性增加、凋亡率下降,这表明在较高剂量(>10-8mol/L)的地塞米松干预下自噬对细胞具有损害作用。Kenanidis等[14]研究发现低剂量的地塞米松(10-8、10-9mol/L)可显著增加细胞活性,其中10-8mol/L的地塞米松诱导自噬的效果最佳,自噬在6 h时达到峰值,同时加入地塞米松(10-8mol/L)和3-MA后,细胞活性降低,且在正常情况下抑制自噬对细胞活性未产生显著影响,这表明在低剂量的地塞米松干预下自噬对细胞活性具有保护作用。上述研究结果表明低剂量的地塞米松可适度激活自噬,对成骨细胞有保护、促进作用,而高剂量的地塞米松则会过度激活自噬,对成骨细胞产生不利影响,这为进一步明确糖皮质激素对人体骨骼影响的机制提供了有力的依据。
已有研究[15-16]表明自噬介导了骨骼疾病治疗药物发挥功效的过程,同时过度的激活或抑制自噬也被认为是某些药物如双膦酸盐产生毒副作用的主要原因。双膦酸盐是常见的骨质疏松治疗药物,但长期使用会加速骨骼病变,严重的可引起颚骨坏死。Levine等[17]研究发现双膦酸盐会降低成骨细胞(hFOB 1.19)的活性并诱导其凋亡,高良姜素则可有效的激活成骨细胞自噬,进而反转双膦酸盐对成骨细胞的损害,但抑制自噬后高良姜素对成骨细胞的保护作用减弱,这表明类黄酮可通过激活细胞自噬来维持细胞的活性。氨基葡萄糖是治疗骨性关节炎的有效药物,但其对成骨细胞的影响尚不明确。Li等[18]研究发现低剂量(<0.6 mmol/L)的氨基葡萄糖在24 h和48 h时可显著增加成骨细胞活性、促进细胞增殖,并可诱导细胞自噬,而高剂量(>0.8 mmol/L)的氨基葡萄糖会显著降低细胞活性、抑制细胞增殖和自噬;同时使用自噬抑制剂3-MA和低剂量的氨基葡萄糖干预成骨细胞48 h后,成骨细胞中自噬标志物LC3、Beclin 1的表达增加,p62表达降低,同时细胞活性和增殖显著降低,这表明在低剂量的氨基葡萄糖干预下,自噬可促进成骨细胞增殖。钽纳米材料是比钛更好的生物替换材料,其具有更高的润湿性和更大的表面能,可以更好的促进早期生物固定[19]。Liu等[20]研究发现10μg/mL的钽纳米粒子可使MC3T3-E1细胞的活性增加20% 和18.7%,同时增加LC3B的表达,降低p62的表达;使用钽纳米粒子干预成骨细胞24 h后,加入雷帕霉素或3-MA干预1 h发现,激活自噬可显著增加成骨细胞活性,而抑制自噬可以逆转钽纳米粒子对细胞活性的促进作用,这表明钽纳米粒子刺激下自噬可促进成骨细胞的活性。
在大多数应激情况下,适宜的自噬都会对成骨细胞起到相应的保护作用,促进成骨细胞增殖并减少凋亡。自噬介导了各类骨疾病治疗药物对成骨细胞的影响,但目前自噬影响成骨细胞活性的机制尚未完全阐明。已有的研究[21]表明自噬可能通过转运蛋白DMT1(divalent metal transporter 1)和相关的信号通路RAGE/Raf/MEK/ERK[22]实现对成骨细胞活性的调控。明确自噬的调控机制并将其应用于临床骨骼疾病药物的研发将是未来的一大研究热点。
2.2 自噬对成骨细胞骨形成作用的影响
成骨细胞在骨形成和骨重塑中发挥重要的作用,其通过骨基质的合成、分泌和矿化来控制骨重塑。细胞外基质矿化发生在成骨细胞分化的终末期,并被认为是成骨细胞成熟的标志[23]。已有研究[24-25]表明成骨细胞的分化可以影响骨形成,成骨细胞分化和功能的缺失会导致各种疾病如:骨质疏松、骨折愈合迟缓、股骨头坏死等。无论是细胞实验还是在体实验中都证实,自噬对成骨细胞的功能产生一定的影响。Neve等[26]研究发现在MC3T3-E1细胞中激活AMPK(adenosine 5’-monophosphate (AMP)-activated protein kinase)可诱导成骨细胞自噬,增加LC3B的表达、降低p62的表达,同时还可促进成骨细胞分化和矿化,使用3-MA抑制成骨细胞自噬后,成骨分化标志物ALP、OCN和Runx2的表达下降,这表明在AMPK活化的情况下自噬对成骨细胞的骨形成具有促进作用。Nollet等[27]研究发现在正常情况下,抑制或激活自噬不会对成骨细胞分化标志物Runx2、Colla1、OCN的表达产生影响,而在有地塞米松干预的情况下抑制自噬会降低上述三个成骨分化标志物的表达,激活自噬会增加这三个基因的表达。Ozeki等[28]研究发现10 μmol/L的山奈酚不会对MC3T3-E1成骨细胞的活性产生显著影响,但可增加Runx2、Osterix、BMP-2 和I型胶原的表达,进而诱导成骨细胞分化和矿化,同时Western-blot检测发现自噬标志物LC3表达增加、P62表达降低,加入3-MA抑制自噬后,成骨分化标志物Runx2、Osterix、BMP-2的表达降低,这表明在山奈酚干预下自噬可促进成骨细胞的分化和矿化。Ozeki等[29]研究发现BMP-2可诱导成骨细胞分化同时增加ATG7的表达,使用siRNA抑制ATG7的表达后,成骨细胞分化标志物BGLAP(bone gamma carboxyglutamate protein)、SPP1(secretedphosphoprotein1)和Osterix的表达减少,反转了BMP-2对成骨分化的促进作用,这表明BMP可通过增加自噬来促进成骨分化。
上述细胞实验表明,在正常情况下激活或抑制自噬不会对成骨细胞的分化和矿化产生影响,但在地塞米松、山奈酚、AMPK活化等情况下,自噬可有效的促进成骨细胞分化和骨基质的矿化。此外在动物实验中也发现自噬影响成骨细胞分化和骨生成。ATG7参与吞噬泡的伸长和LC3的脂化[30]。Puri等[31]通过杂合子小鼠杂交建立成骨细胞谱系缺失ATG7的模型发现,ATG7缺失后小鼠的骨量、骨小梁数量、骨小梁厚度均显著下降,同时成骨细胞的数量以及骨生成速率也显著下降,这表明抑制成骨细胞自噬水平会使成骨细胞的功能受限。Quarles等[32]研究发现在小鼠成骨细胞中敲除p62后,小鼠的骨量、骨小梁厚度、成骨细胞的数量均显著低于野生型小鼠,同时还能激活NF-κB通路,而NF-κB抑制剂 可反转p62缺失对成骨分化标志物表达的影响,这表明在成骨细胞中自噬缺失会激活NF-κB通路进而抑制成骨分化。Beclin-1参与自噬的启动过程,并且可以调控自噬体的形成和成熟[33-34]。Tchetina等[35]研究发现在成骨细胞系UMR-106和原代成骨细胞矿化的过程中LC3的表达均显著增加,抑制UMR-106细胞中ATG7和Beclin-1的表达后,矿化结节的数量显著减少,此外该研究还通过建立成骨细胞中限定性敲除基因ATG5的小鼠模型发现,ATG5的缺失同样会降低成骨细胞的矿化能力,这表明自噬在成骨细胞矿化的过程起关键性的促进作用。Weinstein等[36]研究发现低剂量和高剂量的褪黑素可增加2型糖尿病小鼠的骨密度、骨小梁数量和骨小梁厚度,同时降低骨组织中LC3和Beclin-1的表达;通过细胞实验发现,高糖会使hFOB 1.19 细胞自噬水平提高,成骨分化能力降低,而使用褪黑素和3-MA均可有效的抑制成骨细胞自噬,提高成骨标志物ALP和OCN的表达进而促进成骨分化。
早期的骨骼发育以及后期的骨重塑中,骨形成都是持续存在的;骨形成活动异常会导致骨骼发育异常和骨骼疾病。上述研究表明自噬相关基因ATG7、Beclin-1、p62、ATG5等均介导了成骨细胞的骨形成过程。通过明确自噬对成骨细胞功能的影响,为探索骨骼病理状况发生机制提供有力的理论支撑。
3 自噬在骨疾病中对成骨细胞的调控
骨质疏松是一种以全身性骨量减少以及骨组织微观结构退化为特征的疾病,会导致骨强度降低、脆性增加、骨折风险增加。在绝经后骨质疏松病人和骨质疏松动物模型中成骨细胞的活性均显著下降[37]。Yang等[38]研究发现在绝经后骨质疏松患者外周血中 mTOR、Runx2和ALPL的表达较正常人下降,相关性分析发现mTOR的表达与Runx2的表达正相关,股骨骨密度与Runx2的表达存在正相关,这表明绝经后骨质疏松患者骨密度的降低可能与自噬相关基因mTOR存在关联。对骨质疏松大鼠给于β-蜕皮甾酮干预后,大鼠成骨标志物Runx2、BMP2与自噬标志物Beclin-1、ATG5、LC3I/II、Bcl-2的表达均显著增加,microCT检测发现大鼠椎骨的骨密度、骨量、骨小梁的数量、骨小梁厚度均显著增加[39],这表明自噬水平的增加与骨质疏松的缓解存在关联。
骨折是一种常见的损伤,骨折愈合迟缓或骨不连在骨折中发生的概率为5%~10%[40]。Zhang等[41]研究发现在股骨骨折的大鼠模型中,骨组织自噬水平在24 h时达到峰值,之后逐渐下降,但在3天和7天时仍高于对照组;使用雷帕霉素干预后骨折的愈合显著加快,并可增加细胞的自噬水平,降低Bax的表达,增加Bcl-2的表达,显著减小骨折骨小梁间隙、增加骨小梁周围成骨细胞数量。Zhu等[42]的研究也发现对股骨骨折的大鼠给于雷帕霉素干预后,大鼠骨组织中rpS6的表达受到抑制,LC3的表达增加,同时骨折处愈伤组织矿化和愈伤组织形成增加。这表明在骨折中激活自噬可提高成骨细胞的活性和增殖、抑制成骨细胞凋亡、促进骨形成进而加速骨折愈合。
在骨质疏松和骨折中,自噬可通过对成骨细胞功能和活性的调控影响疾病的发生发展,这为临床骨疾病的治疗提供潜在的靶点。
4 小结
众多的研究表明自噬可通过维持成骨细胞的活性来维持机体骨量的平衡。细胞实验和在体实验也都证实了自噬在正常情况下和不同的应激下,对成骨前体细胞向成骨细胞分化的过程以及成骨细胞的活性、增殖、凋亡和矿化等产生一定影响。过度激活或抑制自噬均会对细胞产生损害,适宜的自噬水平则会对成骨细胞的功能活性起促进作用,但其作用机制尚未完全明确。此外在骨质疏松等骨疾病中自噬发挥重要的调控作用[43],目前的研究主要集中于自噬的作用机制,未来需要通过更多的临床实验来探究自噬功能障碍与骨质疏松之间的关系,从而研究出预防和治疗骨质疏松新方法。
