氧化低密度脂蛋白通过CD36介导的氧化应激诱导巨噬细胞自噬*
2015-03-30姚树桐李严严刘庆华杨娜娜秦树存泰山医学院动脉粥样硬化研究所山东省高校动脉粥样硬化重点实验室基础医学院附属医院检验科泰安市中心医院内分泌科山东泰安7000
姚树桐,李严严,刘庆华,岳 峰,田 华,桑 慧,杨娜娜,秦树存△(泰山医学院动脉粥样硬化研究所,山东省高校动脉粥样硬化重点实验室,基础医学院,附属医院检验科,泰安市中心医院内分泌科,山东泰安7000)
氧化低密度脂蛋白通过CD36介导的氧化应激诱导巨噬细胞自噬*
姚树桐1,2△▲,李严严1▲,刘庆华3,岳峰4,田华1,桑慧2,杨娜娜1,秦树存1△
(泰山医学院1动脉粥样硬化研究所,山东省高校动脉粥样硬化重点实验室,2基础医学院,3附属医院检验科,4泰安市中心医院内分泌科,山东泰安271000)
[摘要]目的:研究氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)对巨噬细胞自噬的诱导作用,并探讨可能的分子机制。方法:体外培养RAW264.7巨噬细胞,给予抗CD36单克隆抗体(2 mg/L)、二亚苯基碘鎓(diphenyleneiodonium,DPI;5 μmol/L)、3-甲基腺嘌呤(3-methyladenine,3-MA; 3 mmol/L)或雷帕霉素(1 μmol/L)预处理1 h,再加入ox-LDL(100 mg/L)继续培养12 h。采用MTT法检测细胞活力,采用相应试剂盒测定培养液乳酸脱氢酶(lactic dehydrogenase,LDH)、细胞内烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶、超氧化物歧化酶(superoxide dismutase,SOD)活性以及活性氧簇(reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA)水平,以评价细胞膜完整性和氧化应激反应。采用免疫印迹技术检测自噬标志分子beclin-1和微管相关蛋白1轻链3-II(microtubule-associated protein 1 light chain 3-II,LC3-II)表达变化。结果: ox-LDL诱导巨噬细胞自噬反应,表现为beclin-1和LC3-II上调;与自噬抑制剂3-MA相似,抗CD36单抗可显著抑制ox-LDL所诱导的LC3-II和beclin-1表达。抗CD36单抗明显抑制ox-LDL所诱导的氧化应激,包括抑制NADPH氧化酶活性和ROS、MDA水平以及升高SOD活性,其作用与NADPH氧化酶抑制剂DPI相似。另外,DPI显著抑制ox-LDL所诱导的beclin-1和LC3-II表达,且ox-LDL所诱导的细胞活力降低和LDH漏出可被3-MA促进并可被自噬诱导剂雷帕霉素拮抗。结论: ox-LDL可诱导巨噬细胞自噬,其机制可能与CD36介导ox-LDL摄取进而触发的氧化应激有关,且一定程度的自噬可减轻ox-LDL所诱导的巨噬细胞损伤。
[关键词]自噬;氧化低密度脂蛋白; CD36;氧化应激;巨噬细胞
[修回日期]2015-03-03
▲并列第1作者
Oxidized low-density lipoprotein induces autophagy in macrophages via CD36-mediated oxidative stress
YAO Shu-tong1,2,LI Yan-yan1,LIU Qing-hua3,YUE Feng4,TIAN Hua1,SANG Hui2,YANG Na-na1,QIN Shu-cun1
(1Institute of Atherosclerosis,Key Laboratory of Atherosclerosis in Universities of Shandong,2College of Basic Medical Sciences,3Department of Clinical Laboratory,Affiliated Hospital,Taishan Medical University,4Department of Endocrinology,The Central Hospital of Taian,Taian 271000,China.E-mail: yst228@126.com; shucunqin@ hotmail.com)
[ABSTRACT]AIM: To investigate the effect of oxidized low-density lipoprotein (ox-LDL) on autophagy in macrophages and the underlying molecular mechanisms.METHODS: RAW264.7 macrophages were pretreated with 2 mg/L anti-CD36 monoclonal antibody (anti-CD36 mAb),5 μmol/L diphenyleneiodonium (DPI),3 mmol/L 3-methyladenine (3-MA) or 1 μmol/L rapamycin for 1 h and then treated with ox-LDL (100 mg/L) for 12 h.The viability of the cells was measured by MTT assay.The activities of lactic dehydrogenase (LDH) in the medium and nicotinamide adenine dinucleotide phosphate (NADPH) oxidase,superoxide dismutase (SOD) in the cells as well as the levels of intracellular reactive oxygen species (ROS) and malondialdehyde (MDA) were determined to characterize the membrane integrity and the oxidative stress,respectively.The protein levels of beclin-1 and microtubule-associated protein 1 light chain 3-II (LC3-II),2 important molecular markers of autophagy,were examined by Western blotting.RESULTS: ox-LDL induced autophagy inRAW264.7 macrophages as assessed by upregulation of beclin-1 and LC3-II.Similar to 3-MA,an autophagy inhibitor,anti-CD36 mAb significantly inhibited the ox-LDL-induced upregulation of beclin-1 and LC3-II.Anti-CD36 mAb suppressed the ox-LDL-induced oxidative stress as revealed by decreased NADPH oxidase activation,ROS and MDA generation as well as increased SOD activity.Similar results were observed in the cells pretreated with DPI,a NADPH oxidase inhibitor.Moreover,DPI significantly inhibited the ox-LDL-induced upregulation of beclin-1 and LC3-II.Inaddition,the decrease in the cell viability and increase in LDH release induced by ox-LDL were promoted by 3-MA and blocked by rapamycin (an autophagy inducer).CONCLUSION: ox-LDL induces autophagy in RAW264.7 macrophages,which may be involved in CD36-mediated ox-LDL uptake and subsequent activation of oxidative stress,and moderate activation of autophagy may protect macrophages from ox-LDL-induced injury.
[KEY WORDS]Autophagy; Oxidized low-density lipoprotein; CD36; Oxidative stress; Macrophage
动脉粥样硬化(atherosclerosis,AS)作为心脑血管疾病的主要病理基础,是一个复杂的多细胞参与的慢性炎症性病理过程,其中修饰后的脂蛋白尤其是氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)所诱导的巨噬源性泡沫细胞形成和死亡是AS发展的核心环节和造成斑块不稳定的决定性因素,进而导致急性心血管事件的发生,因此巨噬细胞已成为减缓AS进展尤其是降低心脑血管病事件发生率的重要治疗靶点[1]。自噬是细胞将受损、变性的蛋白质以及损伤细胞器运输到溶酶体进行消化降解,以胞质内出现自噬体为特征的细胞自我消化过程,是细胞在应激情况下用来维持细胞内环境稳定和存活的一种重要防御机制[2]。近年来研究表明,AS斑块中存在巨噬细胞自噬[3],且自噬的激活可减轻AS病变,增强斑块的稳定性[4],但其机制尚未完全阐明。CD36是介导ox-LDL大量摄取进而导致泡沫细胞形成的主要清道夫受体,本课题组既往研究证实,CD36可介导ox-LDL所诱导的巨噬细胞内质网应激反应[5],而槲皮素可通过下调CD36表达减轻ox-LDL所诱导的巨噬细胞脂质蓄积和氧化应激反应[6],但是ox-LDL是否通过CD36触发巨噬细胞自噬尚不清楚。本工作以ox-LDL与鼠源RAW264.7巨噬细胞共同孵育,研究细胞内自噬关键分子beclin-1和标志分子微管相关蛋白1轻链3-II (microtubule-associated protein 1 light chain 3-II,LC3-II)表达变化及CD36和氧化应激在其中的作用,以探讨ox-LDL对巨噬细胞自噬的诱导作用及机制。
材料和方法
1材料与试剂
ox-LDL购自北京协生生物科技有限公司; DMEM高糖培养基和胎牛血清为Gibco产品;2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofluorescein diacetate,DCHF-DA)和抗CD36单克隆抗体(anti-CD36 mAb)分别购自Molecular Probes和Abcam; RIPA裂解液和BCA蛋白定量试剂盒为Solarbio产品;兔抗beclin-1和LC3多克隆抗体购自Santa Cruz;雷帕霉素、3-甲基腺嘌呤(3-methyladenine,3-MA)、二亚苯基碘鎓(diphenyleneiodonium,DPI)和兔抗β-actin抗体购自Sigma;辣根过氧化物酶标记山羊抗兔IgG为北京中杉金桥公司产品;四甲基偶氮唑蓝[3-(4,5-dimeth-ylthiazol-2-y-l ) -2,5- diphenyl-2H-tetrazolium bromide,MTT]购自Genview;增强化学发光(enhanced chemiluminescence,ECL)试剂盒和PVDF膜分别为Pierce和Millipore产品;烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶测定试剂盒从上海杰美科技公司购买;乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)测定试剂盒购于南京建成生物技术公司;其余试剂均为分析纯。
2方法
2.1细胞培养与实验分组鼠源RAW264.7巨噬细胞购自中国科学院上海生物化学与细胞生物学研究所细胞库,用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM高糖培养基在37℃、5% CO2的培养箱中培养。处理前换无血清DMEM培养基同步化12 h,然后随机分为如下6组: (1)正常对照(control)组:培养液中常规培养; (2) ox-LDL 组:培养液中加入100 mg/L ox-LDL; (3)抗CD36单抗阻断(anti-CD36 mAb+ ox-LDL)组:培养液中先加入2 mg/L anti-CD36 mAb预处理1 h,再加入100 mg/L ox-LDL; (4) NADPH氧化酶抑制剂DPI预处理(DPI+ ox-LDL)组:培养液中先加入5 μmol/L DPI预处理1 h,再加入100 mg/L ox-LDL; (5)自噬抑制剂3-MA预处理(3-MA+ ox-LDL)组:培养液中先加入3 mmol/L 3-MA预处理1 h,再加入100 mg/L ox-LDL; (6)自噬诱导剂雷帕霉素预处理(rapamycin+ ox-LDL)组:培养液中先加入1 μmol/L rapamycin预处理1 h,再加入100 mg/L ox-LDL。各组培养12 h后收集细胞。
2.2细胞活力和LDH测定将细胞接种于96孔板,细胞经处理后,按既往报道的MTT分析方法[7]检测细胞活力。以正常对照组细胞活力为100%,其余各组细胞活力以其吸光度(A)值占对照组A值的百分比表示。
为进一步检测细胞损伤程度,按照LDH活性检测试剂盒说明书测定培养基中LDH水平。
2.3活性氧簇(reactive oxygen species,ROS)水平的测定细胞培养于6孔板中,处理后的细胞用PBS洗涤2次,加入用无血清DMEM培养基稀释的终浓度为10 μmol/L的DCHF-DA,细胞培养箱中避光孵育30 min。收集洗涤细胞,并用PBS重悬,在流式细胞仪(Becton-Dickinson)上检测细胞平均荧光强度。
2.4细胞内SOD活性和MDA含量的测定细胞经处理后,收集细胞,并重悬于0.5 mL裂解缓冲液中,用电动细胞破碎机裂解,1 500 r/min离心10 min,收集上清,根据试剂盒说明书检测SOD活性和MDA含量,分别以1×103U/g蛋白和μmol/g蛋白表示。
2.5 NADPH氧化酶活性测定应用光泽精增强化学发光法测定细胞内NADPH氧化酶活性,具体方法依据试剂盒说明书操作。
2.6 Western blotting分析细胞用RIPA裂解缓冲液在冰浴中裂解并提取总蛋白,BCA法测定蛋白浓度。热变性后,等量的各组总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离(8%~10%分离胶),然后电转印移到PVDF膜。室温下5%脱脂奶粉封闭2 h后,I抗孵育4℃过夜。洗膜后,用辣根过氧化物酶标记的相应II抗室温下孵育2 h。蛋白条带通过ECL反应显示,应用Chemi Q4800 mini型化学发光成像系统(上海欧翔科学仪器有限公司)进行图像采集。采用Image-Pro Plus软件分析蛋白条带积分吸光度(integrated absorbance,IA)值,以靶蛋白IA值与β-actin IA值的比值反映靶蛋白相对表达水平。
3统计学处理
结果用均数±标准差(mean±SD)表示。用SPSS 13.0统计软件进行单因素方差分析,组间两两比较应用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1抗CD36单抗抑制ox-LDL所诱导的RAW264.7巨噬细胞自噬
Beclin-1是自噬启动的关键分子;自噬发生后,LC3-I经泛素样加工修饰形成LC3-II,进而整合到自噬体膜中,在自噬体形成中起重要作用,因此beclin-1和LC3-II可作为自噬的标志分子。以ox-LDL处理RAW264.7细胞12 h,LC3-II和beclin-1水平较对照组显著增加(P<0.01),说明ox-LDL可诱导巨噬细胞自噬;与自噬抑制剂3-MA相似,抗CD36单抗阻滞清道夫受体CD36后,可显著抑制ox-LDL所诱导的LC3-II和beclin-1表达(P<0.05),表明抗CD36抗体可抑制ox-LDL所诱导的巨噬细胞自噬,见图1。
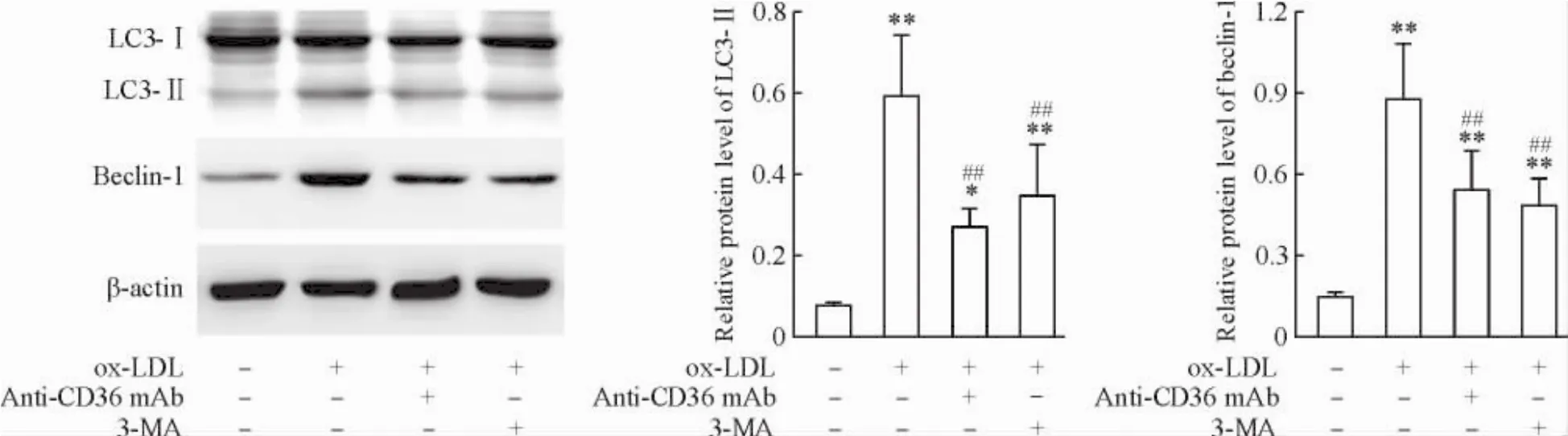
Figure 1.Anti-CD36 mAb inhibited ox-LDL-induced autophagy in RAW264.7 macrophages.Mean±SD.n=4.*P<0.05,**P<0.01 vs control group;##P<0.01 vs ox-LDL group.图1抗CD36单抗抑制ox-LDL所诱导的RAW264.7巨噬细胞自噬
2抗CD36单抗抑制ox-LDL诱导的氧化应激反应
如图2所示,ox-LDL组细胞内ROS和MDA水平较对照组均明显升高,而SOD活性显著降低(P<0.01) ;而与氧化应激抑制剂DPI相似,抗CD36单抗可抑制ox-LDL所诱导的氧化应激反应,表现为ROS 和MDA含量降低(P<0.05),SOD活性增加(P<0.05)。
3抗CD36单抗抑制ox-LDL所诱导的NADPH氧化酶活化
NADPH氧化酶是血管系统催化ROS生成导致氧化应激的主要酶。与NADPH氧化酶抑制剂DPI相似,抗CD36单抗可抑制ox-LDL所诱导的NADPH氧化酶活性上调,其活性较ox-LDL组降低21.7% (P<0.05)。以上结果表明,CD36介导ox-LDL所诱导巨噬细胞氧化应激和自噬反应,见图3。

Figure 2.Inhibitory effects of anti-CD36 mAb on ox-LDL-induced oxidative stress in RAW264.7 macrophages.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs ox-LDL group.图2抗CD36单抗抑制ox-LDL所诱导的氧化应激反应
4 DPI抑制ox-LDL所诱导的巨噬细胞自噬
为进一步证明氧化应激在ox-LDL所诱导的自噬反应中的作用,我们研究了DPI对ox-LDL所致自噬反应的影响。结果显示,与ox-LDL组比较,DPI预处理组LC3-II和beclin-1蛋白水平分别降低了37.2%和40.0% (P<0.05),见图4。
5 ox-LDL诱导细胞毒性的作用可被3-MA促进而被雷帕霉素拮抗
为了证明自噬在ox-LDL所致细胞损伤中的作用,研究了自噬抑制剂3-MA和自噬诱导剂雷帕霉素对ox-LDL所致细胞毒性的影响。如图5所示,3-MA促进了ox-LDL所诱导的细胞损伤,表现为细胞活力降低和LDH漏出进一步加重(P<0.05) ;而雷帕霉素则可拮抗ox-LDL所诱导的细胞损伤,使细胞活力增加和LDH漏出减少(P<0.05),表明自噬可减轻ox-LDL所诱导的细胞损伤。

Figure 3.Anti-CD36 mAb inhibited ox-LDL-induced NADPH oxidase activation in RAW264.7 macrophages.Mean ±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs ox-LDL group.图3抗CD36单抗抑制ox-LDL所诱导的NADPH氧化酶活化

Figure 4.DPI inhibited ox-LDL-induced autophagy in RAW264.7 macrophages.Mean±SD.n=4.**P<0.01 vs control group;#P<0.05,##P<0.01 vs ox-LDL group.图4 DPI抑制ox-LDL所诱导的巨噬细胞自噬
讨论
自噬是一种细胞将受损蛋白和细胞器以溶酶体依赖性降解方式再利用的过程,该过程以包绕胞浆成分的具有双层膜结构的小囊泡,即自噬体为主要特征,是维持细胞稳态、适应各种环境变化的重要机制。在饥饿、氧化应激、缺血等应激情况下,通过III型磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)/beclin-1途径的激活启动自噬,而该启动过程受哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的负性调控。大约30多个自噬相关基因(autophagy-associated gene,ATG)参与了自噬的启动及进展,其中ATG8,即LC3与磷脂酰乙醇胺(phosphatidyl-ethanolamine,PE)结合转变成LC3-Ⅱ并与ATG5-ATG12-ATG16L整合于自噬体膜中,在自噬体的形成中起关键作用;进而自噬体与溶酶体融合形成自噬溶酶体,在溶酶体水解酶的作用下将需要降解的物质分解为各种营养物质供机体再利用[2]。近年来研究表明,自噬参与AS时细胞死亡和存活的调控。在AS斑块中存在血管细胞自噬样特性:髓鞘样结构、细胞质中泛素化包涵体聚集以及空泡形成增多[8]。来自血管内皮和平滑肌细胞的研究表明,ox-LDL及其主要氧化成分7-酮胆甾醇(7-ketocholesterol,7-KC)均可诱导自噬[9-10],且在AS斑块中存在巨噬细胞自噬现象[3-4]。本实验结果显示,RAW264.7巨噬细胞经ox-LDL处理12 h后,beclin-1和LC3-II水平均显著上调,表明ox-LDL可诱导巨噬细胞自噬反应。
CD36是巨噬细胞表面主要识别、摄取ox-LDL 的B类清道夫受体,其结合和摄取的ox-LDL占巨噬细胞结合和摄取修饰脂质的50%以上,且不受细胞内胆固醇负反馈调节,造成大量脂质蓄积而导致泡沫细胞形成[11],然而抑制CD36表达则可减缓AS进展[12]。本课题组既往采用抗CD36单抗和基因沉默技术阻滞CD36功能,可显著抑制ox-LDL所诱导的巨噬细胞内脂质蓄积,并减轻内质网应激反应[5,13],表明CD36在ox-LDL所触发的巨噬细胞一系列生物学效应中具有重要作用。本实验结果显示,应用单克隆抗体阻断CD36所介导的ox-LDL摄入可显著减轻自噬反应,表现为beclin-1和LC3-II上调均受到明显抑制。
氧化应激被认为是AS发病的一个关键机制[14]。来自血管平滑肌细胞的研究表明,抗氧化剂N-乙酰半胱氨酸和夹竹桃麻素可减轻7-KC对LC3-II的上调作用[10],提示氧化应激可能介导自噬的发生。ox-LDL诱导的氧化应激主要来自NADPH氧化酶衍生的ROS的生成过度和抗氧化酶活性的降低[15]。本实验结果显示,巨噬细胞经ox-LDL处理后,NADPH氧化酶活性增加,SOD活性下降,ROS和脂质过氧化产物MDA生成显著增加。然而,与NADPH氧化酶抑制剂DPI相似,抗CD36单抗可拮抗上述变化,提示CD36介导的ox-LDL摄取可触发巨噬细胞氧化应激反应。为了进一步证明CD36介导的氧化应激在巨噬细胞自噬激活中的作用,本实验又探讨了DPI对ox-LDL所致自噬反应的影响。结果显示,DPI可显著抑制ox-LDL所诱导的beclin-1 和LC3-II上调。以上结果表明,CD36介导的ox-LDL摄取可触发氧化应激进而导致巨噬细胞自噬的发生。
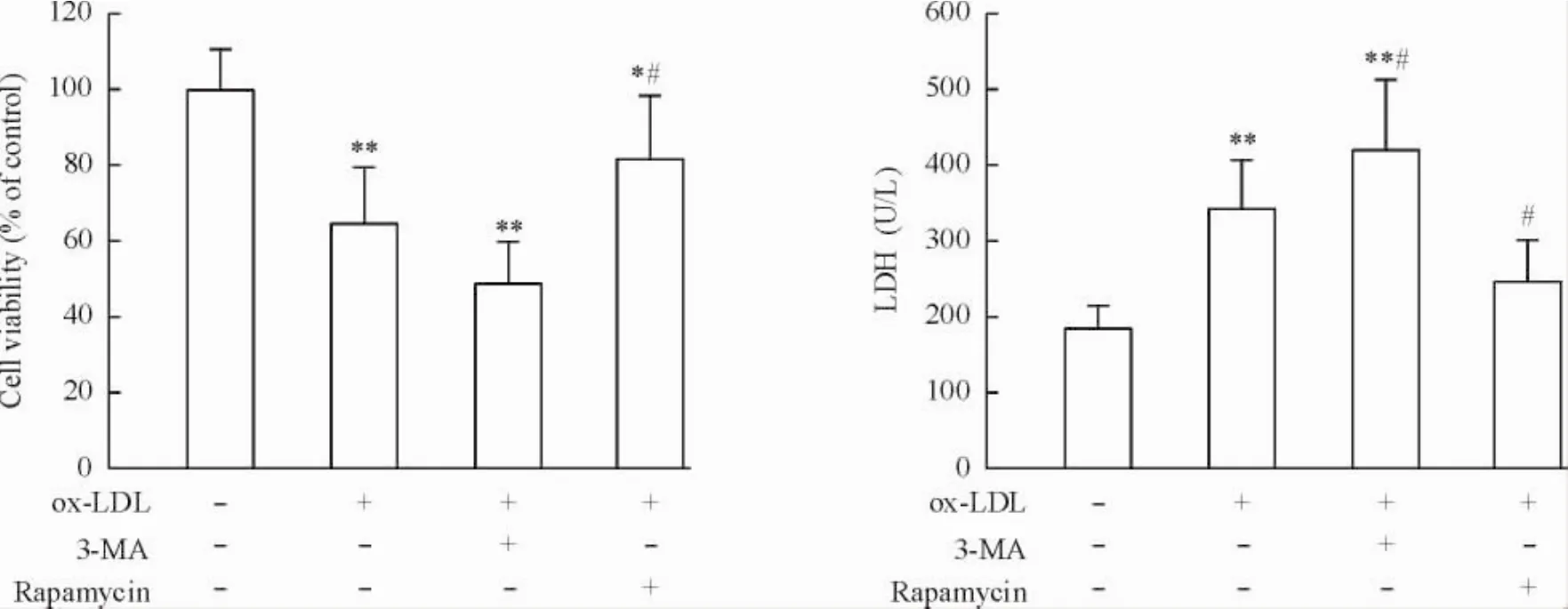
Figure 5.The cytotoxicity of ox-LDL on RAW264.7 macrophages was promoted by 3-MA and blocked by rapamycin.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05 vs ox-LDL group.图5 ox-LDL诱导细胞毒性的作用可被3-MA促进而被雷帕霉素拮抗
近年来研究提示,自噬作为一种自适应及保护性反应,可延缓或减轻AS进展。自噬反应的增强可减轻血管内皮和平滑肌细胞死亡,而自噬缺陷(ATG5-/-、ATG5 siRNA)或自噬抑制剂3-MA可加重ox-LDL、7-KC和游离胆固醇等因素诱导的血管内皮细胞和平滑肌细胞损伤[9-10]。在巨噬源性泡沫细胞中,脂滴通过自噬途径被运输至溶酶体,在溶酶体酸性酯酶的作用下,胆固醇酯被水解,产生游离胆固醇,然后通过ATP结合盒转运子A1 (ATP-binding cassette transporter A1,ABCA1)途径流出[16]。小鼠和兔AS模型证实,ATG5缺陷可增加AS斑块中巨噬细胞凋亡和氧化应激,促进斑块坏死,而自噬诱导剂雷帕霉素则降低AS病变中巨噬细胞和胆固醇的含量,增强斑块的稳定性[4,10,17]。本实验结果显示,3-MA促进了ox-LDL所诱导的细胞损伤,表现为细胞活力降低和LDH漏出进一步加重;而自噬诱导剂雷帕霉素则可拮抗ox-LDL所诱导的细胞损伤,使细胞活力增加和LDH漏出减少,表明自噬可减轻ox-LDL所诱导的巨噬细胞损伤。但是也有研究发现3-MA通过抑制III型PI3K活性抑制自噬而减轻香烟提取物所引起的血管内皮细胞死亡[18],mTOR激活剂3BDO可通过抑制自噬减轻ox-LDL所诱导的血管内皮细胞凋亡,稳定apoE-/-小鼠AS病变[19],提示自噬可加重香烟提取物和ox-LDL所诱导的血管内皮细胞死亡;另外通过自噬途径清除濒死的巨噬细胞可促进炎症激活和炎症因子的释放[20]。因此,自噬的激活是有益的还是有害的可能取决于疾病不同阶段细胞内底物负荷及细胞自噬降解的能力,其在AS发生发展中的作用及其调控机制还有待进一步阐明。
[参考文献]
[1]Williams HJ,Fisher EA,Greaves DR.Macrophage differentiation and function in atherosclerosis: opportunities for therapeutic intervention?[J].J Innate Immun,2012,4 (5-6) :498-508.
[2]Mei Y,Thompson MD,Cohen RA,et al.Autophagy and oxidative stress in cardiovascular diseases[J].Biochim Biophys Acta,2015,1852(2) :243-251.
[3]Verheye S,Martinet W,Kockx MM,et al.Selective clearance of macrophages in atherosclerotic plaques by autophagy[J].J Am Coll Cardiol,2007,49(6) : 706-715.
[4]Liao X,Sluimer JC,Wang Y,et al.Macrophage autophagy plays a protective role in advanced atherosclerosis[J].Cell Metab,2012,15(4) :545-553.
[5]姚树桐,桑慧,杨娜娜,等.氧化低密度脂蛋白诱导巨噬细胞内质网应激及CD36的可能作用[J].生理学报,2010,62 (5) :433-440.
[6]苗成,李金国,苗芳,等.槲皮素对ox-LDL所致的小鼠巨噬细胞脂质蓄积和过氧化的影响[J].中国病理生理杂志,2013,29(8) :1370-1374.
[7]赵莉,姚树桐,陈军,等.载脂蛋白A-I模拟肽D-4F对巨噬细胞源性泡沫细胞清道夫受体A1的抑制作用[J].中国病理生理杂志,2014,30 (10) : 1742-1747.
[8]Martinet W,De Meyer GR.Autophagy in atherosclerosis: a cell survival and death phenomenon with therapeutic potential[J].Circ Res,2009,104(3) : 304-317.
[9]张艳林,曹勇军,尤寿江,等.自噬对氧化低密度脂蛋白损伤内皮细胞的保护作用[J].中华医学杂志,2010,90(39) :2792-2796.
[10]He C,Zhu H,Zhang W,et al.7-Ketocholesterol induces autophagy in vascular smooth muscle cells through Nox4 and Atg4B[J].Am J Pathol,2013,183(2) : 626-637.
[11]Rahaman SO,Lennon DJ,Febbraio M,et al.A CD36-dependent signaling cascade is necessary for macrophage foam cell formation[J].Cell Metab,2006,4(3) : 211-221.
[12]Kuchibhotla S,Vanegas D,Kennedy DJ,et al.Absence of CD36 protects against atherosclerosis in ApoE knock-out mice with no additional protection provided by absence of scavenger receptor A I/II[J].Cardiovasc Res,2008,78 (1) :185-196.
[13]Yao S,Miao C,Tian H,et al.Endoplasmic reticulum stress promotes macrophage-derived foam cell formation by up-regulating cluster of differentiation 36 (CD36) expression[J].J Biol Chem,2014,289(7) :4032-4042.
[14]Li H,Horke S,Frstermann U.Vascular oxidative stress,nitric oxide and atherosclerosis[J].Atherosclerosis,2014,237(1) :208-219.
[15]Peluso I,Morabito G,Urban L,et al.Oxidative stress in atherosclerosis development: the central role of LDL and oxidative burst[J].Endocr Metab Immune Disord Drug Targets,2012,12(4) :351-360.
[16]Ouimet M,Franklin V,Mak E,et al.Autophagy regulates cholesterol efflux from macrophage foam cells via lysosomal acid lipase[J].Cell Metab,2011,13(6) : 655-667.
[17]Velikkakath AK,Nishimura T,Oita E,et al.Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets[J].Mol Biol Cell,2012,23(5) :896-909.
[18]Csordas A,Kreutmayer S,Ploner C,et al.Cigarette smoke extract induces prolonged endoplasmic reticulum stress and autophagic cell death in human umbilical vein endothelial cells[J].Cardiovasc Res,2011,92(1) :141-148.
[19]Peng N,Meng N,Wang S,et al.An activator of mTOR inhibits oxLDL-induced autophagy and apoptosis in vascular endothelial cells and restricts atherosclerosis in apolipoprotein E-/-mice[J].Sci Rep,2014,4: 5519.
[20]Petrovski G,Ayna G,Majai G,et al.Phagocytosis of cells dying through autophagy induces inflammasome activation and IL-1β release in human macrophages[J].Autophagy,2011,7(3) :321-330.
通讯作者△姚树桐Tel: 0538-6225010; E-mail: yst228@ 126.com;秦树存Tel: 0538-6237252; E-mail: shucunqin@ hotmail.com
*[基金项目]国家自然科学基金资助项目(No.81202949; No.81370381)
[收稿日期]2014-11-25
[文章编号]1000-4718(2015)06-1002-06
[中图分类号]R363.2; R332
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.007
