小鼠脊髓损伤后对少突胶质细胞前体细胞发育的影响
2015-03-20沈嘉希刘阿娟杨俊林
沈嘉希,刘阿娟,杨俊林
(杭州师范大学生命与环境科学学院,浙江 杭州310036)
脊髓损伤之后损伤区域周围活跃的星形胶质细胞将会形成胶质疤痕[1],很大程度上阻碍了脊髓损伤后神经元的修复[2],此外,损伤以后微环境将发生剧烈的变化,且各类免疫细胞会释放多种因子.本研究旨在探索这些微环境的变化对少突胶质细胞前体细胞(Oligodendrocyte progenitor cells,OPCs)发育的影响.PDGFRa是血小板源性生长因子受体家族的一员,在中枢神经系统中,PDGFRa只表达在未分化的OPCs中[3].体内试验表明,PDGFRa敲除的小鼠中OPCs的增殖受到明显抑制而分化提前[4].因此,PDGFRa被认为是比较好的OPCs的标记分子.
脊髓损伤目前还没有非常有效的治疗方案,现有主要的治疗方案包括干细胞移植[5]或诱导性多功能干细胞(induced pluripotent stem cells,IPSC)移植[6]、重编程损伤区域中的星形胶质细胞[7]等.移植后的OPCs主要分化形成星形胶质细胞,因此通过观察损伤区域微环境的变化对OPCs发育的影响,对移植OPCs/OLs(Oligodendrocyte cells,少突胶质细胞)治疗脊髓损伤具有参考价值.本研究利用PDGFRa-creER小鼠和Rosa-tdTomato小鼠品系在特定时间内来示踪损伤后OPCs细胞的去向:在脊髓损伤前5d予以腹腔注射药物Tomaxifen[8],诱导tdTomato 的表达,标记损伤前的PDGFRa阳性细胞在脊髓损伤后的转变.
1 材料和方法
1.1 小鼠及主要试剂
PDGFRa-creER+/-小鼠购买自Jackson lab.Rosa-tdTomato+/+小鼠由杭州师范大学发育与再生研究所刘阳老师实验室提供.PBS、庆大霉素购自美国Gicbco公司.山羊血清和蔗糖购自美国Invitrgen公司.包埋剂购自美国Thermo公司.0.1%Triton、氢氧化钠和Tris-HCl购自上海生工.戊巴比妥钠、多聚甲醛(PFA)和戊二醛购自美国Sigma公司.抗体为anticc1(Abcam,AB16794),antiPDGFRa(Abcam,AB61219),antiGFAP(Millipore,AB5804).
1.2 Tomaxifen诱导小鼠
得到PDGFRa-creER/Rosa-tdTomato小鼠后的第25天时,对小鼠注射40mg/mL 的Tomaxifen溶液(溶剂为95%的植物油和5%的无水乙醇)0.1mL,连续注射5d.
1.3 损伤小鼠脊髓
在小鼠腹腔注射戊巴比妥钠,待小鼠麻醉后,将脊髓T7~T10之间的表皮去毛,剪开背部皮肤,在手术显微镜下取出小鼠T8或T9区域脊髓背侧的骨头,在脊髓损伤仪下进行损伤.损伤后用手术线将伤口缝合,并在损伤处留下一小段手术线作为标记.最后在腹腔注射庆大霉素,降低术后感染.
1.4 处理小鼠脊髓
先将小鼠麻醉,剪开小鼠腹腔到胸腔处,露出心脏,将PBS用泵注入右心室,并把左心房剪个小口子,当肝脏颜色退去后,改注射4%的PFA.待小鼠全身肌肉僵硬后,取出损伤段脊髓置于冰上,在PBS中将脊髓取出,放入4%的PFA 中在4 ℃冰箱过夜固定.第二天用30%的蔗糖溶液替换PFA 溶液对脊髓进行脱水.在包埋材料前,将包埋剂在冰上预冷,锡箔纸折成正方形后放在干冰上并将包埋剂加入锡箔纸内,然后迅速把脊髓垂直底面放入包埋剂内,等包埋剂凝固后放入-80 ℃冰箱保存.包埋好的材料在冰冻切片机上切片(厚度为14μm),贴完材料的玻片放入片盒在-80 ℃冰箱保存.
1.5 免疫荧光
将脊髓组织切片放入PBS洗5min,重复3次.5%的山羊血清室温封闭30min,按稀释比例加入一抗,放入水盒在4 ℃过夜.第二天取出片子后继续用PBS洗5min,重复3次,加入荧光标记的二抗,室温孵育1h.最后用PBS洗3遍,每次5min,封片,在荧光显微镜和激光共聚焦显微镜下照相.
1.6 电镜
剖开小鼠胸腔后,用含有戊二醛的PB进行灌注,取出损伤区域,放在PB 中保存.在浙江大学农业与生物技术学院电镜公共平台进行后期处理,在锇酸中脱水,然后依次在由低到高不同浓度梯度的乙醇中脱水.包埋剂包埋后定位损伤部位,之后对材料超薄切片,电子显微镜下照相.
2 结 果
2.1 小鼠Tomaxifen作用下的诱导效率
为了探究PDGFRa阳性细胞在小鼠脊髓损伤后的变化,选用基因型为PDFGRa-creER/Rosa-tdTomato的小鼠作为研究对象,在两个不同的时期通过腹腔注射Tomaxifen诱导Cre的表达起到示踪的作用.选取小鼠出生后第15天(P15)和第30天(P30)两个时期作为参照.PDGFRa阳性细胞随着小鼠的发育逐渐减少(图1),PDGFRa和tomato的信号符合本研究要求(P<0.05).
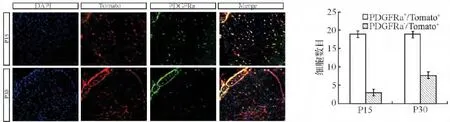
图1 Tomaxifen诱导下tdTomato可以正常表达Fig.1 The expression of the tomato under the action of Tomaxifen
2.2 小鼠脊髓损伤后损伤区域的修复
本研究选择在小鼠P30时期做损伤实验,因为这个时期小鼠脊髓中PDGFRa阳性细胞处于比较稳定的状态,并且细胞的分裂活性较高.用50Kdynes损伤小鼠脊髓T8或T9段后,小鼠会在一段时间后恢复部分行动能力,在该条件下能观察小鼠脊髓的自我修复.本研究在P30时期损伤后,继续饲养小鼠一个月后取材,电镜观察(图2)可见:在物理损伤情况下,大部分的髓鞘都已消失,很多神经元在损伤下死亡.以喂酮腙实验作为比较,28d连续喂饲小鼠酮腙后,取胼胝体在电镜下观察,药物并不能非常干净地脱髓鞘,会有少许的残留,而物理损伤的情况则比较严重.
脊髓损伤后会形成许多的胶质疤痕,对野生型的P30小鼠脊髓伤后30d取材,通过免疫荧光染GFAP抗体后确定损伤区域(图3).胶质疤痕主要由星形胶质细胞、成纤维细胞和小胶质细胞等组成,会阻碍神经元轴突的再生和髓鞘的修复[1].

图2 物理损伤和酮腙作用下脱髓鞘的情况Fig.2 The effect of physical injury and ketone hydrazone demyelinating

图3 物理损伤后形成的胶质疤痕Fig.3 The glial scar under the physical injury
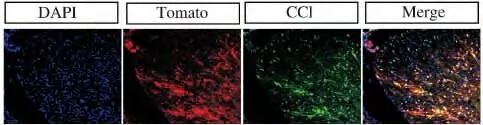
图4 大部分tdTomato阳性细胞表达CC1Fig.4 The tomato positive cells express CC1
2.3 PDGFRa阳性细胞在损伤后的表达
PDGFRa主要表达在OPCs以及更早期的胶质祖细胞等,本研究对PDFGRa-creER/Rosa-tdTomato小鼠在P25时期腹腔注射Tomaxifen,在P30时期进行脊髓损伤,并在损伤后休养30d恢复部分活动能力后取材.通过免疫荧光染少突胶质细胞标志蛋白CC1后发现,大多数tdTomato阳性的细胞表达CC1(图4).说明在损伤以后,大部分的PDGFRa阳性细胞分化成为少突胶质细胞,参与形成髓鞘.
此外,极少数tdTomato阳性的细胞不表达CC1(图5).笔者认为这些细胞可能是新形成的星形胶质细胞,因此做了针对GFAP免疫荧光.在激光共聚焦显微镜下发现有极少数tdTomato阳性细胞的确表达GFAP(图6),表明在脊髓损伤后,有极少部分PDGFRa阳性的细胞参与形成了星形胶质细胞.
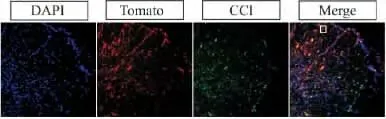
图5 CC1-/tdTomato+的细胞Fig.5 The CC1negative and the tdTomato positive cells
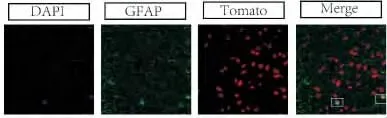
图6 GFAP+/tdTomato+的细胞Fig.6 The GFAP positive and tdTomato positive cells
3 讨论
本研究发现,在损伤后的一个月,PDGFRa阳性的OPCs及其子代细胞主要分化成为CC1阳性的少突胶质细胞,这表明,PDGFRa阳性的细胞在损伤后主要参与髓鞘的修复,但是仍然有少部分PDGFRa阳性的细胞在损伤后参与分化成为GFAP阳性的星形胶质细胞.小鼠脊髓损伤后体内微环境发生了极大的改变,在各类免疫细胞释放的因子作用下,影响了少数OPCs的正常成熟途径.在体外实验中,OPCs可以分化成为星形胶质细胞[9],但是在体内实验中,还未探索是否存在这条途径.
以往的研究[10]表明,使用软磷脂对小鼠脱髓鞘后,部分PDGFRa阳性细胞形成施旺细胞并分化成髓鞘,也有一些PDGFRa阳性的细胞表达GFAP信号.物理损伤或使用软磷脂脱髓鞘后,体内微环境发生改变,使少部分OPCs细胞的命运发生了改变.因此通过比较正常脊髓微环境和损伤后微环境的差别,可以寻找出影响OPCs发育的因素,这为今后提高干细胞移植或OPCs在治疗脊髓损伤时分化成为OLs的效率、抑制移植的细胞分化成为星形胶质细胞提供了应用基础.
[1]Stichel C C,Müller H W.The CNS lesion scar:new vistas on an old regeneration barrier[J].Cell Tissue Res,1998,294(1):1-9.
[2]Richardson P M,Issa V M K,Shemie S.Regeneration and retrograde degeneration of axons in the rat optic nerve[J].J Neurocytol,1982,11(6):949-966.
[3]Spassky N,Olivier C,Perez-Villegas E,etal.Single or multiple oligodendroglial lineages:a controversy[J].Glia,2000,29(2):143-148.
[4]Fruttiger M,Karlsson L,Hall A C,etal.Defective oligodendrocyte development and severe hypomyelination in PDGF-A knockout mice[J].Development,1999,126(3):457-467.
[5]Fehlings M G,Vawda R.Cellular treatments for spinal cord injury:the time is right for clinical trials[J].Neurotherapeutics,2011,8(4):704-720.
[6]Wang S,Bates J,Li X J,etal.Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination[J].Cell Stem Cell,2013,12(2):252-264.
[7]Piantino J,Burdick J A,Goldberg D,etal.An injectable,biodegradable hydrogel for trophic factor delivery enhances axonal rewiring and improves performance after spinal cord injury[J].Exp Neurol,2006,201(2):359-367.
[8]Feil S,Krauss J,Thunemann M,etal.Genetic inducible fate mapping in adult mice using tamoxifen-dependent cre recombinases[J].Methods Mol Biol,2014,1194:113-139.
[9]Dincman T A,Beare J E,Ohri S S,etal.Isolation of cortical mouse oligodendrocyte precursor cells[J].J Neurosci Methods,2012,209(1):219-226.
[10]Zawadzka M,Rivers L E,Fancy S P J,etal.CNS-resident glial progenitor/stem cells produce Schwann cells as well as oligodendrocytes during repair of CNS demyelination[J].Cell Stem Cell,2010,6(6):578-590.
