糖肾宁对糖尿病肾病大鼠肾组织nephrin、desmin表达的影响
2015-03-03邹大威高彦彬李娇阳周盛楠王馨瑶龚慕辛耿建国王金羊朱智耀张娜
邹大威 高彦彬 李娇阳 周盛楠 王馨瑶 龚慕辛 耿建国 王金羊 朱智耀 张娜
糖肾宁对糖尿病肾病大鼠肾组织nephrin、desmin表达的影响
邹大威高彦彬李娇阳周盛楠王馨瑶龚慕辛耿建国王金羊朱智耀张娜
【摘要】目的探讨糖肾宁对链脲佐菌素诱导的糖尿病大鼠肾小球足细胞损伤的影响。方法
8周龄SPF级雄性SD大鼠46只,随机选择10只为对照组,其余大鼠予大剂量STZ腹腔注射建立糖尿病模型。其中34只大鼠血糖≥16.7 mmol/L视为糖尿病模型建立成功,随机分为模型组、缬沙坦组、糖肾宁组,予糖肾宁及缬沙坦干预12周,测定空腹血糖、血清尿素氮、血清肌酐、24小时尿蛋白,足细胞裂孔隔膜蛋白nephrin、骨架蛋白desmin的蛋白或基因表达。结果与对照组比较,模型组大鼠空腹血糖、血清尿素氮、血清肌酐、24小时尿蛋白均明显升高(P<0.05),desmin蛋白、基因表达上调(P<0.05)、nephrin mRNA表达下调 (P<0.05);与模型组比较,糖肾宁、缬沙坦干预后, desmin蛋白、基因表达下调(P<0.05)、nephrin mRNA表达上调(P<0.05),血清尿素氮、血清肌酐、24小时尿蛋白显著降低(P<0.05),但血糖无明显变化 。结论糖肾宁干预链脲佐菌素诱导的糖尿病肾病大鼠可减少肾小球足细胞损伤,降低蛋白尿、保护肾功能。
【关键词】糖尿病肾病;足细胞损伤;糖肾宁
最新的研究表明中国成年人群的糖尿病总体发病率约为11.6%,糖尿病前期的发病率是50.1%,估计中国约有1.139亿糖尿病患者, 4.934亿糖尿病前期患者[1],糖尿病肾病( diabetic nephropathy , DN) 是糖尿病的严重并发症, 是导致终末期肾衰竭和糖尿病患者死亡的主要原因,因此,防治糖尿病肾病具有重要意义。既往研究认为, DN 的主要病理特征是肾小球细胞外基质堆积、系膜增宽、基底膜增厚, 肾小球硬化及肾间质纤维化[2]。近年来,肾小球滤过屏障结构和功能的改变, 尤其是作为肾小球滤过屏障结构成分的足细胞在DN发生、发展中的作用,日益成为研究热点[3-4]。研究表明足细胞损伤是DN持续进展、蛋白尿持续增加的关键因素[5],因此积极寻找减轻足细胞损伤,控制DN病情进展的中药迫在眉睫。糖肾宁复方临床应用治疗糖尿病肾病多年,效果显著,临床试验研究也表明该药可明显降低DN患者尿蛋白,改善肾功能,疗效优于洛汀新[6]。笔者旨在通过本实验探讨糖肾宁减少蛋白尿、保护肾功能的作用机制,是否部分与减轻肾小球足细胞损伤相关。
1材料与方法
1.1动物
8周龄SPF级雄性SD大鼠46只[生产许可号:SCXK(京)2012-0001],购自北京维通利华实验动物技术有限公司。
1.2干预药物与试剂
干预药物:糖肾宁(配比:黄芪4份、葛根2份,川芎2份,大黄1份,金樱子2份、倒扣草3份,由首都医科大学中医药学院中药制剂室制备成浸膏粉);缬沙坦胶囊(北京诺华制药有限公司,80 mg x7粒,批号:X1448)。
试剂:Trizol试剂盒(批号:30B00150,NEP019-2,北京鼎国昌盛生物技术有限责任公司),M-MLV反转录试剂盒(批号:TRT-101,TOYOBO,日本),链脲佐菌素(Streptozotocin, STZ)(Sigma,美国),尿蛋白定量检测试剂盒(批号:20130820,C035-2,南京建成,中国),desmin抗体(ab32362,Abcam,英国),山羊抗兔二抗(即用型sp-9001,中杉金桥,中国),肌酐测定试剂盒(批号:657881,ROCHE, 瑞士),尿素氮测定试剂盒(批号:658513,ROCHE,瑞士)。
1.3仪器
实时荧光定量PCR仪(PRISM 7700,ABI,美国),凝胶成像分析仪(WD-9413,北京市六一仪器厂,中国),紫外分光光度仪(Q-5000 ,Quwell,美国),模块化生化免疫分析系统(Cobas 6000 C501, Roche),生物显微镜(ECLIPSE 80i,Nikon,日本)。
1.4实验方案
本实验采用大剂量STZ(60 mg/kg)诱导8周龄雄性SD大鼠建立糖尿病模型,空腹血糖≥16.7 mmol/L 认为糖尿病模型建立成功。造模成功的43只糖尿病大鼠随机分为模型组M(n=12)、糖肾宁组TSN(n=11)、 缬沙坦组XST(n=11),另设10只非糖尿病大鼠为对照组(NC)。糖尿病模型成功后立即干预给药,XST组予缬沙坦10 mg/kg·d灌胃,TSN组予糖肾宁(生药20 g/kg·d,按浸膏粉/生药比换算配制药物)灌胃,NC组及M组均予等体积蒸馏水灌胃,连续给药12周。实验期间,于给药0点、给药1个月、给药2个月、给药3个月,称量体质量,采用尾静脉取血法动态监测各组大鼠血糖,代谢笼收集24小时尿液,考马斯亮蓝法测定24小时尿蛋白含量。
1.5指标收集与检测
给药3个月末,大鼠禁食12小时于次日清晨处理大鼠。根据大鼠体质量,用10%水合氯醛麻醉大鼠(300 mg/kg),暴露腹腔,进行腹主动脉取血,分离血清4℃保存。采用苦味酸法测定血清肌酐,采用尿酶紫外速率法测定血清尿素氮。取肾脏纵切,部分10%多聚甲醛固定、石腊包埋,切成4μm厚的切片,进行HE染色及desmin免疫组化染色。部分用预冷的生理盐水洗去血渍和杂质,取肾皮质迅速放入液氮中保存,待测desmin及nephrin基因表达水平。
1.6肾组织nephrin、desmin mRNA检测
从GeneBank获得目的基因mRNA的全长序列,利用引物和探针设计软件Primer 5.0设计引物序列。经过Blast分析,引物序列具有特异性。(见表1)。取大鼠肾组织80 mg,采用Trizol提取RNA,并用DNase纯化RNA。以总RNA为模板,使用TOYOBO反转录试剂盒进行cDNA的合成,在实时荧光定量PCR仪上扩增并检测荧光,每个样本均做3次,取平均值减少误差,采用双标准曲线法[7]对desmin、nephrin mRNA的表达水平进行相对定量分析。
1.7肾组织免疫组织化学测定
将4%的多聚甲醛固定的肾组织石蜡包埋,制成石蜡切片,厚度 4 μm,0.01M PBS在微波炉内进行抗原修复,滴入5%H2O2微波炉内4~5分钟灭活内源性酶,0.01M PBS漂洗3次。加入1:50浓度的desmin一抗,37℃ 90分钟,0.01M PBS漂洗3次,滴入适当二抗,37℃ 25分钟,PBS漂洗3次各5分钟, DAB染色,镜下控制反应时间,苏木素轻度复染,脱水,透明,封片,光学显微镜观察。
1.8计算机图像半定量分析
每组随机选取3张肾组织切片,使用尼康ECLIPSE 80i 生物显微镜在400倍视野下采集图像,每张切片随机选择5个肾小球。用NIS-Elements BR 3.2图像分析软件计算肾小球desmin阳性面积,计算每个肾小球内desmin的阳性信号面积比。公式:desmin阳性信号面积比=desmin阳性染色面积(μm2)/肾小球面积(μm2)。
1.9统计方法
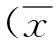
2结果
2.1各组大鼠一般情况及体重、血糖的比较
实验过程中,对照组大鼠无死亡,给药1个月时间点模型组、缬沙坦组各死亡1只、给药3个月时间点模型组、糖肾宁组各死亡1只。STZ腹腔注射后大鼠血糖明显升高(P<0.05),给药0周各组大鼠体重无明显差异(P>0.05);与对照组相比,给药1、2、3个月的模型组大鼠的血糖升高且稳定、体重明显较少(P<0.05),;与模型组相比,给药1、2、3个月的缬沙坦组、糖肾宁组大鼠的体质量、血糖无明显差异(P>0.05)。各给药组大鼠体质量、血糖无明显差异(P>0.05)。见表2、表3。

表1 Neprhin、Desmin基因引物序列
注:F 上游引物;R 下游引物


组别血糖(mmol/L)给药0月1月2月3月对照组 5.79±0.3355.85±0.3445.61±0.495.64±0.60模型组 30.40±1.448a31.09±1.52a31.38±1.68a31.33±1.94a缬沙坦组30.34±1.22a30.57±1.68a31.26±1.66a31.63±1.46a糖肾宁组30.85±1.46a31.18±1.18a31.05±1.66a31.17±2.43a
注:与对照组比较,aP<0.05


组别体质量(g)给药0月1月2月3月对照组 233.3±15.59508.66±57.85563.72±52.28556.18±63.09模型组 233.44±11.73a317.02±62.54a327.59±59.29a287.04±63.45a缬沙坦组232.79±11.49a329.01±59.68a343.68±69.81a305.80±58.86a糖肾宁组234.59±12.45a339.45±57.94a331.48±58.91a311.60±73.31a
注:与对照组比较,aP<0.05

±s,n=9~10)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05; 对照组10只,余组9~10只

±s,n=8)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
2.2各组大鼠24小时尿蛋白排泄比较
与对照组相比,给药1、2、3个月的模型组大鼠的尿蛋白含量明显升高(P<0.05),提示DN模型建立成功。与模型组相比,给药1、2、3个月的缬沙坦组、糖肾宁组大鼠的24小时尿蛋白均有不同程度的降低(P<0.05),各干预组组间比较无显著差异(P>0.05)。实验结果表明糖肾宁具有明显的降低糖尿病大鼠尿蛋白的作用。见表4。
2.3各组大鼠血清肌酐、血清尿素氮比较
与对照组相比,给药3个月的模型组大鼠的血清肌酐、血清尿素氮含量明显升高(P<0.05)。与模型组相比,缬沙坦、糖肾宁干预3个月后,血清肌酐、血清尿素氮均有不同程度的降低(P<0.05),各干预组组间比较无显著差异(P> 0.05)。实验结果表明糖肾宁具有保护肾功能的作用。见表5。
2.4糖肾宁对足细胞desmin、nephrin基因表达的影响
采用实时荧光定量PCR方法检测各组nephrin、desmin mRNA表达,结果表明,与对照组相比,模型组大鼠肾组织nephrin mRNA表达明显降低(P<0.05),desmin mRNA明显升高(P<0.05) ;与模型组相比,糖肾宁、缬沙坦干预3个月后大鼠肾组织nephrin mRNA表达明显升高(P<0.05),desmin mRNA明显降低(P<0.05)(P<0.05),各干预组组间比较无显著差异(P>0.05)。见图1。
2.5免疫组化法检测各组肾组织desmin的表达
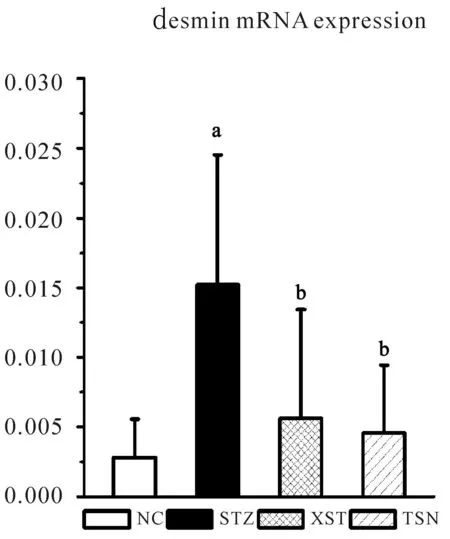
如图所示,光镜下棕褐色为阳性染色。对照组的desmin蛋白表达较少,模型组的desmin蛋白主要表达在足细胞中,可见大量表达(见图2),大鼠肾小球desmin阳性面积比明显增高(P<0.05),缬沙坦及糖肾宁组大鼠阳性染色减弱,与模型组相比有差异(P<0.05)。(见图2,表6)

NC:对照组 STZ:模型组 XST:缬沙坦组 TSN:糖肾宁组注: 与对照组比较,aP<0.05; 与模型组比较,bP<0.05图1 给药12周末各组大鼠肾组织nephrin、desmin基因表达量的比较

NC STZ
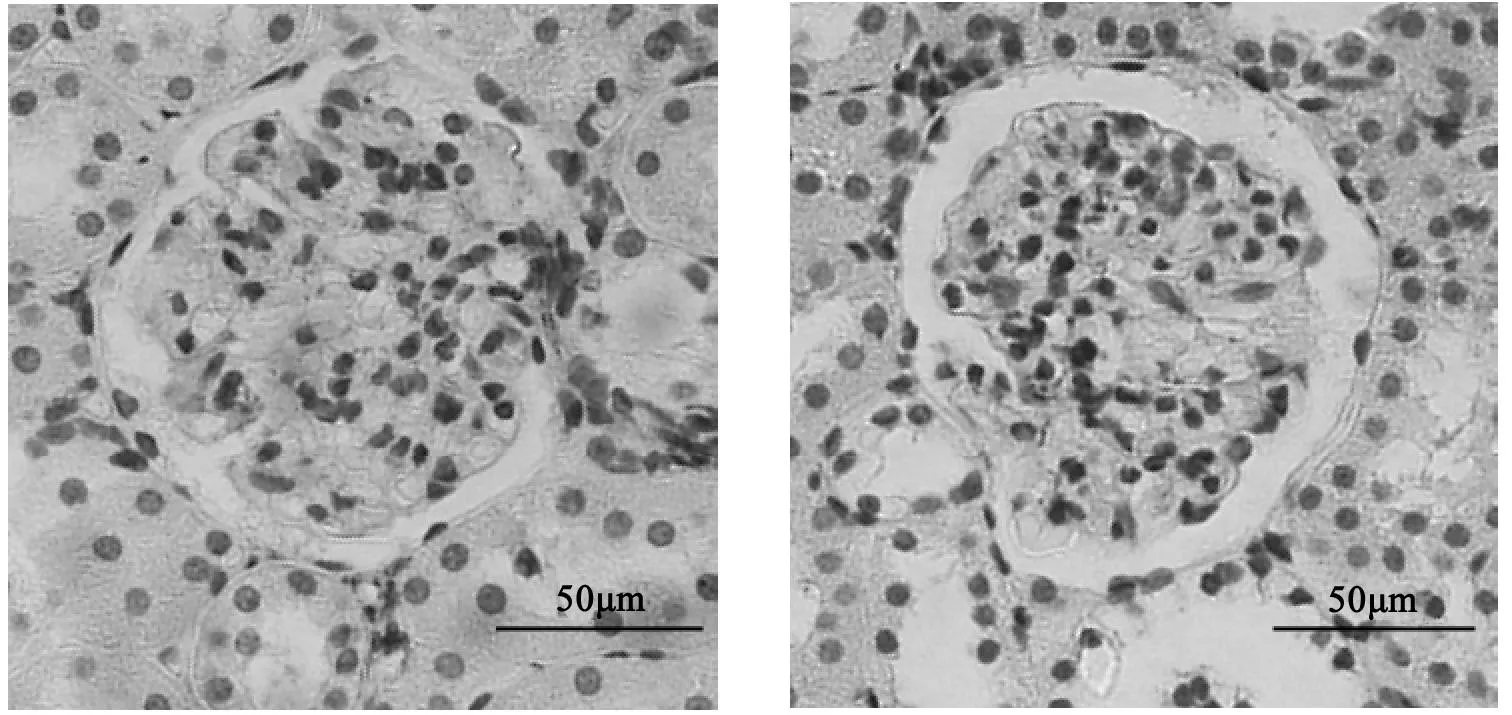
XST TSN NC:对照组 STZ:模型组 XST:缬沙坦组 TSN:糖肾宁组图2 给药12周末各组大鼠肾组织免疫组化desmin的表达(×400)


组别desmin阳性面积比对照组 0.09±0.02模型组 0.81±0.10a缬沙坦组 0.45±0.13ab糖肾宁组 0.48±0.11ab
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
3讨论
本实验采用中药糖肾宁防治糖尿病肾病,该药在临床应用及临床试验研究中均获得较好疗效。高彦彬教授认为糖尿病肾病是消渴病日久,久病入络所引起的尿浊、水肿、腰疼、关格等肾系并发症,病位在肾,继发于消渴病,因此称为消渴病肾病。DN的基本病机是肾元亏虚、肾气不固、肾络瘀阻、浊毒内停。针对其病机特点,络病理论结合多年临床经验,高彦彬教授研制出中药复方糖肾宁,其中黄芪益气固表,利水消肿,金樱子固肾摄精,丹参活血化瘀,大黄泻热通腑,逐瘀降浊,全方共奏益气固肾、化瘀通络降浊之效。
本实验采用大剂量STZ腹腔注射SD大鼠建立模型,该方法具有成模率较高、简单易行的特点,实验过程中,动态检测血糖,血糖基本处于>25 mmol/L的高值,表明糖尿病动物模型稳定成功。糖肾宁对血糖没有明显的影响,表明中药糖肾宁发挥的减轻DN足细胞损伤的作用与降低血糖无关。STZ注射4周后测定模型组24 h尿蛋白含量可达到45 mg/24h左右,明显高于对照组,说明DN模型成功建立,这与文献报道是一致的[8]。缬沙坦是血管紧张素受体1拮抗剂的代表药物,因其具有公认的降低尿蛋白的作用,常作为阳性对照药物[9],在本实验中糖肾宁能够稳定的降低尿蛋白、改善肾功能,与缬沙坦的作用不相上下(P>0.05)。
肾小球滤过屏障由肾小球基底膜(glomerular basement membrance, GBM)、足细胞、内皮细胞共同构成。肾小球足细胞是滤过屏障的最外一层防线,其主要特征是自细胞体伸出很多指状突起并且相邻的突起末端之间形成裂孔隔膜,对于阻遏蛋白漏出起关键作用。足细胞损伤主要表现为足细胞裂孔隔膜蛋白表达下调、足细胞骨架蛋白表达异常。肾病蛋白nephrin是构成裂孔隔膜的主要蛋白,结蛋白desmin是构成足细胞骨架的中间丝蛋白。本实验旨在通过探讨糖肾宁对desmin、nephrin的调控作用,分析该药对DN足细胞损伤的影响。
足细胞裂孔隔膜由nephrin、Podocin、CD2AP等多种蛋白质组成,这些分子被称为“足细胞相关分子”,它们有序组合,在足突间构成拉链样结构,对蛋白质等大分子物质形成选择性滤过屏障。DN时,足细胞裂孔隔膜蛋白表达的改变,将导致肾小球滤过屏障结构和功能的异常,从而促使尿蛋白形成和/或肾小球硬化。nephrin是最早被发现的一种裂孔隔膜蛋白,是维持足细胞结构的关键裂孔隔膜分子,相对分子质量为135×103,特异性表达在裂孔隔膜上,是裂孔隔膜蛋白复合体的主要成分[10]。nephrin mRNA及蛋白表达的降低早于其超微结构的改变和蛋白尿的出现,是肾小球足细胞损伤的早期标志物[11]。1998年Kestila[12]等从先天性芬兰型肾病综合征(Congenital nephrotic syndrome of the Finnish type, NPHS1)患者中成功克隆出肾病综合征l(NPHS1)基因, 采用Northern blot 及 situ hybridization 证实NPHS1表达在肾小球,并证实该基因编码的产物nephrin蛋白在肾小球滤过屏障功能中起着关键作用[13]。本实验发现,与对照组相比,模型组肾小球nephrin mRNA表达减少,糖肾宁具有减弱DM相关的nephrin mRNA表达减少的作用。缬沙坦也体现了降低nephrin mRNA表达的作用(P>0.05)[14]。
足细胞足突是以actin细胞骨架为基础的可收缩性结构,其可动态调节足细胞的形态和位置,从而调控肾小球滤过功能。细胞骨架主要由微丝蛋白、中间丝蛋白、微管蛋白组成,结蛋白 desmin 属于细胞骨架的中间丝蛋白。裂孔隔膜分子之间通常形成蛋白复合体发挥作用,且通过接头蛋白与细胞骨架结构相连结,裂孔隔膜分子受损时,往往可导致足细胞骨架重构[15]。正常情况下肾小球系膜细胞可少量表达desmin,而足细胞无明显表达,当足细胞损伤时,细胞骨架重新排列,可大量表达desmin发生表型转化,因此desmin可作为足细胞损伤的标志[16-17]。本实验发现,与对照组相比,模型组肾小球desmin蛋白表达明显增加,在中药糖肾宁干预后,DN大鼠肾小球足细胞desmin蛋白表达明显减少,提示足细胞的损伤减轻,与光镜观察结果是一致的。在本实验中缬沙坦可升高糖尿病模型大鼠肾组织nephrin表达,降低结蛋白desmin表达,具有抑制足细胞表型转换的作用,与其他实验研究亦具有一致性[18]。
综上所述,初步证实糖肾宁可通过上调糖尿病大鼠降低的足细胞裂孔隔膜蛋白nephrin,下调异常升高的足细胞骨架蛋白desmin,减轻肾小球足细胞损伤,降低尿蛋白,保护肾功能。因白蛋白过负荷可引起足细胞损伤并导致足细胞骨架重构,而裂孔隔膜蛋白因与足细胞骨架蛋白相连接,因此裂孔隔膜蛋白nephrin损伤亦可导致足细胞骨架重构。因此糖肾宁是通过降低蛋白尿、减轻足细胞骨架重构,还是调控裂孔隔膜蛋白nephrin减轻足细胞骨架重构,或是对结蛋白desmin有直接调控作用,这都需要后续进行深入的机制研究。
参考文献
[1]Y Xu, L Wang, J He et al. Prevalence and Control of Diabetes in Chinese Adults [J]. JAMA,2013,310(9):948-958.
[2]Lea J, Pnicholas SB. Diabetes mellitus and hypertension: Key risk factors for kidney disease[J].J Natl Med Assoc,2008, 94(Suppl 8):7-15.
[3]Dalla VestraM, MasieroA, RoiterAM, et al.Is podocyte injury relevant in diabetic nephro-pathy? Studies in patients with type 2 diabetes[J].Diabetes, 2003,52(4):1031-1035.
[4]杨倩,梁伟,丁国华.足细胞损伤与糖尿病肾病[J].中国医学前沿杂志,2012, 4(9):10-13.
[5]Ziyadeh F N,Wolf G. Pathogenesis of the podocytopathy and proteinuria in diabetic glo-merulopathy[J].Curr Diabetes Rec,2008,4(1):39-45.
[6]高彦彬,赵慧玲,周晖,等.糖肾宁治疗气阴两虚、络脉瘀滞型早期糖尿病肾病临床研究[J].中华中医药杂志,2006,21(7):409-411.
[7]徐丽华,刘春雷,常玉梅,等.双标准曲线相对定量PCR试验原理与方法[J].生物技术通报,2011,(1):70-75.
[8]杨亦彬, 张翥, 苏克亮, 等. 链脲佐菌素诱导大鼠糖尿病肾病模型的方法学探讨[J]. 华西医学, 2005, (2): 299-300.
[9]刘晓, 高媛媛, 鲁茜,等. 银杏叶提取物、卡托普利和缬沙坦对大鼠糖尿病肾病保护作用的比较[J]. 中药材, 2008,(1): 97-100.
[10]李秋月,李六生,李桂霞,等.坎地沙坦对糖尿病肾病大鼠足细胞Nephrin、Podocin和CD2AP表达的影响[J].华中科技大学学报(医学版),2012,41(3):310-313.
[11]黄平,王雁秋.绞股蓝总皂苷对糖尿病肾病大鼠足细胞损伤的影响及机制[J].中华中医药杂志,2012,27(3):723-726.
[12]M. Kestila, U. Lenkkeri and M. Mannikko, et al., Positionally cloned gene for a novel glomerular protein—nephrin—is mutated in congenital nephrotic syndrome [J]. Molecular Cell,1998, 1(4): 575-582.
[13]石绮屏. Nephrin基因表达的改变与糖尿病肾病[J]. 国外医学(内分泌学分册),2004, (1): 5-27.
[14]F. Bonnet, M.E. Cooper, H. Kawachi, et al., Irbesartan normalises the deficiency in glomerular nephrin expression in a model of diabetes and hypertension[J]. Diabetologia, 2001,44(7): 874-877.
[15]孙桂芝,孙艳艳,方敬爱.糖尿病肾病足细胞损伤的研究进展[J].中国中西医结合肾病杂志,2008,9(2):177-178.
[16]LIY, KANG Y S, DAIC, etal. Epithelial-to-mesenchymal transition is a potential pathway leading to podocyte dysfunction and proteinuria[J].Am J Pathol,2008,172(2):299-308.
[17]ZhangC,HuJJ,XiaM,et al. Protection of Podocytes from hy Perhomocysteinemia-induced injury by deletion of the gP91Phox gene[J].Free Radic Biol Med,2010,48:1109-1117.
[18]H.Y. Dai, M. Zheng, R.N. Tang, et al. Effects of angiotensin receptor blocker on phenotypic alterations of podocytes in early diabetic nephropathy[J].American Journal of the Medical Sciences,2011,341(3):207-214.
(本文编辑:蒲晓田)
·论著·
作者单位:110847 沈阳,辽宁中医药大学护理学院(王丽);大连市第二人民医院消化科(李翌萌)
Effects ofTangshenningon nephrin, desmin expression of renal tissue in STZ-Induced diabetic ratsZOUDa-wei,GAOYan-bin,LiJiao-yang,etal.SchoolofTraditionalChineseMedicine,CapitalMedicalUniversity,Beijing100069,China
【Abstract】ObjectiveObjective To investigate the effects of Tangshenning on podocyte injury of renal tissue in streptozotocin (STZ) induced diabetic rats. Methods: Non-diabetic rats (n=10) were designed as the control group, other rats were given STZ to induce diabetic model. The diabetic rats (fasting blood glucose≥16.7mmol /L)were randomly divided into three groups: the model group(n=12), the Tangshenning group (n=11) and the Valsartan group(n=11), After intervention with Tangshenning and valsartan for 12 weeks, 24h Urinary protein excretion (24h UPro), fasting blood glucose (FBG), serum creatinine (Scr), serum urea nitrogen(BUN) were examined. The protein and mRNA expression of podocyte slit diaphragm protein nephrin and cytoskeletal protein desmin mRNA expression were accessed. Results FBG, BUN, SCr, 24h UPro as well as desmin protein and mRNA expression of renal tissue in model group were increased significantly(P<0.05), nephrin mRNA expression of renal tissue in model group were decreased significantly (P<0.05) compared with non-diabetic rats group. Obviously, after Tangshenning or Valsartan intervention, 24h UPro, BUN and SCr were significantly declined(P<0.05), while no significant change of FBG after intervention (P>0.05).Tangshenning or valsartan could also decrease desmin expression and increase nephrin expression compared with model group. Conclusion Tangshenning could alleviate podocyte injury of renal tissue in STZ-induced diabetic rats, as well as reducing proteinuria and protecting renal function.
【Key words】Diabetic nephropathy;Tangshenning;Podocyte injury
作者简介:王丽(1978- ),女,博士,讲师。研究方向:中医消化病基础及临床研究。E-mail :wltcm@126.com
(收稿日期:2014-08-07)
Corresponding author:GAO Yan-bin,E-mail:dfyynfm@163.com
【中图分类号】R285.5
【文献标识码】A
doi:10.3969/j.issn.1674-1749.2015.03.011
