葛花枳椇子配伍对酒精性肝损伤大鼠血中乙醇浓度和肝中乙醇脱氢酶活性的量—时—效影响
2015-04-21刘明陈绍红钟赣生柳海艳赵桐
刘明 陈绍红 钟赣生 柳海艳 赵桐
酒精性肝病(alcoholic liver disease,ALD)是因长期大量摄入酒精而造成的肝脏损伤疾病。随着酒精摄入量的增加,该疾病呈渐进性发展,可从最初的酒精性脂肪肝发展为酒精性肝炎、酒精性肝纤维化及酒精性肝硬化[1]。随着生活水平的提高和饮食结构的变化,人们社交应酬增多以及生存竞争压力增大,酗酒和酒精中毒呈日益增多趋势。在欧美发达国家,酒精性肝病的发病形式主要以酒精性脂肪肝为主;在中国,酒精性疾病的发生率也与日俱增,主要以酒精性肝炎为主[2]。乙醇及其代谢产物和代谢过程中产生的代谢混乱是导致酒精性肝病的重要原因[3]。在古代文献记载中,葛花枳椇子是最具有代表性的解酒药对,葛花功用为解酒醒脾,枳椇子具有清热利尿,解酒毒的功效,二者也较少用于其他疾病的治疗。实验组前期通过借助现代科学技术方法与手段,进行了葛花和枳椇子不同比例配伍(1∶1、1∶2、和2∶1),不同的提取方法(水提和醇提)对大鼠慢性酒精性肝损伤的防治研究,结果表明葛花枳椇子2∶1比例配伍采用传统水提解酒保肝效果最佳[4]。本实验在此基础上,通过研究酒后血中乙醇质量浓度和肝中乙醇脱氢酶活性,探讨不同剂量的葛花枳椇子2∶1比例配伍后解酒保肝是否存在量-时-效关系。
1 材料与方法
1.1 实验动物与分组
选取健康雄性Wistar 大鼠,体质量180 ~200 g,由北京维通利华实验动物技术有限公司提供。许可证编号为SCXK(京)2012-0001。适应性喂养一周后,按体重随机分为6 组:空白组、模型组、东宝甘泰组、配伍低剂量组、配伍中剂量组、配伍高剂量组,其中空白组30 只,模型组、东宝甘泰组、配伍各剂量组每组各50 只。
1.2 实验药物与试剂
1.2.1 实验药物 葛花为豆科植物野葛Pueraria lobata (Willd.)Ohwi 的花。枳椇子为鼠李科植物枳椇Hovenia dulcis Thunb 的干燥成熟种子。两种药材均购自北京本草方源药业有限公司,经北京中医药大学基础医学院中医方药系李伟老师鉴定均为优质药材。
葛花枳椇子混合煎液的制备:将葛花、枳椇子按2∶1的比例混合浸泡0.5 小时,第一次加10 倍量水煎煮提取1.5 小时,第二次加8 倍量水煎煮1 小时。滤过,合并滤液,浓缩至一定浓度。使用时,加去离子水配制成含生药12 g/mL、6 g/mL、3 g/mL 浓度的药液。
东宝肝泰药液的制备:使用时用去离子水配成0.036 g/mL 浓度的药液。
1.2.2 主要实验试剂 56°红星二锅头酒:购自北京红星股份有限公司;东宝甘泰片:吉林通化东宝药业股份有限公司生产,批号为:090503;生理盐水:山东齐都药业有限公司;组织乙醇脱氢酶(alcohol dehydrogenase,ADH)测定试剂盒:南京建成科技有限公司生产,批号为:20130412;无水乙醇:北京化工厂生产,批号为:20130320;肝素钠:优级纯。中国医药公司北京公司;盐酸氨基脲:国药集团化学试剂有限公司,批号为:20111215;甘氨酸:北京东胜泰博科技有限公司;焦磷酸钠:国药集团化学试剂有限公司,批号为:F20110503;氢氧化钠:北京化工厂生产,批号为:20121120;高氯酸:北京化工厂生产;乙醇脱氢酶:SIGMA 公司进口;氧化型辅酶Ⅰ:SIGMA公司进口
1.3 主要实验仪器
台式高速冷冻离心机:型号为TGL-16A,长沙平凡仪器仪表有限公司;恒温水浴锅:北京光明医疗仪器厂;快速混匀器:型号为SK-1,江苏国华仪器厂;微量移液器:北京青云航空仪表有限公司;752-C 紫外光栅分光光度计:上海第三分析仪器厂;电子分析天平:型号为AEL-160,日本产。
1.4 造模与给药方法
大鼠适应性喂养一周后开始造模,用56°红星二锅头白酒灌胃,第1 周每天给酒8 mL/kg,1 次灌胃,连续2 周;第3 周每天给酒10 mL/kg,以后每周称重,根据体重计算给酒量,连续12 周。除正常喂养外,空白组每天给予去离子水,灌胃体积为10 mL/kg,模型组给予56°红星二锅头白酒灌胃,配伍各剂量组每日上午先给予相应浓度的药液,给药体积为10 mL/kg,下午给予白酒灌胃。连续12 周,每周给大鼠称重,自由进食进水。
1.5 对慢性酒精性肝损伤大鼠血中乙醇浓度的影响
1.5.1 制作标准曲线 (1)用生理盐水将新鲜正常大鼠全血(经抗凝处理)稀释,配成含乙醇量分别为25 mg/dL、50 mg/dL、100 mg/dL、200 mg/dL、400 mg/dL、800 mg/dL 的溶液。(2)上述各管加入3.4%高氯酸4 mL,混匀,于3000 r/min 离心5分钟,取上清液作为标准液。(3)取6 只试管,分别加入乙醇脱氢酶(ADH)-氧化型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD +)液4.9 mL;其中一支加蒸馏水0.1 mL,作为对照;其余五支各加0.1mL 标准液,室温放置60 分钟。用752-C 紫外可见分光光度计于340 nm 测各管吸收度,绘制标准曲线。回归方程为y =1806x +3.6398,R2=0.9976
1.5.2 样品测试 大鼠280 只,按体重随机分为6组:空白组、酒精组、东宝甘泰组、配伍低剂量(生药3 g/kg)+酒精组、配伍中剂量(生药6 g/kg)+酒精组、配伍高剂量(生药12 g/kg)+酒精组。空白组30 只,其余各组各50 只。实验分别在4 周末、8 周末、12 周末取材,取材前所有大鼠均禁食不禁水12小时,用10%水合氯醛350 mg/kg 腹腔注射麻醉,腹主动脉取血,取少量新鲜血液,经抗凝处理。在取血同时另取肝左叶约0.2 g,立即放入液氮中冷冻,之后置于-70℃冰箱中冷藏,备测乙醇脱氢酶活性(ADH)。
从每管抗凝血中取出0.25 mL,加生理盐水0.75 mL,再经去蛋白处理,余步骤与制作标准曲线相同。根据吸光度,用标准曲线求出乙醇质量浓度。
1.6 乙醇脱氢酶检测
测试时用手动匀浆器将肝组织在冰水中制成10%匀浆,4℃3000 转/分钟离心10 分钟,提取上清液,备检测。将测定ADH 试剂盒内的试剂混匀,37℃预温10 分钟,加入待测液0.05 mL,加入样本的同时开始计时,充分混匀,15 秒时340 nm 处,0.5 cm光径,测定OD 值A1,迅速将反应液置于37℃水浴锅中,10分钟15 秒时取出,测定OD 值A2。
计算公式为:肝组织匀浆中的ADH 活力(U/mgprot)=[测定(A2-A1)-空白(A2-A1)]÷ (6.22 ×0.5)×[反应液总体积(mL)÷样本量(mL)]÷反应时间×1000÷10%组织匀浆蛋白含量(mgprot/mL)
1.7 统计学方法
采用SPSS 11.5 统计软件进行统计学处理。各项检测指标的数据均采用均值±标准差(±s)来表示,方差齐性检验采用Levene 检验,多组均数间的比较采用单因素方差分析(One-way ANOVA),两两均数间比较采用LSD 法,P <0.05 提示差异有统计学意义。为保证检测指标的客观真实性,统计数据时剔除不符合正态分布原则的界外值。
2 结果
2.1 葛花枳椇子2∶1配伍对酒精性肝损伤大鼠血中乙醇质量浓度的影响
与模型组比较,给药4 周后,各给药组大鼠血中乙醇浓度均有所降低,但无统计学差异(P>0.05)。给药8 周后,各给药组大鼠血中乙醇浓度均明显降低,有显著性差异,且配伍低剂量组血中乙醇浓度最低,与中剂量组相比(P <0.001),有统计学差异,与高剂量组相比(P <0.01),比较有统计学差异。给药12 周后,各给药组大鼠血中乙醇浓度亦均明显降低,均有显著性差异(P <0.001),且配伍低剂量组血中乙醇浓度最低,与中剂量组和高剂量组比较有统计学差异(P <0.01),见表1。

表1 葛花枳椇子配伍对酒精性肝损伤大鼠血中乙醇浓度的影响
2.2 葛花枳椇子2∶1配伍对酒精性肝损伤大鼠肝中乙醇脱氢酶活性的影响
与空白组比较,模型组白酒灌胃4 周(P <0.05)、8 周(P <0.001)和12 周(P <0.001)后,肝中ADH 活性逐渐降低,均有统计学差异。与模型组比较,给药4 周后,各给药肝中ADH 活性增强,但无统计学差异(P>0.05),其中低剂量组ADH 较高。给药8 周后,东宝肝泰组(P <0.05)和配伍低剂量组(P <0.01)ADH 活性增强,有显著性差异。给药12 周后,配伍低剂量组(P <0.01)ADH 活性增强,有显著性差异,见表2。
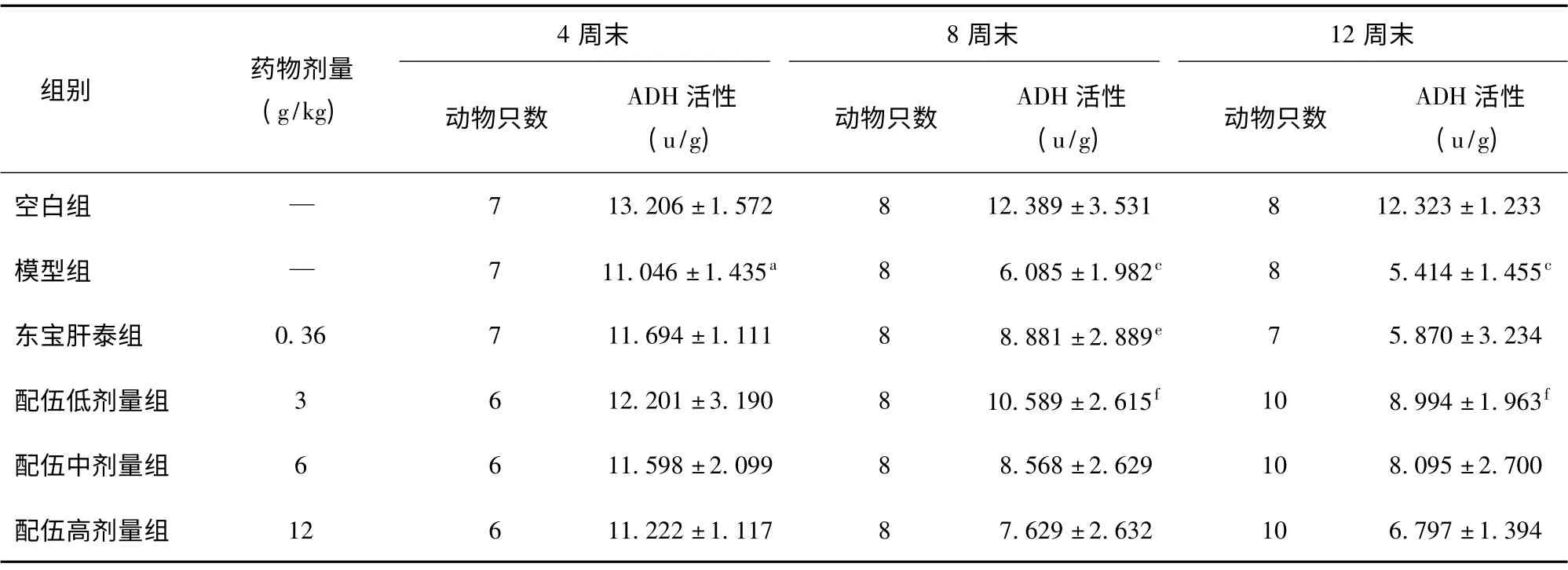
表2 葛花枳椇子配伍对酒精性肝损伤大鼠肝中ADH 的影响
3 讨论
肝脏是酒精代谢的重要场所,摄入体内的乙醇98% ~90%在肝脏内氧化,2% ~10%由呼吸道、尿液和汗腺以原形排出;肝脏代谢的乙醇80%通过乙醇脱氢酶转化为乙醛,约20%通过微粒体乙醇氧化酶转化为乙醛,乙醛再经乙醛脱氢酶转化为乙酸,进入三羧酸循环,氧化成二氧化碳和水(CH3CH2OH→CH3CHO →CH3COOH →CO2+ H2O)[5]。目 前ADL 的发病机制尚不明确,但认为与多种因素有关[6]。
口服乙醇90% ~98%是通过以下3 个途径代谢[7]:饮酒后,首先启动0 级经典途径,即通过胞质内的乙醇脱氢酶和过氧化小体内的过氧化氢酶进行代谢;当血液中乙醇浓度过高时,也启动1 级代谢途径,即通过内质网中的复合氧化酶系统进行代谢,通过这3 种途径将乙醇氧化分解为乙醛。乙醛对肝脏有直接毒性作用,可以造成肝细胞脂肪变性坏死等一系列变化。其中ADH 乙醇氧化体系在乙醇代谢中起重要作用。乙醇的肝毒性是由于乙醇脱氢酶介导过度产生还原型腺嘌呤二核苷酸及有高度毒性的乙醛的结果。肝细胞内乙醇代谢有三个主要通路,其中之一是胞浆质的ADH 通路。乙醇氧化过程中会同时伴随2 分子的氧化性辅酶I(NAD+)转化为还原型辅酶I(Nicotinamide adenine dinucleotide,NADH),这样导致NADH/NAD 比值增高,进而影响了NAD +依赖的过程,严重干扰了细胞新陈代谢,使三羧酸循环受到抑制[8]。此外,乙醇还会在代谢过程中促进氧自由基(Reactive oxygen species,ROS)的产生,同时伴随摄入不足等导致体内抗氧化物减少,促发氧化应激[9]。产生的自由基会抑制脂肪酸氧化,致使肝细胞脂肪蓄积。这是引起酒精性脂肪肝的主要原因。NADH 在340 nm 有吸收峰,故本实验采取测定单位时间内生成的NADH 引起的吸收度变化率的方法,测定ADH 活性的变化。
正常情况下,ADH 在肝脏中含量最高,血清中的ADH 活性是恒定的,只有当肝细胞受损时,ADH由肝细胞内释放入血,从而引起ADH 含量升高,所以检测血清中的ADH 活性是诊断某些肝脏疾病的指标之一。本研究观察了葛花枳椇子配伍对酒后血中乙醇质量浓度和肝中乙醇脱氢酶活性的影响。从本实验的结果可以看出,模型组大鼠肝组织中乙醇脱氢酶的活性较空白组明显降低。与模型组比较,给药4 周后,各给药组肝中ADH 活性增强,但无统计学差异;给药8 周和12 周后,配伍低剂量组ADH 活性增强,有显著性差异。
有研究表明乙醇脱氢酶活性的变化可以影响到血中乙醇的浓度。当乙醇脱氢酶活性受到抑制或下降时,导致机体对乙醇的吸收提高,从而加重乙醇对肝、肾、脑等脏器的损害。本实验另一研究结果表明随着大鼠白酒灌胃时间的延长,血中乙醇浓度逐渐升高。给药治疗8 周和12 周后,葛花枳椇子各剂量配伍组均可明显降低血中乙醇浓度,且至第12 周末,配伍低剂量组血中乙醇浓度最低,显示一定的治疗优势,提示随着给药时间的延长治疗效果越好。
结合大鼠酒后血中乙醇质量浓度和肝中乙醇脱氢酶活性的改变,可以看出给药8 周和12 周后低剂量组大鼠肝中ADH 活性增强,血中乙醇浓度明显降低。并且随着给药时间的延长,低剂量组可以通过增强乙醇脱氢酶活性加强肝脏对乙醇的代谢,降低对肝脏的损伤而起到一定的保肝效果。
[1]Cohen JI,Nagy LE.Pathogenesis of Mcohohc liver disease:interactions between parenchymal and nonparenchymal cells[J].J Dig Dis,2011,12(1):3.
[2]厉有名.酒精性肝病的流行病学特点[J].实用肝脏病杂志,2012,15(3):180-182.
[3]卿笃信,凌奇荷.酒精代谢酶与酒精性肝病的关系研究进展[J].国外医学·生理、病理科学与临床分册,2003,23(3):310.
[4]柳海艳.葛花枳椇子配伍对酒精性肝损伤的防治作用及机理探讨[D].北京:北京中医药大学,2011
[5]李先栓.乙醇代谢物的解毒探究[J].实验教学与仪器,2010,(10):36-37.
[6]时代音,董蕾,鲁晓岚,等.乙酰半胱氨酸对大鼠酒精性肝病的保护作用研究[J].陕西医学杂志,2012,41(5):519.
[7]You M,Crabb DW.Recent Advances in Alobolic Liver Disease II.Minireview:molecular mechaniams of alcoholic fatty liver[J].Am J Physial Gastrointest Liver Physiol,2004,287(1):G1-G6.
[8]杨万枝.酒精性肝病发病机制研究进展[J].安徽医科大学学报,2012,47(1):97-99.
[9]Tilg H,Moschen AR,Kaneider NC,et al.Pathways of liver injury inalcoholic liver disease[J].J Hepatol,2011,55 (5 ):1159-1161.
