活性氧介导的线粒体功能不全与小细胞肺癌多药耐药细胞H446/CDDP对顺铂耐药性关系的研究
2015-02-18王瑞璇马李杰段鸿涛
王瑞璇 马李杰 段鸿涛
王力彬3 金发光1
活性氧介导的线粒体功能不全与小细胞肺癌多药耐药细胞H446/CDDP对顺铂耐药性关系的研究
王瑞璇1马李杰1段鸿涛2
王力彬3金发光1
肺癌是全球癌症死亡的首要原因[1-2],可分为非小细胞肺癌(non small-cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC)。其中,SCLC占肺癌的15%,与NSCLC相比,SCLC恶性程度高, 易发生早期广泛性转移,目前治疗方案以全身化疗为主。顺铂作为治疗SCLC的一线化疗药物,其抗肿瘤毒性与诱导细胞凋亡有关,且其对 H446细胞凋亡的诱导呈时间和浓度依赖性[3-4],虽然早期化疗缓解率高,但复发率较高,且复发后可产生获得性多药耐药((multi-drug resistance, MDR),是目前治疗SCLC亟需解决的问题之一。近期有研究表明顺铂耐药性的发生可能与细胞凋亡通路的改变密切相关[5]。在对淋巴瘤的研究中,Sarah等[6]认为淋巴瘤细胞对氧化应激的耐受可使细胞发生凋亡耐受进而产生化疗药物耐药。课题前期的实验结果证实,受顺铂冲击后,人小细胞肺癌H446细胞内活性氧(reactive oxygen species, ROS)的水平明高于其多药耐药株H446/CDDP细胞[7]。但氧化应激是否通过调节凋亡通路进而诱导小细胞肺癌产生顺铂耐药性以及其具体作用机制还有待进一步探索。
机体在正常情况下,氧化产物 ROS的生成和清除处于动态平衡状态 。当机体受到各种刺激时,此种平衡可被打破,ROS 生成增多且超过抗氧化系统的清除能力时,机体可发生氧化应激[8]。机体氧化应激不仅参与多种疾病的发生发展, 且其所介导的细胞凋亡途径的改变可促使肿瘤细胞对化疗药物的敏感性发生改变。细胞内80%的ROS来源于线粒体[9]。细胞内增加的ROS可直接或间接损伤线粒体膜,造成线粒体膜电位下降,这一过程又可影响细胞氧化磷酸化,导致ROS的产生进一步增加,形成恶性循环。细胞内ROS水平的增加和线粒体跨膜电位的下降被认为是细胞凋亡级联反应过程中的早期事件[10-11]。 大量研究证实,抗肿瘤药物可通过增加细胞内 ROS含量进而导致线粒体功能不全如线粒体膜电位的去极化从而诱导瘤细胞凋亡[12-13]。但是目前鲜有文献报道细胞内ROS含量以及线粒体跨膜电位水平的改变与人小细胞肺癌细胞对顺铂耐药性的关系。本实验中我们通过体外检测人小细胞肺癌细胞 H446与其多药耐药细胞H446/CDDP在5 μg/ml顺铂作用下的生存率、凋亡百分比、细胞内ROS的含量以及线粒体膜电位水平,旨在探讨细胞内ROS的含量以及线粒体功能不全与小细胞肺癌多药耐药细胞H446/CDDP对顺铂耐药性的关系及其相关作用机制。
材料与方法
一、材料与试剂
人小细胞肺癌细胞株 H446及其多药耐药细胞H446/CDDP由第三军医大学新桥医院全军呼吸科研究所馈赠。RPMI-1640培养基以及胎牛血清于Gibco公司购买,Annexin V-FITC/PI(Propid-iumiodide,碘化丙啶)双染色法凋亡检测试剂盒购自美国B-D pharmingen公司, MTT, JC-1膜电位试剂盒,活性氧检测试剂均购于碧云天生物有限公司。其他所需材料还包括 0.25%胰酶, DMSO, PBS,酶标测试仪,96孔和6孔细胞培养板等。
二、实验方法
1. 细胞培养: 人肺癌细胞H446和其多药耐药细胞H446/CDDP分别应用不包含和包含顺铂(终浓度为0.5 μg/ml)的完全培养基RPMI-1640,内含10%胎牛血清培养,其中青霉素100 U/ml,链霉素100 U/ml,置37 ℃,5%CO2,培养箱内培养。
2. MTT法测定细胞生存率: 取对数生长期的H446和H446/CDDP两种细胞,0.25%胰酶消化,培养基重悬制备单细胞悬液,分别取200 μl细胞悬液接种于96孔培养板之中,保证每孔的细胞接种量为5×103个,然后将96孔板置培养箱内培养12 h后,吸去培养板内培养基,空白对照组加入200 μl完全培养基,加药组加入含顺铂 (终浓度为5 μg/ml)的培养基200 μl,分别培养24、48、72 h后,每孔加入20 μl MTT(5 mg/ml,PBS配制),37 ℃培养箱内孵育4 h之后,吸去每孔上清液,加入150 μl DMSO,用酶联免疫检测仪于490 nm处检测各孔的OD值,重复3次。计算细胞的存活率。细胞存活率=(用药组OD-空白组OD值)/(对照组OD-空白组OD值)×100%。
3. Annexin V/PI双染色测定细胞凋亡: 取对数生长期的H446和H446/CDDP两种细胞,0.25%胰酶消化,培养基重悬制备单细胞悬液,以1×105/孔分别接种于两个六孔培养板中,置37 ℃ ,含5%CO2的培养箱内培养24 h,待细胞生长至六孔板底面积的60~70%时,吸去培养板内培养基,空白对照组加入2 ml完全培养基,加药组加入含5 μg/ml顺铂的培养基2 ml,37 ℃培养箱内培养24 h后,用0.25%胰酶消化细胞,离心半径8 cm,800 r/min,离心5 min弃上清液收集细胞;每管中加入2 ml PBS液混匀,细胞离心洗涤2次。最后加入300 μl Binding Buffer重悬细胞,再加入5 μl Annexin V-FITC,5 μl PI,避光室温反应15 min,流式细胞仪检测细胞凋亡。
4. 细胞内ROS的检测: 取对数生长期的H446和H446/CDDP细胞,以1×105/孔分别接种于两个六孔培养板中,两种细胞均分为阴性对照组, 加药组(加入5 μg/ml的顺铂),分别检测顺铂刺激24 h后,两种细胞内ROS的变化。用无血清培养基洗涤细胞一次,每孔加入2 ml终浓度为10 μmol/L DCFH-DA 的无血清培养基充分覆盖细胞,37 ℃培养箱内孵育20 min后,应用无血清培养基洗涤细胞3次,充分去除未进入细胞的DCFH-DA,最后加入1 ml无血清培养基,30 min内置于荧光显微镜下观察,绿色荧光的强弱代表细胞内ROS的水平。
5. JC-1测线粒体膜电位(MMP): JC-1是一种广泛用于检测线粒体膜电位(MMP) 的理想荧光探针。在线粒体膜电位较高时,JC-1聚集在线粒基质中,形成聚合物,可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,可以产生绿色荧光。取对数生长期的H446和H446/CDDP细胞,0.25%胰酶消化,培养基重悬制备单细胞悬液,以1×105/孔分别接种于六孔培养板中,两种细胞均分为阴性对照组,加药组(加入5 μg/ml的顺铂),置培养箱内培养24 h, 然后进行线粒体膜电位的检测,首先吸去六孔板内培养液,PBS洗涤细胞两次,每孔加入1 ml细胞培养液、1 ml JC-1染色工作液,充分混匀,置细胞培养箱内孵育20 min后,吸除上清液,用1×JC-1缓冲液洗涤细胞两次,最后每孔加入2 ml细胞培养液,荧光显微镜观察。检测JC-1单体即绿色荧光时,激发波长为490 nm,发射波长为530 nm,检测JC-1复合物即红色荧光时,激发波长为525 nm,发射波长为590 nm。
三、统计学方法
采用SPSS 17.0统计软件。计量数据以均数±标准差表示。两样本均数比较用t检验;多个样本均数比较用单因素方差分析 。P≤0.05即差异有统计学意义。
结果
一、顺铂对H446和H446/CDDP两种细胞的生长抑制
应用5 μg/ml的顺铂作用于两种细胞,如图1所示,细胞存活率随时间的延长而降低,呈现出明显的时间依赖性。且多药耐药细胞H446/CDDP 在24、48、72 h的存活率分别为:0.661±0.023、0.507±0.031和0.441±0.023,明显高于H446细胞在顺铂刺激时相应时间点的存活率:0.389±0.051、0.212±0.020 和0.138±0.009(P<0.05)。

图1H446和H446/CDDP两种细胞5 μg/ml顺铂诱导后24、48、72 h后细胞生存率
二、顺铂诱导H446和H446/CDDP细胞凋亡
应用5 μg/ml顺铂作用于H446和H446/CDDP两种细胞24 h后,分别检测细胞的凋亡百分比。如图2所示 ,H446细胞和H446/CDDP细胞的凋亡百分比分别为(13.83±1.79)%% 和(4.87±0.80)%,前者明显高于后者,且H446细胞早期凋亡百分数 也明显高于H446/CDDP细胞, 统计学差异明显(P<0.05)[(8.63±0.45)%vs. (1.97±0.42)%]。

图2流式细胞仪检测细胞凋亡,A:H446正常组,B:H446 5 μg/ml顺铂组,C: H446/CDDP正常组,D:H446/CDDP H446 5 μg/ml顺铂组
三、顺铂诱导H446和H446/CDDP两种细胞后细胞内ROS的含量变化
应用5 μg/ml的顺铂作用于两种细胞24 h后,检测细胞内ROS的含量以明确两种细胞在顺铂刺激后细胞内的氧化应激水平。结果如图3所示,H446细胞内ROS的水平在顺铂刺激24 h后明显增加,而H446/CDDP细胞在顺铂刺激24 h后细胞内ROS的表达量也有所增加,但增加的程度明显低于H446细胞。

图3顺铂诱导24 h后H446和H446/CDDP细胞内ROS的水平
四、顺铂诱导H446和H446/CDDP两种细胞 MMP的检测结果
细胞内ROS的升高可诱导线粒体膜电位下降,下降的膜电位又可进一步使细胞内ROS增加,两者协同作用,是细胞凋亡早期的一个标志性事件。如图4所示, 应用5 μg/ml的顺铂作用于24 h后,H446细胞内红色荧光减弱,绿色荧光明显增强,MMP下降水平显著,而H446/CDDP细胞线粒体内红色荧光强度明显高于绿色荧光强度,MMP下降水平明显低于H446细胞。
讨论
肺癌作为最常见的恶性肿瘤之一,治疗方式包括手术,放疗以及化疗等。 SCLC占肺癌的15%左右,因多数患者在确诊早期已发生广泛转移,使化疗成为治疗SCLC的主要手段。但由于多药耐药现象的产生,常导致化疗的失败,患者的5年生存率低于5%[14]。因此,深入研究SCLC耐药性的发生机制对于提高肺癌患者的总体生存率具有重要的意义。
细胞凋亡,又称程序性细胞死亡,在肿瘤的发生发展中发挥至关重要的作用。细胞凋亡有两种途径,死亡受体介导的外源性途径以及线粒体介导的内源性途径。大量文献报道,适时适度的细胞凋亡对于机体正常功能的维持具有重要的意义,凋亡耐受不仅是肿瘤细胞的标志之一,而且可以诱导肿瘤细胞对化疗药物产生耐药。在实验中,我们首先将5 μg/ml的顺铂作用于H446和H446/CDDP两种细胞,发现细胞均呈现出时间依赖性的生存抑制,且耐药细胞的生存率明显高于敏感细胞,随着药物作用时间的延长其耐药性越来越显著。顺铂作为化疗药物之一,可以与细胞内DNA 结合形成顺铂-DNA复合物,从而激活多种信号通路,诱导细胞凋亡进而发挥毒性作用。因此我们推测H446/CDDP细胞对顺铂的耐药性与其凋亡耐受相关。本实验中,应用流式细胞凋亡检测仪我们发现两种细胞在5 μg/ml顺铂作用24 h后,H446细胞和H446/CDDP细胞的凋亡百分比分别为(13.83 ±1.79)%% 和(4.87±0.80)%,前者明显高于后者,其中早期凋亡细胞比例分别为(8.63±0.45)%和(1.97±0.42)%,具有明显的统计学差异。 提示多药耐药细胞H446/CDDP对顺铂耐药性的产生与凋亡抑制有关。
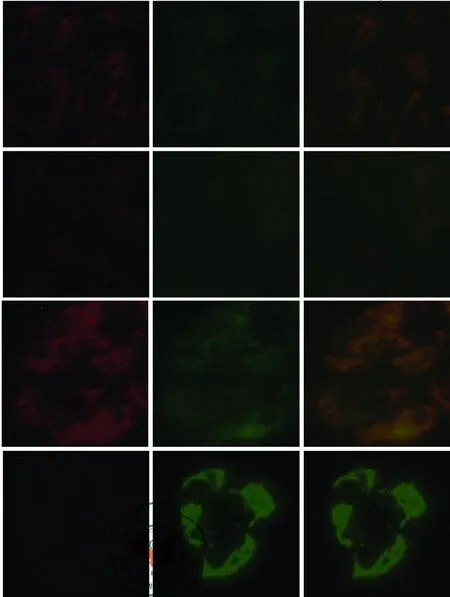
图45 μg/ml顺铂诱导24 h后H446和H446/CDDP两种细胞线粒体膜电位(MMP)
线粒体是普遍存在于真核细胞中的一种半自主细胞器,除了为细胞供能外,还参与信息传递,细胞凋亡等过程,且其基因的突变或者蛋白表达的异常与肿瘤细胞化疗药物耐药有关[15-16]。Kachadourian等[17]认为,顺铂诱导的细胞凋亡与细胞内氧化应激有关,且以往有文献报道, H446 细胞内ROS含量增加可导致MMP降低,下降的膜电位又可促使线粒体细胞色素C释放并激活凋亡通路下游相关蛋白,诱导线粒体介导的内源性凋亡途径的活化,促使小细胞肺癌H446细胞凋亡[18]。本实验中我们应用5 μg/ml的顺铂分别作用于H446和H446/CDDP两种细胞24 h后,发现H446细胞内ROS的含量明显高于H446/CDDP细胞内ROS的含量 ;与此同时,H446细胞MMP的下降明显高于H446/CDDP细胞,早期细胞凋亡百分比也相应增加 。以上结果提示H446/CDDP对顺铂耐药的产生可能与细胞内ROS的减少进而导致MMP下降抑制所介导的内源性的凋亡耐受有关。
本研究证实,应用顺铂治疗小细胞肺癌H446细胞,细胞内ROS含量增加,MMP下降,诱导细胞凋亡;而多药耐药细胞H446/CDDP对顺铂耐药性的产生与细胞内ROS的含量减少进而导致MMP下降抑制所致的线粒体介导的内源性的凋亡耐受有关。但是具体分子机制还需进一步研究探索,这将为临床治疗小细胞肺癌患者, 提高其总体生存率奠定坚实的理论基础。
参考文献
1任成山, 钱桂生. 支气管肺癌研究的新思维[J/CD]. 中华肺部疾病杂志:电子版, 2009, 2(3): 143-146.
2Villaruz LC, Socinski MA, Cunningham DE, et al. The prognostic and predictive value of KRAS oncogene substitutions in lung adenocarcinoma[J]. Cancer, 2013, 119(12): 2268-2274.
3Efferth T, Rücker G, Falkenberg M, et al. Detection of apoptosis in KG-1a leukemic cells treated with investigational drugs.[J]. Arzneimittelforschung, 1996, 46(2): 196-200.
4戢福云, 钱桂生, 钱频, 等. 顺铂诱导人小细胞肺癌细胞系NCI-H446细胞的凋亡[J]. 中国癌症杂志, 2007, 17(5): 354-357.
5Scagliotti GV, Parikh P, von Pawel J, et al. Phase Ⅲ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26(21): 3543-3551.
6Wilkinson ST, Tome ME, Briehl MM. Mitochondrial adaptations to oxidative stress confer resistance to apoptosis in lymphoma cells[J]. Int J Mol Sci, 2012, 13(8): 10212-10228.
7梁丽峰, 李佩佩, 常蕊静, 等. 人小细胞肺癌细胞H446及其MDR细胞H446/DDP受顺铂冲击后乳酸代谢与活性氧产生情况[J/CD]. 中华肺部疾病杂志:电子版, 2013, 6(2):134-138.
8Miyamoto H, Doita M, Nishida K, et al. Effects of cyclic mechanical stress on the production of inflammatory agents by nucleus pulposus and anulus fibrosus derived cells in vitro[J]. Spine (Phila Pa 1976), 2006, 31(1): 4-9.
9Kaneda K, Miyamoto K, Nomura S, et al. Intercellular localization of occludins and ZO-1 as a solute transport barrier of the mesothelial monolayer[J]. J Artif Organs, 2006, 9(4): 241-250.
10Zamzami N, Marchetti P, Castedo M, et al. Reduction in mitochondrial potential constitutes an early irreversible step of programmed lymphocyte death[J]. J Exp Med, 1995, 181(5): 1661-1672.
11Luo J, Shi R. Acrolein induces oxidative stress in brain mitochondria [J]. Neurochem Int, 2005, 46(3): 243-252.
12Ma Y, Zhang J, Zhang Q, et al. Adenosine induces apoptosis in human liver cancer cells through ROS production and mitochondrial dysfunction[J]. Biochem Biophys Res Commun, 2014, 448(1): 8-14.
13Esmaeili MA, Farimani MM, Kiaei M. Anticancer effect of calycopterin via PI3K/Akt and MAPK signaling pathways, ROS-mediated pathway and mitochondrial dysfunction in hepatoblastoma cancer (HepG2) cells[J]. Mol Cell Biochem, 2014, 397(1-2): 17-31.
14Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300.
15Matsuyama W, Nakagawa M, Wakimoto J, et al. Mitochondrial DNA mutation correlates with stage progression and prognosis in non-small cell lung cancer[J]. Hum Mutat, 2003, 21(4): 441-443.
16Tseng LM, Yin PH, Chi CW, et al. Mitochondrial DNA mutations and mitochondrial DNA depletion in breast cancer[J]. Genes Chromosomes Cancer, 2006, 45(7): 629-638.
17Kachadourian R, Leitner HM, Day BJ. Selected flavonoids potentiate the toxicity of cisplatin in human lung adenocarcinoma cells: a role for glutathione depletion[J]. Int J Oncol, 2007, 31(1): 161-168.
18Yang CL, Ma YG, Xue YX, et al. Curcumin induces small cell lung cancer NCI-H446 cell apoptosis via the reactive oxygen species-mediated mitochondrial pathway and not the cell death receptor pathway[J]. DNA Cell Biol, 2012, 31(2): 139-150.
(本文编辑:王亚南)
王瑞璇,马李杰,段鸿涛,等. 活性氧介导的线粒体功能不全与小细胞肺癌多药耐药细胞H446/CDDP对顺铂耐药性关系的研究[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(5): 569-573.
·论著·
【摘要】目的探讨人小细胞肺癌多药耐药细胞 H446/CDDP细胞内活性氧(ROS)介导的线粒体功能不全及其与顺铂耐药性之间的关系。方法用MTT法检测H446细胞及其多药耐药细胞H446/CDDP在5 μg/ml顺铂作用后的细胞生存率,流式细胞术检测细胞凋亡,荧光显微镜观察顺铂诱导后两种细胞内 ROS含量以及线粒体膜电位 (MMP)水平。实验中均设置空白对照组。结果顺铂诱导后细胞的生存率均随药物作用时间的延长明显降低,且H446/CDDP细胞在各个时间点的生存率均明显高于H446细胞;5 μg/ml顺铂作用24 h后H446和H446/CDDP两种细胞的早期凋亡百分比分别为(8.63±0.45)%和(1.97±0.42)%,具有明显的统计学差异(P<0.05);H446细胞内ROS的水平在顺铂诱导24 h后明显升高, 而 H446/CDDP细胞内ROS的水平无明显变化;与此同时,H446细胞 MMP下降水平明显高于H446/CDDP细胞。结论顺铂可使小细胞肺癌 H446 细胞内ROS的产生增加,MMP下降,从而诱导细胞凋亡,而多药耐药细胞H446/CDDP顺铂耐药性的产生与顺铂作用后细胞内ROS减少,MMP下降抑制所致的线粒体介导的内源性细胞凋亡途径耐受有关。
【关键词】小细胞肺癌;H446/CDDP细胞;顺铂;细胞凋亡;活性氧
Study of reactive oxygen species mediated mitochondrial dysfunction on cisplatin resistance in multi-drug resistance cells H446/CDDPWangRuiXuan1,MaLiJie1,DuanHongtao2,WangLibin3,JinFaguang1.1DepartmentofRespiratoryMedicine,TangduHospitalaffiliatedtotheForthMilitaryMedicalUniversity,Xi′an710038,China
Correspondingauthor:JinFaguang,Email:jinfag@fmmu.edu.cn
【Abstract】ObjectiveTo explore the relationship between reactive oxygen species-dependent mitochondrial dysfunction and cisplatin resistance in multi-drug resistance cells H446/CDDP. MethodsThe survival rate of small cell lung cancer cells H446 and the multi-drug resistance H446/CDDP cells were measured by MTT assay after cisplatin induced (5 μg/ml). Cell apoptosis were detected by flow cytometry. Meanwhile both Intracellular reactive oxygen species (ROS) and mitochondrial membrane potential (MMP)were observed using fluorescence microscope. There were blank controls in the study. ResultThe survival rate of both cells were obviously decreased after cisplatin induced as stimulating time prolonged, and at each time point H446/CDDP cells survival rate were significantly higher than that of H446 cells. Early apoptosis percentage of H446 and H446/CDDP after cisplatin induced(5 μg/ml) were(8.63±0.45)% and (1.97±0.42)%, the difference is statistically significant(P<0.05). ROS content in H446 cells increased markly after being stimulated 24 h by cisplatin, on the other hand ROS in H446/CDDP cells barely rose. At the same time, reduction of the H446 cells MMP was significantly higher than that of H446/CDDP cells. Conclusion Cisplatin induced apoptosis involves increased production of ROS, and dissipation of MMP, while cisplatin resistance in multi-drug resistance cells H446/CDDP is associated with resistance of mitochondriamediated apoptotic (intrinsic) pathways which is mediated by the reduction of intracellular ROS and the inhibition of loss of MMP after the application of cisplatin.
【Key words】Small cell lung cancer;H446/CDDP cells;Cisplatin;Cell apoptosis;Reactive oxygen species (ROS)
收稿日期:(2015-07-09)
文献标识码:中图法分类号: R743.2,R563 A
通讯作者:金发光,Email: jinfag@fmmu.edu.cn
基金项目:作者单位: 710038 西安,第四军医大学唐都医院呼吸内科1、胸外科2;710038 西安,第四军医大学药学系3
DOI:10.3877/cma.j.issn.1674-6902.2015.05.008
