大环内酯类免疫抑制剂的研究进展*
2014-11-20魏继福龚晓健王永庆
刘 菲 ,魏继福 ,孟 玲 ,龚晓健 ,王永庆 **
1中国药科大学药理教研室,南京 210009;
2江苏省人民医院药学部临床药理实验室,南京 210029
FK506结 合蛋 白 (FK506 binding proteins,FKBPs)最早在免疫细胞中发现,具有肽基脯氨酰基顺反异构酶(peptidyl-prolylcis-trans isomerase,PPI-ases)活性。FKBPs在人类中已发现15个成员[1],其中FKBP12以其分子量12 kD而得名,是目前发现的分子量最小的、也是研究最多的FKBPs[2]。
微生物酵解产物他克莫司、雷帕霉素和子囊霉素是FKBPs的配体,且对FKBP12均有较高亲和力,属于免疫抑制剂。目前他克莫司和雷帕霉素已经广泛地应用于器官移植排斥反应的治疗中,两者的免疫抑制机制都与FKBPs密切相关[3]。他克莫司,雷帕霉素和子囊霉素及其衍生物都是FKBP12重要的配体,不仅具有免疫抑制作用,还可应用在其他疾病的治疗上。有些小分子化合物也能与FKBP12结合发挥神经保护作用[4]。本文就FKBP12配体及其多种的生理功能进行综述,为一些疾病的治疗提供新的策略。
1 他克莫司及其衍生物
1.1 他克莫司
1.1.1 他克莫司的免疫抑制作用他克莫司(FK506,tacrolimus) 是一种从筑波链霉菌(Streptomyces tsuknbaenis)发酵产物中分离出来的23元大环内酯类免疫抑制剂(如图1.1)。他克莫司进入细胞 后 , 首 先 与 FKBPs (FKBP12、FKBP12.6 和FKBP51)结合成FK506-FKBP复合物,然后再与钙调磷酸酶(calcineurin,CaN)结合,从而抑制 CaN的活性。CaN的一个重要作用是引起活化 T细胞核因 子 家 族 (nuclear factor of activated T cells,NFATs)的去磷酸化。CaN抑制剂可干扰去磷酸化的NFATs转位进入细胞核内,从而抑制白介素-2(IL-2)的基因表达及T细胞的早期活化(G0~G1期)[5]。
在发现他克莫司之前,临床上常用环孢素A(CsA)作为免疫抑制剂来治疗器官移植后的排斥反应。CsA也是一种CaN抑制剂,免疫抑制机制与他克莫司类似,但他克莫司的作用效果是CsA的100倍左右[6]。心血管疾病是CsA治疗中易引发的不良反应,而他克莫司有可能加重这一不良反应。主要原因在于他克莫司的结合蛋白FKBP12具有peptidyl-prolyl isomerases(PPIases)活性,可稳定兰尼碱受体(RyRs)和 1,4,5-三磷酸肌醇受体(IP3R)的构象。RyRs和IP3R是细胞内两个主要的钙离子释放通道。他克莫司与FKBP12的结合导致FKBP12与RyRs和IP3R的分离,引起钙离子从钙通道上过度释放,对心血管系统有一定影响[7]。而近期Szabó等[8]发现治疗浓度的他克莫司对犬类心肌细胞的离子通道并无直接影响。还有报道称,他克莫司可降低心血管疾病的风险。器官移植后的患者在由CsA治疗转变为他克莫司治疗后,高血压和高血脂的症状都有所缓解,但是服用他克莫司的患者的高血糖发生率仍然很高[9]。
他克莫司的免疫抑制活性还体现在自身免疫性疾病的治疗上。重症肌无力 (myasthenia gravis,MG)是一种主要累及神经肌肉接头突触后膜上乙酰胆碱受体(acetylcholine receptor,AchR)的自身免疫性疾病。在日本,他克莫司已被用作治疗MG[10]。
1.1.2 其他功能CaN可使神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)和 Bcl-2家族促凋亡蛋白BAD去磷酸化,引起神经细胞凋亡[11]。FK506-FKBPs可抑制CaN的活性,防止神经细胞凋亡,对神经系统具有保护作用。此外,他克莫司还具有抗炎的作用。目前外用他克莫司软膏已用于治疗皮肤病,其中特应性皮炎(atopic dermatitis)是其主要适应症[12]。
1.2 他克莫司衍生物
他克莫司衍生物是一类与其结构相似的化合物,也具有结合FKBP12的能力。其中506BD的结构(如图1.2)与他克莫司相比,同样包含FKBP12结合域[13]。另一个他克莫司衍生物是L-685,818(如图1.3),与他克莫司的区别在于第18位、第21位和第24位碳上[14]。这两种化合物都能结合FKBP12,但都不能抑制CaN的活性。506BD和L-685,818可与他克莫司竞争与FKBP12结合,从而他克莫司引起的降低免疫抑制作用。因此,在研究他克莫司的作用机制时,506BD和L-685,818常用作他克莫司竞争性拮抗剂。
2 雷帕霉素及其衍生物
2.1 雷帕霉素
2.1.1 雷帕霉素的免疫抑制作用雷帕霉素(rapamycin)最初是从放线菌(Streptomyces hygroscopicus)培养液中分离出的35元大环内酯类抗生素,又称西罗莫司(如图2.1)。雷帕霉素虽然和他克莫司一样都能与FKBP12结合,但是其免疫抑制机制却不同。雷帕霉素与FKBP12结合成rapamycin-FKBP复合物并不能影响CaN的活性,而是通过阻断哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)的活性来发挥免疫抑制作用。mTOR是一种分子量为289-kDa的丝氨酸/苏氨酸蛋白激酶。mTOR对CD4+T细胞,记忆性CD8+T细胞,抗原提呈细胞(antigen-presenting cell,APC)及B细胞的分化有促进作用[15-16]。当mTOR活性被雷帕霉素抑制时,调节性T细胞(T-regulatory cells)大量增殖,对机体免疫反应的负向调节增加[17]。还有文献报道[16],雷帕霉素可阻断树突细胞(dendritic cells,DCs)对T细胞免疫应答的刺激作用。
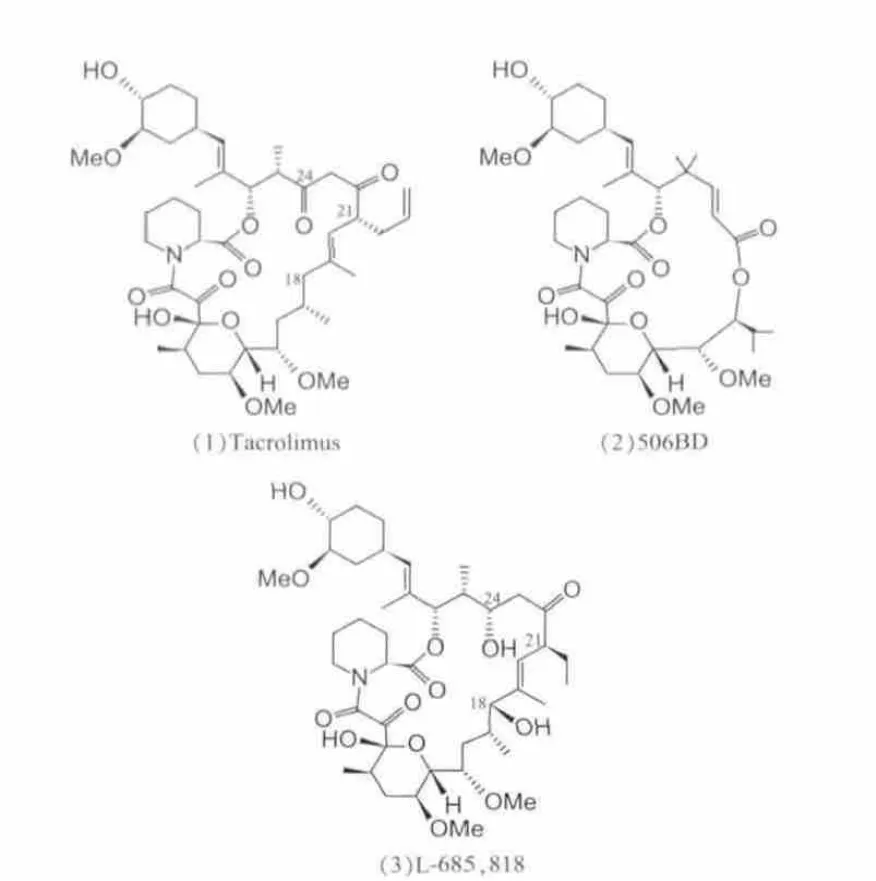
图1 他克莫司(Tacrolimus)及其衍生物的结构式
雷帕霉素同他克莫司在治疗器官移植后排斥反应的效果上相似,但是雷帕霉素可降低患者移植术后高血糖的发生率。Veroux等[18]的研究发现,将治疗排斥反应的免疫抑制剂由CsA或他克莫司转变成雷帕霉素后,移植患者的高血糖发生率明显降低。这表明,mTOR在胰岛素信号转导和葡萄糖代谢过程中扮演重要角色。
2.1.2 其他功能近年来,雷帕霉素的抗肿瘤功能越来越受到学者的关注。FKBP12可与TGF-β受体I(TGF-βreceptor,TGF-βRI)结合来稳定 TGF-βRI构象。雷帕霉素可与TGF-βRI竞争性结合FKBP12,使TGF-βRI从复合物TGF-βRI-FKBP12中释放出来,从而加强TGF-β介导的small mothers against decapentaplegic(Smad)信号通路,抑制肿瘤细胞的生长[19]。有报道称,雷帕霉素与转化生长因子-β(TGF-β)存在协同作用,可使细胞周期停留在G1期,可能与雷帕霉素导致TGF-βRI的释放有关[20]。
mTOR存在于两种复合物中,即mTORC1和mTORC2[21]。雷帕霉素主要是对mTORC1有抑制作用,对mTORC2不敏感。mTORC1活化后,可作用于两种蛋白合成相关因子4E-BP1和S6K1。雷帕霉素可抑制4E-BP1和S6K1的磷酸化来阻断蛋白合成,抑制肿瘤细胞的增殖。4E-BP1是调节mRNA翻译的关键分子,磷酸化的S6K1可激活核糖体生物合成过程,因此4E-BP1的激活对蛋白合成更为重要。然而,雷帕霉素对4E-BP1的作用比对S6K1要弱的多[22]。雷帕霉素抑制mTORC1会引发负反馈调节作用,导致蛋白激酶B(又称AKT)的激活,减弱雷帕霉素的抗肿瘤作用[23]。所以,虽然雷帕霉素及其衍生物在治疗肿瘤上已展现出较好的疗效[24],但是由于以上这些原因,它们的抗肿瘤作用还是受到一些限制。
雷帕霉素还可应用在心血管疾病的治疗中。冠状动脉介入术已用于修复冠状动脉狭窄,但是术后复发的概率还是很高。虽然气囊血管成形术(balloon angioplasty)已经对复发的状况有所改善,但由于血管平滑肌 (vascular smooth muscle,VSM)细胞的增殖效果仍不理想[25]。雷帕霉素可通过抑制mTOR的活性来减弱VSM细胞的增殖。临床试验发现,应用冠状动脉支架移植术的患者复发率比气囊血管成形术要低,且将雷帕霉素涂抹在手术用的冠状动脉支架上效果更佳[26]。
2.2 雷帕霉素衍生物
2.2.1 mTOR抑制剂雷帕霉素的衍生物依维莫司、替西罗莫司和地磷莫司均属于mTOR抑制剂,抗肿瘤的机制与雷帕霉素类似,并且修正了雷帕霉素作为抗肿瘤药物时水溶性和稳定性不佳的缺点,且在临床上已体现出较好的疗效[25]。
依维莫司(everolimus,又称 RAD001,如图 2.2)是雷帕霉素的衍生物,也具有免疫抑制活性,临床上已被用于治疗器官移植后的排斥反应,并发现其与CNI合用时可明显减轻不良反应[27]。依维莫司目前已被FDA批准治疗早期肾细胞癌和神经内分泌瘤,且是目前市场上销售最成功的FKBP12配体药物[24,28]。 替西罗莫司(temsirolimus,又称 CCI-779,如图2.3)是第一个FDA批准的雷帕霉素衍生物,其适应症是肾细胞癌[29]。地磷莫司(ridaforolimus,又称AP23573,如图2.4)目前虽然尚未被FDA批准治疗肿瘤,但地磷莫司治疗子宫内膜癌已进入2期临床试验[30],治疗肉瘤已进入3期临床试验[31],是未来非常有前景的抗肿瘤药物。
2.2.2 非mTOR抑制剂WAY-124466(如图2.5)、WYE-592(如图 2.6)和 ILS-920(如图 2.7)都是雷帕霉素的半合成衍生物,在雷帕霉素结构的三烯的位置上发生反应,导致其失去抑制mTOR的能力,均无免疫抑制活性。细胞培养实验表明,WAY-124466和WYE-592均有促进神经细胞生长的作用[32];惠氏公司研制的ILS-920治疗缺血性脑卒中已进入1期临床试验[33]。
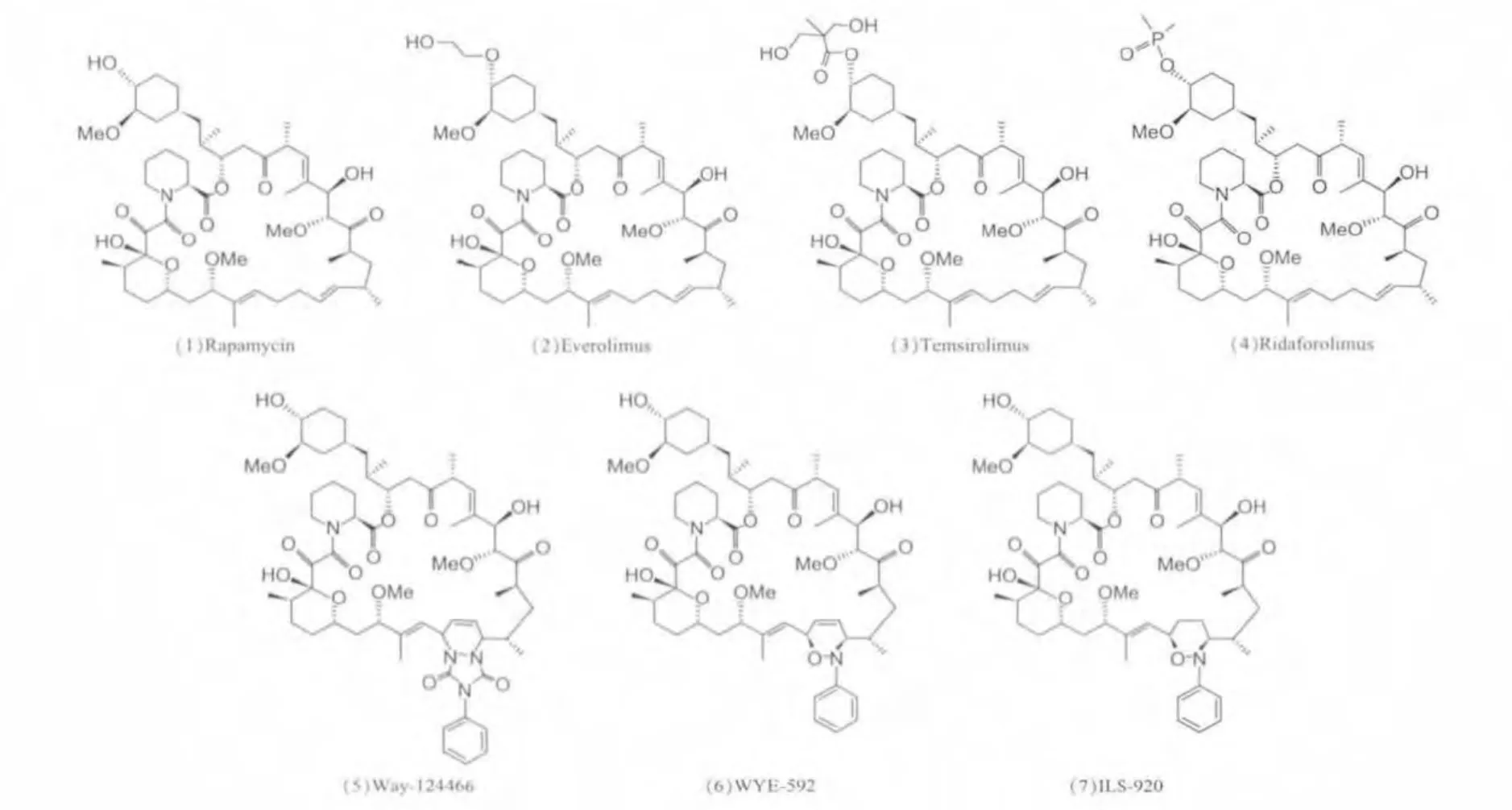
图2 雷帕霉素(Rapamycin)及其衍生物的结构式
2.3 子囊霉素及其衍生物
2.3.1 子囊霉素子囊霉素 (asomycin, 又称FK520,如图3.1)为23元的大环内酯结构,是从吸水链霉菌(Streptomyces hygroscopicus)的土壤中分离出来的。以往只知道子囊霉素具有抗菌活性;直到它的类似物他克莫司的发现才推动了子囊霉素免疫抑制作用的研究。子囊霉素结合FKBP12的位点与他克莫司相同,其免疫抑制机制与他克莫司类似,对CaN有抑制作用[34]。
2.3.2 匹美莫司匹美莫司(SDZ ASM 981,pimecrolimus,如图3.2)是一种子囊霉素的衍生物,结构上与子囊霉素的区别仅在于32位碳上的羟基转变为氯。匹美莫司是一种新型的CaN抑制剂,临床上已被用于治疗特应性皮炎,美国市场上销售的商品名为Elidel®[35]。匹美莫司和他克莫司的抗炎机制相同,都是通过抑制NFATs介导的炎症细胞因子的转录来发挥抗炎作用的[36]。与他克莫司相比,匹美莫司有较好的皮肤选择性,用药后引起的全身性免疫应答较轻微;且匹美莫司有更好的亲脂性,对皮肤有更强的亲和力[37]。虽然如此,匹美莫司抑制CaN的能力低于他克莫司3倍左右。因此,在美国,他克莫司被用于治疗中度至重度特应性皮炎,匹美莫司被用于治疗轻度至中度特应性皮炎[35]。

图3 子囊霉素(Ascomycin)及其衍生物匹美莫司(Pimecrolimus)的结构式
3 其他FKBP12天然配体
美立霉素(meridamycin,如图4.1)是从吸水链霉菌(Streptomyces hygroscopicus)菌株中分离出的27元大环内酯类化合物[38]。Antascomicins(如图4.2)是从小单孢菌 (Micromonospora)中分离得到的[39]。Meridamycin和antascomicins均与FKBP12具有较高的亲和力,但由于缺乏他克莫司或雷帕霉素上的效应基团,因此它们并没有免疫抑制功能。Meridamycin和其衍生物虽然不是免疫抑制剂,但对神经细胞具有保护的作用[32]。

图4 其他FKBP12天然配体Meridamycin和Antascomicins的结构式
4 小分子配体
FKBP12小分子配体是指能与FKBP12结合、分子量低于800Da的化合物,它们是依照他克莫司或雷帕霉素的FKBP12结合域设计而成的,具有神经保护功能[4]。他克莫司的神经保护机制与CaN的抑制相关,而这些小分子配体只能结合FKBP12,却不能抑制CaN。这表明,FKBP12配体可通过另外一种不依赖CaN的机制来发挥神经保护作用,但这个机制尚未明确。福泰制药公司(Vertex Pharmaceuticals)和吉尔福德制药公司(Guilford Pharmaceuticals)研制出多种FKBP12的小分子配体。其中比较经典的是由福泰团队研制的V-10367(如图5.1),以及吉尔福德团队研制的GPI-1046(如图5.2)和GPI-1485(如图 5.3)[40]。

图5 FKBP12小分子配体的结构式
V-10367是迄今为止FKBP12的合成配体中亲和力最高的[32]。体内和体外实验都报道了V-10367的神经保护功能[41]。由于V-10367对CaN不敏感,常用来研究FKBP12配体神经保护机制的非CaN依赖途径[42]。Tanaka等研究发现,GPI-1046可导致黑质中神经营养因子GDNF(glial cell line-derived neurotrophic factor)水 平的显著提高[43];Sauer 等经小鼠Morris水迷宫实验发现,GPI-1046全身给药有助于提升小鼠空间记忆力,可能是由于GPI-1046对胆碱能神经元萎缩的修复[44]。而GPI-1485治疗帕金森氏症(Parkinson’s disease)已进入 2期临床试验[45]。
5 结 语
本文针对功能蛋白FKBP12的几种大环内酯类配体及其生理功能进行了综述,且部分配体目前已开发成临床上的治疗药物。新型FKBP12配体一般是依照他克莫司或雷帕霉素FKBP结合域设计而成的,其中FKBP12小分子配体由于其分子量较小更易于透过血脑屏障,神经保护效果可能优于神经保护因子GDNF或BDNF,开发这类化合物为今后治疗神经失调类疾病提供了新的策略。
[1]Blackburn EA,Walkinshaw MD.Targeting FKBP isoforms with small-molecule ligands[J].Curr Opin Pharmacol,2011,11(4):365-71.
[2]Kang CB,Hong Y,Dhe-Paganon S,et al.FKBP fami-ly proteins:immunophilins with versatile biological functions[J].Neurosignals,2008,16(4):318-25.
[3]Wu X,Wang L,Han Y,et al.Creating Diverse Target-Binding Surfaces on FKBP12:Synthesis and Evaluation of a Rapamycin Analogue Library[J].ACS Comb Sci,2011,13(5):486-95.
[4]Gerard M,Deleersnijder A,Demeulemeester J,et al.Unraveling the role of peptidyl-prolyl isomerases in neurodegeneration[J].Mol Neurobiol,2011,44(1):13-27.
[5]Hamawy MM,Knechtle SJ.An overview of the actions of cyclosporine and FK506[J].Transplant Rev(Orlando),2003,17(4):165-71.
[6]Fung J,Abu-Elmagd K,Jain A,et al.A randomized trial of primary liver transplantation under immunosuppression with FK 506 vs cyclosporine[J].Transplant Proc,1991,23(6):2977-83.
[7]Cameron AM,Steiner JP,Sabatini DM,et al.Immunophilin FK506 binding protein associated with inositol 1,4,5-trisphosphate receptor modulates calcium flux[J].Proc Natl Acad Sci USA,1995,92(5):1784-8.
[8]Szabó L,Szentandrássy N,Kistamás K,et al.Effects of tacrolimus on action potential configuration and transmembrane ion currents in canine ventricular cells[J].Naunyn Schmiedebergs Arch Pharmacol,2013,386(3):239-46.
[9]Zadrazil J,Horak P,Zahalkova J,et al.Improvement of cardiovascular risk factors and cosmetic side effects in kidney transplantrecipients after conversion to tacrolimus[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2009,153(1):67-73.
[10]Wakata N,Saito T,Tanaka S,et al.Tacrolimus hydrate(FK506):therapeutic effects and selection of responders in the treatment of myasthenia gravis[J].Clin Neurol Neurosurg,2003,106(1):5-8.
[11]Guo X,Dillman JF,Dawson VL,et al.Neuroimmunophilins:novel neuroprotective and neuroregenerative targets[J].Ann Neurol,2001,50(1):6-16.
[12]Pople PV,Singh KK.Targeting tacrolimus to deeper layers of skin with improved safety for treatment of atopic dermatitis[J].Int J Pharm,2010,398(1):165-78.
[13]Bierer BE,Somers PK,Wandless TJ,et al.Probing immunosuppressant action with a nonnatural immunophilin ligand[J].Science,1990,250(4980):556-9.
[14]Becker J,Rotonda J,McKeever B,et al.FK-506-binding protein:three-dimensionalstructure ofthe complex with the antagonist L-685,818 [J].J Biol Chem,1993,268(15):11335-39.
[15]Powell JD,Pollizzi KN,Heikamp EB,et al.Regulation of immune responses by mTOR[J].Annu Rev Immunol,2012,30:39-68.
[16]ArakiK,YoungbloodB,Ahmed R.Theroleof mTOR in memory CD8+T-cell differentiation[J].Immunol Rev,2010,235(1):234-43.
[17]Waickman AT,JD.P.mTOR,metabolism,and the regulation of T- cell differentiation and function[J].Immunol Rev,2012,249(1):43-58.
[18]Veroux M,Tallarita T,Corona D,et al.Conversion to SirolimusTherapy in Kidney TransplantRecipients with New Onset Diabetes Mellitus after Transplantation[J].Clin Dev Immunol,2013:Published online 2013 May 20,doi:1155/2013/496974.
[19]Stockwell BR,Schreiber SL.TGF-β-signaling with small molecule FKBP12 antagonists that bind myristoylated FKBP12-TGF-β type I receptor fusion proteins[J].Chem Biol,1998,5(7):385-95.
[20]Danielpour D.Functions and regulation of transforming growth factor-beta (TGF-β)in the prostate[J].Eur J Cancer,2005,41(6):846-57.
[21]Falcon BL,BarrS,GokhalePC,etal.Reduced VEGF production,angiogenesis,and vascular regrowth contribute to the antitumor properties of dual mTORC1/mTORC2 inhibitors[J].Cancer Res,2011,71(5):1573-83.
[22]Janes MR,Fruman DA.Targeting TOR dependence in cancer[J].Oncotarget,2010,1(1):69-76.
[23]Carew JS,Kelly KR,Nawrocki ST.Mechanisms of mTOR inhibitor resistance in cancer therapy[J].Target Oncol,2011,6(1):17-27.
[24]Naing A.Overcoming resistance to mTOR inhibition for enhanced strategies in clinical trials[J].Expert Opin Investig Drugs,2013,22(6):679-85.
[25]Tsang CK,Qi H,Liu LF,et al.Targeting mammalian target of rapamycin (mTOR)for health and diseases[J].Drug Discov Today,2007,12(3):112-24.
[26]Moses JW,Leon MB,Popma JJ,et al.Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery[J].N Engl J Med,2003,349(14):1315-23.
[27]Van Rossum HH,Romijn FP,SmitNP,etal.Everolimus and sirolimus antagonize tacrolimus based calcineurin inhibition via competition for FK-binding protein 12[J].Biochem Pharmacol,2009,77(7):1206-12.
[28]Houghton PJ.Everolimus[J].Clin Cancer Res,2010,16(5):1368-72.
[29]Bukowski RM.Temsirolimus:a safety and efficacy review[J].Expert Opin Drug Saf,2012,11(5):861-79.
[30]Colombo N,McMeekin D,Schwartz P,et al.Ridaforolimus as a single agent in advanced endometrial cancer:results of a single-arm,phase 2 trial[J].Br J Cancer,2013,108(5):1021-26.
[31]Demetri GD,Chawla SP,Ray-Coquard I,et al.Results of an International Randomized Phase III Trial ofthe Mammalian TargetofRapamycin Inhibitor RidaforolimusVersusPlacebo to ControlMetastatic Sarcomas in Patients After Benefit From Prior Chemotherapy[J].J Clin Oncol,2013,31(19):2485-92.
[32]GaaliS,Gopalakrishnan R,WangY,etal.The chemical biology of immunophilin ligands[J].Curr Med Chem,2011,18(35):5355-79.
[33]Zaleska MM,Mercado MLT,Chavez J,et al.The developmentofstroke therapeutics:promising mechanisms and translational challenges[J].Neuropharmacology,2009,56(2):329-41.
[34]Gatto GJ,McLoughlin SM,Kelleher NL,et al.Elucidating the substrate specificity and condensation domain activity of FkbP,the FK520 pipecolate-incorporating enzyme[J].Biochemistry,2005,44(16):5993-6002.
[35]Gupta A,Chow M.Pimecrolimus:a review[J].J Eur Acad Dermatol Venereol,2003,17(5):493-503.
[36]Hoetzenecker W,Ecker R,Kopp T,et al.Pimecrolimus leads to an apoptosis-induced depletion of T cells but not Langerhans cells in patients with atopic dermatitis[J].J Allergy Clin Immunol,2005,115(6):1276-83.
[37]StuetzA,GrassbergerM,MeingassnerJG.Pimecrolimus(Elidel,SDZ ASM 981)--preclinical pharmacologic profile and skin selectivity[J].Semin Cutan Med Surg,2001,20(4):233-41.
[38]Salituro GM,Zink DL,Dahl A,et al.Meridamycin:A novel nonimmunosuppressive FKBP12 ligand from streptomyces hygroscopicus[J].Tetrahedron Lett,1995,36(7):997-1000.
[39]Fehr T,Sanglier JJ,Schuler W,et al.Antascomicins A,B,C,D and E novel FKBP12 binding compounds from a Micromonospora strain[J].J Antibiot(Tokyo),1996,49(3):230-33.
[40]BabineRE,VillafrancaJE,GoldBG.FKBP immunophilin patents for neurological disorders[J].Expert Opin Ther Pat,2005,15(5):555-73.
[41]Kupina NC,Detloff MR,Dutta S,et al.Neuroimmunophilin ligand V-10,367 is neuroprotective after 24-hour delayed administration in a mouse model of diffuse traumatic brain injury[J].J Cereb Blood Flow Metab,2002,22(10):1212-21.
[42]Klettner A,Herdegen T.The immunophilin‐ligands FK506 and V-10,367 mediate neuroprotection by the heat shock response[J].Br J Pharmacol,2003,138(5):1004-12.
[43]Tanaka K-i,Fujita N,Ogawa N.Immunosuppressive(FK506)and non-immunosuppressive (GPI1046)immunophilin ligands activate neurotrophic factors in the mouse brain[J].Brain Res,2003,970(1):250-53.
[44]Sauer H,Francis JM,Jiang H,et al.Systemic treatment with GPI 1046 improves spatial memory and reverses cholinergic neuron atrophy in the medial septal nucleus of aged mice[J].Brain Res,1999,842(1):109-18.
[45]NINDS N-P.A randomized clinical trial of coenzyme Q10 and GPI-1485 in early Parkinson disease[J].Neurology,2007,68(1):20-8.
