破壁方式对冠突散囊菌有性繁殖体提取物抑菌活性的影响
2021-09-28李滔滔汪无忌肖晗汕刘石泉胡治远余松林文瑞明
汤 涵, 李滔滔, 汪无忌, 刘 纯, 陈 怡,肖晗汕, 刘石泉, 胡治远, 余松林, 文瑞明
(湖南城市学院 材料与化学工程学院/黑茶金花湖南省重点实验室,湖南 益阳413000)
茯砖茶在自然发花工艺完成后,表面生有金黄色的颗粒,这种颗粒被称为“金花”[1]。“金花”实为冠突散囊菌(Eurotium cristatum)的闭囊壳[2-3],因此冠突散囊菌俗称为金花菌。闭囊壳即子囊果,是冠突散囊菌有性繁殖孢子(子囊孢子)的生成部位,呈球形或近球形,成熟子囊果无规律破裂释放子囊[3],子囊为一层拟薄壁组织包裹8个子囊孢子[4]。子囊孢子双凸镜形,具冠状突起及小疣,表面明显粗糙[5]。冠突散囊菌具有多种功效,包括抗氧化、降脂减肥、抗癌、抑菌等[6-9],其在茯砖茶发花过程中形成生长优势,其他种类的微生物很少存在[10-11],其可能产生不利于杂菌生长的产物[12]。目前,冠突散囊菌抑菌活性研究大都集中在冠突散囊菌发酵液[13],即冠突散囊菌胞外产物的抑菌性能,而冠突散囊菌胞内活性成分抑菌性能的研究较少。成熟子囊果较易破裂释放子囊,子囊孢子孢壁质地坚韧、耐酸碱、极难氧化分解[12],限制了对孢子内有效抑菌成分的准确分析。为了提取冠突散囊菌子囊孢子内的有效抑菌成分,对冠突散囊菌子囊果及子囊孢子进行破壁。
作者以冠突散囊菌子囊果和子囊孢子为研究对象,拟采用超声法、玻璃珠振摇法破碎子囊果,超声法、玻璃珠振摇法、萌发法破壁子囊孢子,获得子囊果提取物及子囊孢子提取物,对比不同破壁方法获得的提取物对金黄色葡萄球菌和大肠杆菌抑制作用的影响,探寻对抑菌活性影响最小且高效的破壁提取方法,为冠突散囊菌天然抑菌物质的开发提供前期研究基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂冠突散囊菌(编号JH1206):黑茶金花湖南省重点实验室提供。
茯砖茶:湖南益阳茶厂股份有限公司提供;琼脂、蔗糖、氯化钠、牛肉膏和蛋白胨:国药化学试剂有限公司产品;土豆:购于菜市场。
1.1.2 主要仪器设备JY96-IIN超声波细胞破碎仪:上海沪析实业有限公司产品;BLD-210倒置显微镜:北京世纪科信科学仪器有限公司产品;HH-2数显恒温水浴锅:浙江力辰仪器科技有限公司产品;RE-2000A旋转蒸发仪:上海亚荣生化仪器厂制造;TS-100C恒温振荡器:上海天呈实验仪器制造有限公司产品;DT5-2B低速离心机:北京时代北利离心机有限公司产品;101-2AB电热鼓风干燥箱:天津市泰斯特仪器有限公司产品;SW-CJ-1FD洁净工作台:上海博讯仪器有限公司产品;YXQ-100G立式压力蒸汽灭菌器:上海东亚压力容器制造有限公司产品;AUW220电子天平:日本岛津公司产品。
1.2 方法
1.2.1 冠突散囊菌子囊果的破碎
1)冠突散囊菌子囊果的获取 选择作者所在实验室自制的茶叶(表面冠突散囊菌生长茂盛的冠突散囊菌散茶),过100目网筛分离冠突散囊菌子囊果,将分离的子囊果收集到干净的玻璃储罐中置于室温备用。
2)超声法破碎冠突散囊菌子囊果 称取2 g子囊果置于烧杯中,加30 mL蒸馏水混匀,置于超声波细胞破碎仪中破碎,设置时间20 min,调整功率分别为360、720、1 080、1 440、1 800 W。
3)玻璃珠振摇法破碎冠突散囊菌子囊果 称取2 g子囊果装入组织培养瓶中,加30 mL蒸馏水混匀,加玻璃珠若干(玻璃珠直径为2 mm,铺满瓶底),然后放入180 r/min的摇床中振摇60 min。
1.2.2 冠突散囊菌子囊孢子的破壁
1)冠突散囊菌子囊孢子的获取 称取适量子囊果于组织培养瓶中,加30 mL蒸馏水,加玻璃珠若干(玻璃珠铺满瓶底),然后放入180 r/min的摇床中振摇60 min。将破碎后的子囊果用10层纱布过滤两遍,取滤渣,将子囊孢子细胞浓度调节为107个/mL。
2)超声法破壁冠突散囊菌子囊孢子 取30 mL子囊孢子悬液,在超声时间20 min条件下,调节功率分别为360、720、1 080、1 440、1 800 W。在超声功率1 800 W条件下,调节超声时间分别为10、20、30、40、50 min。
3)玻璃珠振摇法破壁冠突散囊菌子囊孢子 根据文献[14],取30 mL子囊孢子悬液于组织培养瓶中(玻璃珠铺满瓶底),置于-18℃冰箱冷冻1 d。将冷冻好的子囊孢子立即于60℃水浴锅中分别水浴加热1.0、1.5、2.0、2.5、3.0 h,再放入180 r/min的摇床中分别振摇2、4、6、8、10 h。
4)萌发法破壁冠突散囊菌子囊孢子 取30 mL子囊孢子悬液于组织培养瓶中,放入30℃、120 r/min的摇床中振摇培养48 h。
1.2.3 冠突散囊菌子囊孢子破壁率的测定及计算

式中:W为子囊孢子破壁率,%;N1为子囊孢子总数,个;N2为未破壁子囊孢子总数,个[15]。
1.2.4 冠突散囊菌子囊果和子囊孢子提取物抑菌活性的检测在40℃条件下,将子囊果或子囊孢子提取物放置于真空干燥箱烘干,再添加适量的水,溶解固体物质,使其质量溶度为200 mg/mL。在无菌操作条件下,滴入0.2 mL提取液于灭菌后的滤纸片上,等待其充分吸收并晾干。用蒸馏水将金黄色葡萄球菌和大肠杆菌菌液配制成OD值为0.4的菌悬液,分别取0.3 mL均匀涂布于已制好的牛肉膏蛋白胨固体培养基中。将准备好的滤纸片贴于含菌平板中,每个处理设3个重复,于37℃培养24 h后测定抑菌圈大小。
2 结果与分析
2.1 冠突散囊菌子囊果破碎方法对其抑菌活性的影响
2.1.1 超声法破碎冠突散囊菌子囊果结果由图1可知,破碎前的子囊果呈球形或近球形,因不透光而呈现黑褐色;经过超声处理,具有规则形状的子囊果消失,伴随出现大量絮状物。超声功率为360 W时子囊果基本完全破碎,随着超声功率的增加,子囊果破碎程度增加,聚集的絮状物体积减小,周围密集地分散着释放出的子囊孢子。
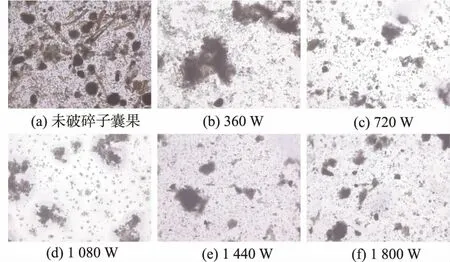
图1 400倍光学显微镜下不同超声功率破碎后的子囊果Fig.1 Microscope(400×)photo of ascocarps broken under different ultrasonic power condition
为探究超声法破碎子囊果对其抑菌活性的影响,以金黄色葡萄球菌和大肠杆菌为指示菌,采用1.2.4中方法检测超声破碎后子囊果内含物的抑菌效果,结果为:采用超声法破碎冠突散囊菌子囊果的提取物对大肠杆菌无明显的抑制作用;超声功率在1 440 W以下时,子囊果提取物对金黄色葡萄球菌无抑制作用,当超声功率增加至1 800 W,提取物表现出抑制作用,其抑菌圈半径为1.0 mm。
2.1.2 玻璃珠振摇法破碎冠突散囊菌子囊果结果通过400倍光学显微镜观察玻璃珠振摇法破碎的子囊果,结果见图2。冠突散囊菌子囊果在有玻璃珠的情况下,振摇60 min后,即可完全破碎,破碎后的子囊果外壁破裂,释放出里面的子囊孢子以及内容物。子囊果破碎后出现很多聚集在一起的絮状物,为破碎的子囊果外壁及子囊拟薄壁组织,此结果和超声法破碎子囊果结果一致。

图2 400倍光学显微镜下玻璃珠振摇法处理的子囊果Fig.2 Microscope (400×)photo of ascocarps disrupted using glass bead-beating method
为探究玻璃珠振摇法破碎子囊果对其抑菌活性的影响,将破碎后的子囊果于4 000 r/min离心20 min,取上清液将质量浓度定至200 mg/mL,以金黄色葡萄球菌和大肠杆菌为指示菌,采用1.2.4的方法进行抑菌活性检测,检测结果如图3所示。由图3可知,玻璃珠振摇法处理后的子囊果提取物对大肠杆菌和金黄色葡萄球菌均有较强的抑制作用,抑菌圈半径分别为5.8 mm和12.6 mm。对比超声法,玻璃珠振摇法破碎子囊果后的提取物对金黄色葡萄球菌和大肠杆菌的抑制作用更强,这说明玻璃珠振摇法能更好地保留冠突散囊菌子囊果中的抑菌物质。超声法处理子囊果后,其提取物对大肠杆菌和金黄色葡萄球菌的抑制作用减弱,甚至消失,这说明超声波对提取物中的抑菌物质有破坏作用。因此,玻璃珠振摇法比超声法更合适于提取冠突散囊菌子囊果中的抑菌物质。
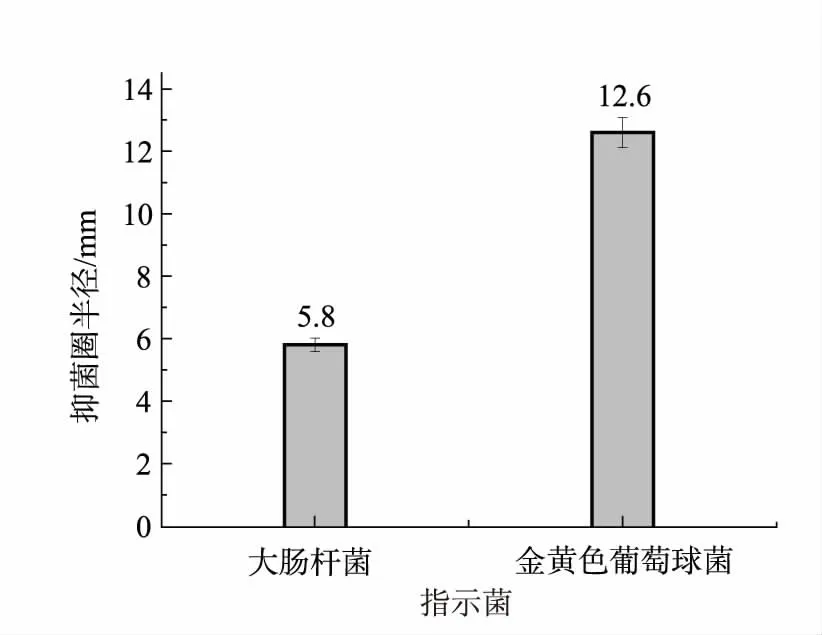
图3 玻璃珠振摇法破碎子囊果所得提取物的抑菌作用Fig.3 Antibacterial activities of ascocarps extract obtained using glass bead-beating method
2.2 冠突散囊菌子囊孢子破壁方法对其抑菌活性的影响
2.2.1 超声法破壁冠突散囊菌子囊孢子结果在设置的条件下用超声法处理子囊孢子,破壁率见图4。在超声时间20 min条件下,随着超声功率的增加,子囊孢子的破壁率增加,最高为43.8%;固定超声功率为1 800 W,增加超声时间,子囊孢子的破壁率可进一步提高,最高可达到67.5%。

图4 超声条件对子囊孢子破壁率的影响Fig.4 Effect of ultrasonic condition on ascospores breakage rate
为探究超声法破壁子囊孢子对其抑菌活性的影响,将超声功率为1 800 W、时间50 min破壁后的子囊孢子提取物浓缩至200 mg/mL,采用1.2.4的方法检测提取物对大肠杆菌和金黄色葡萄球菌的抑菌活性,结果见图5。由图可知,提取物对金黄色葡萄球菌无明显的抑菌作用,对大肠杆菌有微弱的抑菌作用。这说明超声法虽然能破壁冠突散囊菌子囊孢子,但子囊孢子提取物丧失了抑菌活性,因此超声法不适合于提取冠突散囊菌有性繁殖体中子囊孢子的抑菌活性物质。
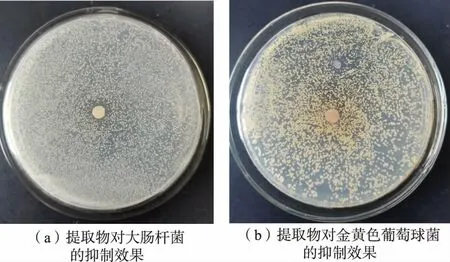
图5 超声功率为1 800 W、时间50 min处理的子囊孢子提取物对指示菌的抑菌效果Fig.5 Bacteriostasis results of ascospore extracts against the tested bacteria obtained with ultrasonication under 1 800 W for 50 min
2.2.2 玻璃珠振摇法破壁冠突散囊菌子囊孢子结果从子囊果中释放的孢子,呈现规整、丰满的球形,经过纱布过滤后可去除大部分菌丝和破碎的子囊果壁,如图6(a)所示。破壁后的子囊孢子样本中丰满、规整的球形状态的子囊孢子明显减少,同时出现类似子囊果破壁后聚集在一起的絮状物质(见图6(b))。每隔2 h取样测子囊孢子的细胞浓度,得到不同水浴加热时间、不同振摇时间子囊孢子破壁率,结果见表1。在振摇时间较短(2~4 h)的条件下,60℃水浴加热时间对冠突散囊菌子囊孢子破壁率影响较大,其中水浴加热时间为1.5 h最好,振摇2 h后子囊孢子的破壁率即可达到81.8%;随着振摇时间的延长,60℃水浴加热时间的影响逐渐降低。水浴加热时间较短(1.0~1.5 h)的条件下,子囊孢子的破壁率能在较短的时间(2 h)内达到80%以上;随着振摇时间的延长,子囊孢子的破壁率还可进一步提高,最高可达94.8%。子囊孢子的最佳破壁条件为水浴加热时间1.5 h、振摇10 h。

图6 400倍光学显微镜下玻璃珠振摇法处理的子囊孢子Fig.6 Microscope(400×)photo of ascospores disrupted using glass bead-beating method

表1 不同水浴加热时间、振摇时间对子囊孢子破壁率的影响Table 1 Effect of different heating time of water bath and shaking time on the breakage rate of ascospores
为了探讨玻璃珠振摇法处理的子囊孢子抑菌性能,将60℃水浴加热1.5 h后再恒温振摇10 h的样本,离心取上清液,将上清液浓缩至200 mg/mL,采用1.2.4的方法检测其抑菌活性,结果见图7。提取物对金黄色葡萄球菌和大肠杆菌均有抑制作用,其抑菌圈半径分别为2.3、2.4 mm。

图7 冠突散囊菌子囊孢子提取物对指示菌的抑制作用Fig.7 Antibacterial activities of ascospore extracts obtained using glass bead-beating method
2.2.3 萌发法破壁冠突散囊菌子囊孢子结果取30 mL子囊孢子悬液于组织培养瓶中,放于30℃、120 r/min的摇床中振摇培养48 h。每隔3 h取样测定子囊孢子的细胞浓度,得到不同萌发时间子囊孢子破壁率,如图8所示。萌发法对冠突散囊菌子囊孢子的破壁率在40%~60%,萌发时间的延长可增加子囊孢子的破壁率,但萌发法的破壁率低于玻璃珠振摇法。采用1.2.4中的方法检测其提取物的抑菌活性,提取物对大肠杆菌和金黄色葡萄球菌均无明显的抑制作用,可能是因为冠突散囊菌孢子在萌发过程中,需消耗部分营养物质,而这些被消耗的物质具有抑菌活性。因此,萌发法不适合于提取冠突散囊菌有性繁殖体中的子囊孢子抑菌物质。
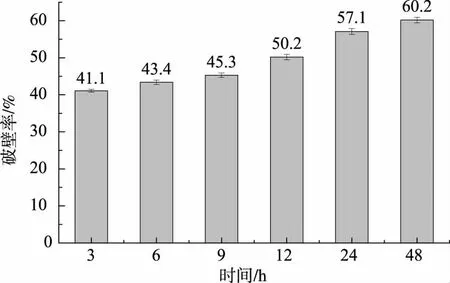
图8 萌发法破壁子囊孢子的结果Fig.8 Results of ascospores disrupted using germination method
3 结语
作者采用超声法、玻璃珠振摇法和萌发法处理冠突散囊菌有性繁殖体,探讨不同破壁方法处理冠突散囊菌有性繁殖体所得提取物的抑菌活性。结果表明:冠突散囊菌子囊果较易破碎,其提取物对大肠杆菌和金黄色葡萄球菌有较强的抑制作用,最大抑菌圈半径分别为5.8 mm和12.6 mm;超声法破碎冠突散囊菌子囊果后,其抑菌性能有所下降,可能是超声对抑菌物质有破坏作用。子囊果提取物经过60℃处理1 h后,其对金黄色葡萄球菌和大肠杆菌的抑菌圈降低至一半[6],而超声处理过程会伴随温度的上升,这说明超声法附带的升温现象将破坏子囊果中的抑菌物质。因此,玻璃珠振摇法比超声法更适合于提取冠突散囊菌子囊果中的抑菌物质。
子囊孢子比子囊果更难破碎,在相同的超声条件下(功率360 W,时间20 min),子囊果可以完全破碎,而子囊孢子的破碎率只有32%。为提高玻璃珠振摇法对子囊孢子的破壁率,在玻璃珠振摇法处理之前,增加一个骤变的温差处理过程,通过这种温差处理,增加子囊孢子壁的脆性,从而提高破壁率[14]。增加温差处理后,玻璃珠振摇法对子囊孢子的破壁率最大,最高可达到94.8%,其次是超声法,子囊孢子的破壁率可达到67.5%,萌发法对子囊孢子的破壁率在40%~60%。3种破壁子囊孢子的方法中,只有温差条件下的玻璃珠振摇法处理子囊孢子后,所得提取物有抑菌活性(金黄色葡萄球菌和大肠杆菌的抑菌圈半径分别为2.3、2.4 mm),此外玻璃珠振摇法还具有操作简便、高效等优点。因此,玻璃珠振摇法是提取冠突散囊菌有性繁殖体中抑菌物质的首选方法,具有一定的开发价值。
3种方法中,玻璃珠振摇法对子囊果和子囊孢子的破壁率最高,其提取物的抑菌活性最好。玻璃珠振摇法提取的子囊孢子提取物,对大肠杆菌和金黄色葡萄球菌的抑菌圈半径分别为2.4、2.3 mm;提取的子囊果提取物,对大肠杆菌和金黄色葡萄球菌的抑菌圈半径分别为5.8 mm和12.6 mm。子囊果提取物60℃处理1 h后,其金黄色葡萄球菌和大肠杆菌的抑菌圈降低至一半[6],这说明高温处理能降低子囊果中物质的抑菌物质活性。造成子囊果提取物抑菌活性强于子囊孢子提取物抑菌活性的原因,可能是由于玻璃珠振摇法处理子囊孢子之前经过60℃处理1.5 h,破坏了其中部分抑菌活性物质。
