绿色荧光蛋白转基因小鼠不同源性间充质干细胞原代培养及生物学特性比较*
2014-11-08黄益民许秀芳张兆光
辛 毅, 李 娜, 张 颖, 黄益民, 刘 飒, 许秀芳, 张兆光
绿色荧光蛋白(green fluorescent protein,GFP)转基因小鼠是将来源于维多利亚多管水母(Aequorea victoria)的发光蛋白通过转基因技术敲入C57小鼠基因序列中获得的组织细胞发出绿色荧光的小鼠,其细胞自发荧光的特点为干细胞示踪提供了良好的动物来源[1-2]。目前对GFP转基因小鼠脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)的纯化培养未见报道,而骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的分离培养报道也较少。MSCs具有多向分化潜能,在体外适当的诱导条件下可以分化为骨、脂肪、内皮、软骨、肌肉和神经等多种组织细胞,体外培养不丢失其多向分化潜能,GFP小鼠作为良好的示踪工具提供了一个很好的细胞来源[3]。本实验拟通过酶消化法培养UCMSCs与密度梯度离心法分离BMSCs,在生物学特性、表面标志及多向分化潜能等方面进行比较,为干细胞示踪提供了良好的细胞来源及技术方法。
材料和方法
1 动物
孕晚期健康GFP转基因小鼠,体质量50~55 g,由北京大学医学部实验动物中心提供,北京市心肺血管疾病研究所实验动物中心繁殖。
2 主要试剂
DMEM/F12培养基、胎牛血清(fetal bovine serum,FBS)、青霉素和链霉素均为Gibco产品。Ⅱ型胶原酶和胰蛋白酶均为Sigma产品。MTT为Promega产品。成骨和成脂诱导试剂盒(Mesenchymal Adipogenesis Kit和Mesenchymal Stem Cell Osteogenesis Kit)为Millipore产品。小鼠淋巴细胞分离液为国产试剂。流式抗体 PE-CD90、PE-CD105、PE-CD44、PE-CD45、PE-CD79a、PE-CD19 和 PE-CD14 为 BD 产品;细胞培养板、离心管和培养皿等均为Corning产品。4000B型荧光倒置显微镜为Leica产品。CO2细胞培养箱(Thermo Electron产品)。酶标检测仪(Beckman产品)。超净工作台购自北京昌平长城净化空气仪器厂,TGL-16C离心机购自上海安亭科学仪器厂。
3 方法
3.1 取材 用0.3%戊巴比妥钠腹腔注射麻醉孕鼠,75%乙醇消毒腹部,将子宫取出并分离胚胎,剪取脐带组织,置含双抗预冷0.01 mmol/L PBS的培养皿中清洗3次,去除血污抗菌,将脐带用眼科剪剪碎成约1 mm×1 mm×1 mm组织块,放入50 mL离心管中备用;再用消毒的手术器械无菌分离四肢长骨,去除骨膜及残留肌肉,剪去长骨两端,暴露髓腔后放入100 mm培养皿中备用。
3.2 Ⅱ型胶原酶消化分离UCMSCs 将脐带组织碎块放入50 mL离心管,再加入2 g/LⅡ型胶原酶,体积为组织的15~20倍为宜。37℃、100 r/min水浴摇床消化60~90 min,吸管轻轻吹打组织块1~2 min,当脐带组织块由白色呈半透明状态时,用10%FBS DMEM/F12终止消化,收获细胞;在其余未完全消化的组织块中再次加入消化液,是上一次消化液总体积的1/2,消化时间为60 min,余步骤同前;重复消化2~3次,所有的细胞悬液均过200目铜网纯化。细胞悬液1 000 r/min离心5 min,弃上清,细胞沉淀中加含10%FBS的DMEM/F12培养基2 mL,将细胞接种于T25培养瓶,再补充3 mL含10%FBS的DMEM/F12培养基,置体积分数5%CO2、37℃培养箱中继续培养,每隔2 d换液1次。
3.3 密度梯度离心法分离BMSCs 用注射器吸取DMEM/F12培养基反复冲洗骨髓腔,收集冲洗液,1 200 r/min离心10 min,弃上清。用含10%FBS的DMEM/F12培养基吹打重悬细胞,制成单细胞悬液,缓缓加入到15 mL装有小鼠淋巴细胞分离液离心管中,使细胞悬液位于分离液之上,2 500 r/min离心20 min后取出离心管,管中液体分为4层,从上至下为培养基层、单个核细胞层、分离液层及沉淀的红细胞,用无菌吸头吸取单个核细胞层置于新的离心管,加入 DMEM/F12培养基重悬,1 200 r/min离心10 min,弃上清。计数后以1×1010/L密度接种于25 cm2培养瓶,标记为P0,置于体积分数5%CO2、37℃饱和湿度培养箱内培养。24 h后全量换液,以后每2~3 d换液,弃去未贴壁细胞以达到纯化的目的。
3.4 UCMSCs及BMSCs生长曲线的测定 分别取2种原代细胞,按2×107/L接种于24孔培养板,每孔接种1 mL。从接种时间算起,每隔24 h计数5孔内的细胞密度,算出平均值,共计7 d。以培养时间(d)为横坐标、细胞数为纵坐标绘制生长曲线。
3.5 MST法测定UCMSCs及BMSCs增殖 分别取2种原代细胞,以每孔约2×104个细胞等量接种于96孔板中,每孔加入100 μL培养液,置体积分数5%CO2、37℃细胞培养箱内孵育。每隔1 d向其中5孔加入5 g/L MTT溶液20 μL,孵育4 h后,用酶标仪在490 nm波长处测定各孔的吸光度 (A490),每天测5孔,连续测7 d。设立平行对照孔调零。
3.6 UCMSCs及BMSCs传代及纯化 细胞生长成致密单层后,用2.5 g/L胰蛋白酶消化,待大部分细胞变圆时,加含100 mL/L FBS的DMEM/F12完全培养液终止消化,反复轻轻吹打,1∶3传代;依次标记为P1、P2 和 P3。
3.7 UCMSCs及BMSCs周期的测定 分别取P3达到80% ~90%融合细胞,消化、洗涤并计数2×108/L,700 mL/L冰乙醇固定24 h后,PBS洗涤2次,加 200 μL RNase A(1 g/L),37 ℃水浴 30 min,再加 PI染色液(50 mg/L)避光反应 30 min,BD FACS Calibur流式细胞仪检测,Multicycle软件分析。
3.8 UCMSCs及BMSCs流式细胞术分析 分别取P3细胞,胰蛋白酶消化成单细胞悬液,PBS洗涤2次,分别加入标志物 PE-CD90、PE-CD105、PE-CD44、PE-CD45、PE-CD14、PE-CD79a和 PE-CD19 流式抗体,同时做同型对照,4℃孵育30 min,PBS洗去未标记的抗体,20 g/L多聚甲醛固定后流式细胞术检测。
3.9 UCMSCs及BMSCs诱导分化潜能的检测
3.9.1 UCMSCs及BMSCs成脂的诱导 分别取P3细胞,以2×105个接种于6孔板,体外向脂肪细胞诱导分化:含10%FBS的DMEM/F12培养基培养至100%融合,换为成脂分化诱导液(10%FBS的DMEM/F12,10 mg/L 胰岛素,1 μmol/L 地塞米松,0.5 mmol/L 1-甲基-3-异丁基黄嘌呤,100 μmol/L 吲哚美辛,1×105U/L青霉素,100 mg/L链霉素),连续诱导30 d后,PBS洗2次,油红O染液染色30 min,蒸馏水冲洗至背景干净,苏木素复染10 min,自来水冲洗3次,在显微镜下取图,并统计油红O染色的阳性细胞。阴性对照组用含10%FBS的DMEM/F12培养基培养,每3~4 d换1次液,连续诱导30 d后,后续处理与诱导组同时进行并观察统计细胞数。
3.9.2 UCMSCs及BMSCs成骨的诱导 分别取 P3细胞,以2×105个接种于6孔板,体外向成骨细胞诱导分化:含10%FBS的DMEM/F12培养基培养至80%融合,弃培养液,PBS洗2次,换成成骨分化诱导液(含体积分数10%胎牛血清,100 nmol/L地塞米松,10 mmol/L β-甘油磷酸钠,0.2 mmol/L 抗坏血酸,1×105U/L青霉素,100 mg/L链霉素),连续诱导14 d,在显微镜下观察可见细胞不透明区域时,PBS洗2次,700 mL/L冰乙醇固定1 h,PBS洗2次,用茜素红染料1 mL滴加于每孔中,染色20 min后,用PBS洗2次,在倒置显微镜下观察,并统计阳性细胞数。阴性对照组用含10%FBS的DMEM/F12培养基培养,每3~4 d换1次液,连续培养14 d后,后续染色步骤与诱导组相同并观察统计细胞数。
4 统计学处理
应用SPSS 11.0统计软件分析,计量资料以均数±标准差(mean±SD)表示,组间均数比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 酶消化法分离培养UCMSCs
用Ⅱ型胶原酶消化脐带组织块,可以得到较多的单个游离细胞,接种到培养皿里,24 h后可贴壁,1 d后形状由圆形逐渐变成长梭形,见图1A;2 d后细胞已开始生长,向四周伸展,呈旋涡状生长,见图1B;4 d后贴壁的细胞由中心向周围不断生长,细胞排列成复层,细胞生长形状变得不规则,相互之间紧密相连,铺满平皿底部就可传代,见图1C。
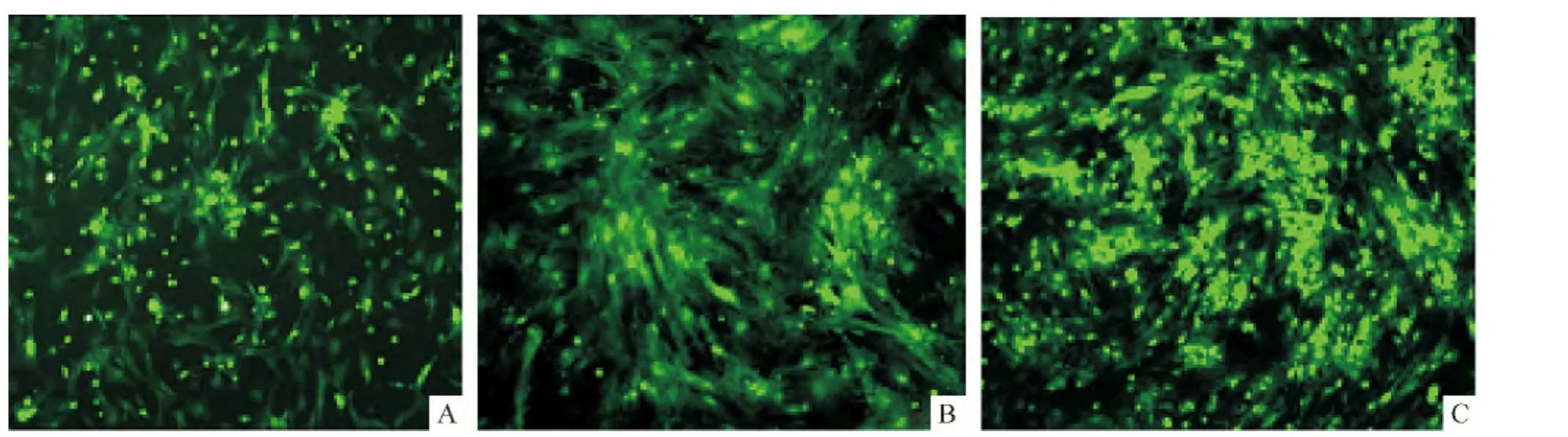
Figure 1.Primary culture of UCMSCs by enzyme digestion method(×100).A:1 d;B:2 d;C:4 d.图1 酶消化法原代培养的UCMSCs
2 密度梯度离心法分离BMSCs
用密度梯度离心法分离BMSCs,可以得到较多的单个游离细胞,接种到培养皿里,24 h后可贴壁,细胞两端伸出突起,见图2A,细胞射光性较强;2 d后形状由长椭圆形逐渐变成短梭形,由中心向四周不断生长,见图2B,呈克隆样生长;4 d后细胞大量生长,呈集聚性长梭形伸展的细胞,排列成单层,细胞生长形状变得规则,相互之间紧密相连,铺满平皿底部就可传代,见图2C。

Figure 2.Primary culture of BMSCs by density gradient separation method(×100).A:1 d;B:2 d;C:4 d.图2 密度梯度分离法原代培养的BMSCs
3 原代培养UCMSCs及BMSCs生长曲线
比较连续7 d测定的生长曲线显示:原代培养的UCMSCs接种0~1 d后,细胞数明显增加,比BMSCs数目增多,差异显著(P<0.05);2~5 d为对数生长期,细胞数在此段时间内达到高峰,比BMSCs数目增多,差异显著(P<0.01);5 d后细胞数量减少,但细胞数仍比BMSCs略多,差异显著(P<0.01);细胞呈现“潜伏期-对数生长期-平台期”的生长模式,细胞生长曲线近似“S”形;原代培养的BMSCs接种0~4 d后,细胞数缓慢增加,5~7 d后细胞数也有增加趋势,细胞生长曲线平缓,未显示出“S”形特征,见图3。
4 原代培养UCMSCs及BMSCs MTT测定结果
原代培养UCMSCs增殖能力测定,连续7 d测定A490值。UCMSCs生长前2 d与第3天比较有显著差异(P<0.05),提示增殖能力较弱;3~5 d变化较为显著,提示此段时间内细胞增殖较快,可进行传代;原代培养BMSCs增殖能力的测定,接种细胞后1~4 d,细胞数目无明显变化(P>0.05),提示此阶段增殖能力较弱,5~7 d细胞数目变化较明显,前4 d与第5~7天比较有统计学意义(P<0.05),提示此段时间内细胞增殖较快,7 d后可进行传代。原代培养UCMSCs与BMSCs增殖能力相比较有显著差异(P<0.05),见表1。
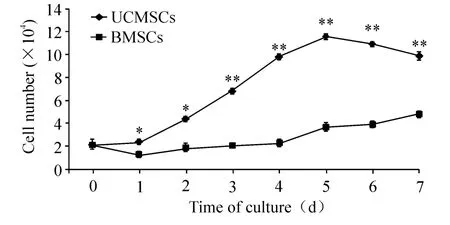
Figure 3.The growth curves of primarily cultured UCMSCs and BMSCs.Mean ± SD.n=5.*P < 0.05,**P < 0.01 vs BMSCs.图3 原代培养UCMSCs及BMSCs生长曲线

表1 原代培养UCMSCs及BMSCs细胞活力测定Table 1.Viability of primary culture of UCMSCs and BMSCs(Mean±SD.n=5)
5U CMSCs及BMSCs传代及纯化特点
2种方法培养的细胞长至70%~80%即可传代,2.5 g/L胰蛋白酶消化后,细胞呈单个,亮而圆,1 d后,细胞贴壁,单层生长,呈散在的长梭形,3d后细胞呈密集单层生长,有细胞集落出现,融合率达80%左右,可形成致密的单层;细胞体外培养时,从细胞开始生长3~5 d传代1次。UCMSCs与BMSCs计数统计,即细胞的成活率约为97%,表明培养的细胞消化传代成活率高,见图4。2种细胞差异无统计学意义(P >0.05)。
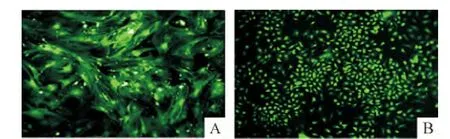
Figure 4.Morphologic changes of UCMSCs(A)and BMSCs(B)in the third passage(fluorescence microscope,×100).图4P3 UCMSCs及BMSCs形态特征
6U CMSCs及BMSCs周期分析
流式细胞术分别检测P3 UCMSCs和BMSCs的G0/G1和S+G2/M百分率,结果显示,UCMSCs G0/G1期细胞占85.95%,显著高于S期与G2/M期细胞之和,见图5A;BMSCs G0/G1期细胞占87.92%,显著高于S期与G2/M期细胞之和,见图5B。2种细胞差异无统计学意义(P>0.05)。
7 UCMSCs及BMSCs免疫表型流式细胞术检测结果
P3 UCMSCs PE-CD44、PE-CD105和 PE-CD90阳性表达率为(65.40 ±1.43)%、(58.90 ±1.67)%和(64.50 ±1.96)%,而 PE-CD79a、PE-CD19、PE-CD14和PE-CD45表达率低,阳性率分别为(12.70±0.45)%、(39.40 ± 0.34)%、(3.40 ± 0.54)%、(31.50 ±0.26)%,见图 6A;P3 BMSCs PE-CD44、PE-CD105和PE-CD90高表达,为(55.30±1.29)%、(61.90 ± 1.76)% 和(57.90 ± 1.96)%,而 PECD79a、PE-CD19、PE-CD14 和 PE-CD45表达率低,分别为(10.90% ±0.64)%、(27.70 ±2.19)% 、(20.60±0.84)%和(25.90±0.84)%,见图6B;2种细胞差异无统计学意义(P>0.05)。
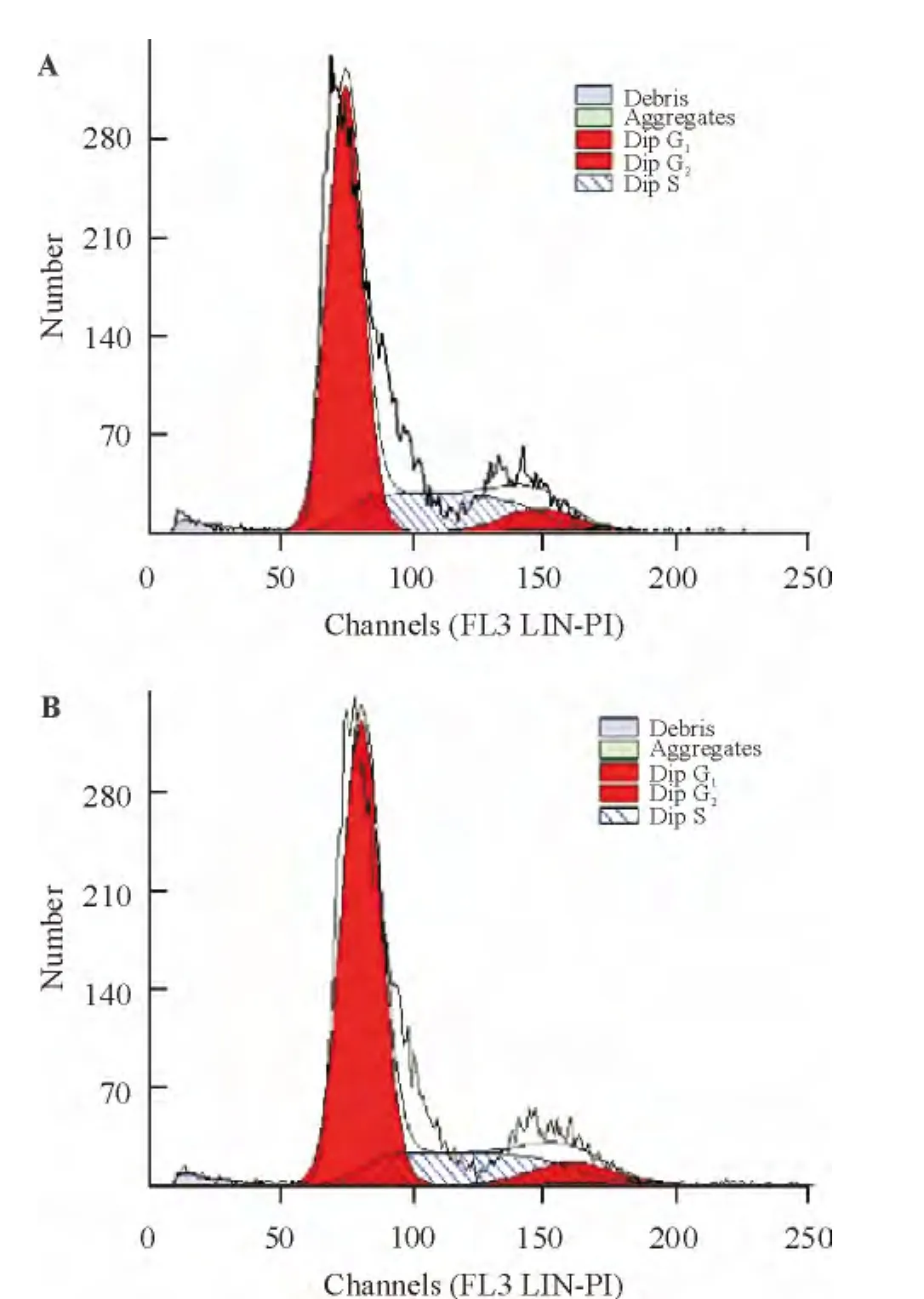
Figure 5.Cell cycle analysis of UCMSCs(A)and BMSCs(B)in third passages.图5P3代UCMSCs及BMSCs DNA周期分析
8U CMSCs及BMSCs成脂细胞诱导
P3 UCMSCs和BMSCs分别成脂诱导20 d左右,细胞形态逐渐由长梭形变为短梭形,随着诱导时间的延长,高倍镜下可见细胞变为椭圆形或圆形,细胞质内有颗粒样物质,胞质较多,核较大,空泡,提示脂滴开始形成。随着诱导时间延长,胞质内的脂滴增多。诱导后的细胞经油红O染色,可见胞质中有大量被染成红色的脂滴,UCMSCs油红O染色呈阳性,阳性率为(94.6±3.8)%,见图 7A;BMSCs阳性率为(30.5±2.6)%,见图7B。2种细胞的阳性率有显著差异(P<0.05)。对照组 P3 UCMSCs和 BMSCs用基础培养基培养20 d后,在显微镜下观察未见细胞形态学变化,油红O染色均未见胞质中红色的脂滴,即油红O染色阴性,见图7C、D。
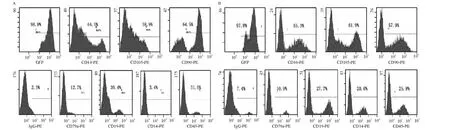
Figure 6.Flow cytometry analytic results of cellular surface antigens of UCMSCs(A)and BMSCs(B)in the third passage.图6 P3 UCMSCs及BMSCs细胞免疫表型分析
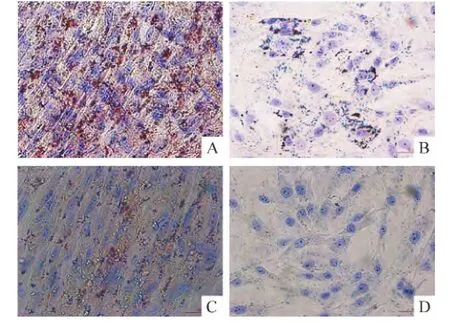
Figure 7.Adipogenic differentiation of UCMSCs and BMSCs in the third passage(Oil red O staining,× 400).A:UCMSCs(induction group);B:BMSCs(induction group);C:UCMSCs(control group);D:BMSCs(control group).图7 P3 UCMSCs及BMSCs成脂细胞诱导分化结果
9U CMSCs及BMSCs成骨细胞诱导
P3 UCMSCs及BMSCs分别成骨诱导15 d左右,细胞形态逐渐由长梭形变为鳞片形、三角形或多角形等,细胞外基质分泌增多,中央可见类似结节状的结构,部分细胞呈现层叠状生长,茜红素染色后可见细胞密集处有红色的沉着物,呈团状并向四周放射状排列,中心颜色明显加深。UCMSCs茜红素染色阳性率达(92.5±5.1)%,见图 8A;BMSCs阳性率为(35.5±3.4)%,见图8B。2种细胞的阳性率有显著差异(P<0.05)。对照组 P3 UCMSCs和 BMSCs用基础培养基培养15 d后,在显微镜下观察未见细胞形态学变化,茜素红染色均未见红色的结节状细胞团,即茜素红染色阴性,见图8C、D。
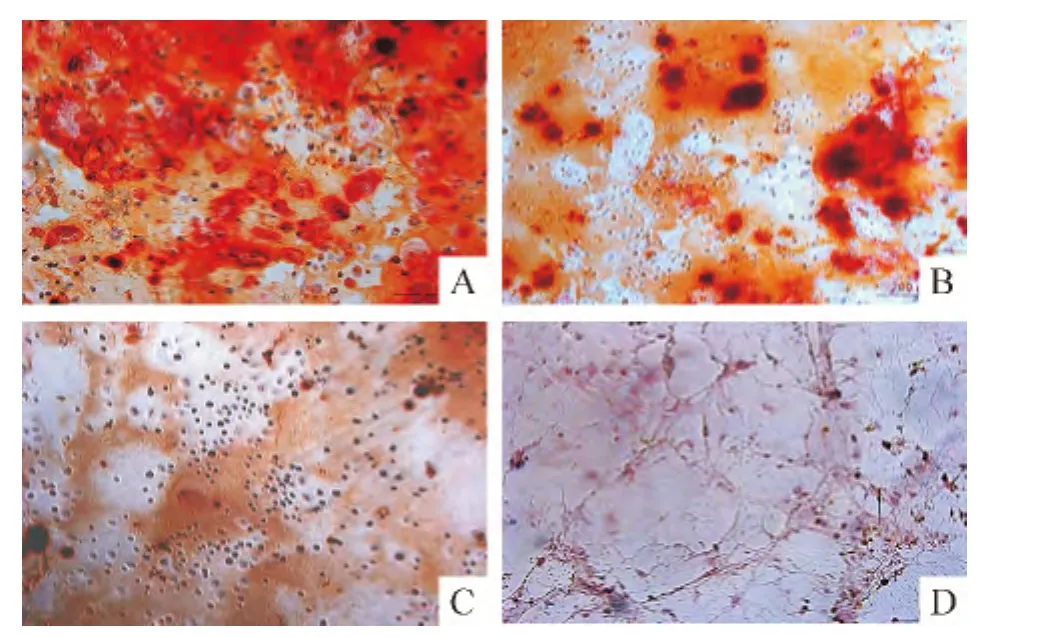
Figure 8.Osteogenic differentiation of UCMSCs and BMSCs in the third passage(Alizarin red staining,×100).A:UCMSCs(induction group);B:BMSCs(induction group);C:UCMSCs(control group);D:BMSCs(control group).图8 P3 UCMSCs和BMSCs成骨细胞诱导分化结果
讨 论
荧光蛋白标记技术是近年来高速发展的一种细胞标记技术,采用基因嵌合的方式将荧光蛋白基因嵌合入待标记的细胞。GFP基因是研究活细胞中基因表达和定位的新型报告基因,被广泛应用于移植干细胞的体内示踪,但其细胞标记的时效性极不稳定,荧光容易淬灭[4]。而荧光蛋白转基因动物则不存在标记不稳定的缺陷,细胞体外扩增传代和体内分化均不会引起荧光强度减弱或淬灭,可以提供荧光稳定、获取简便的示踪细胞[5-6]。
目前国内对于BMSCs分离纯化和培养的研究中,采用GFP转基因小鼠进行研究的比较少,在GFP小鼠脐带中分离MSCs进行体外培养的技术方法未见报道。有研究表明,脐带中富含干细胞,远远高于骨髓中的含量,脐带间充质干细胞有望取代骨髓间充质干细胞成为组织工程中更为理想的种子细胞[7]。本研究利用GFP转基因小鼠作为细胞供体,采用酶消化法消化脐带组织的方式获得数量充足的UCMSCs,且操作简单易行,可更好地保持细胞活力,细胞呈长梭形旋涡状生长且增殖能力较强,3 d后即可传代,细胞在短期内增殖迅速,缩短了原代培养时间。BMSCs可以通过贴壁细胞分离法、密度梯度离心法、流式细胞仪分选法和免疫磁珠分离法进行分离[8],本研究利用密度梯度离心法分离BMSCs,操作较复杂,能够获取较均一的单个核细胞但细胞数量较少,细胞贴壁慢,呈成纤维状克隆样生长,原代培养7 d后才能传代,传代培养时间较长。脐带MSCs与骨髓MSCs相比较,分离细胞操作简单且数量多;原代培养细胞贴壁时间快,所用时间短,短期内迅速增殖,脐带源MSCs可为后续实验提供充足的细胞。
为了更加深入地比较2种源性干细胞的生长增殖特性,本研究采用生长曲线法、MTT法和DNA周期检测细胞生物学特性,其结果显示:原代培养的UCMSCs在3~5 d生长迅速,即可传代;BMSCs于8 d后迅速增殖且可以传代,细胞增殖生长曲线与MTT结果相一致。UCMSCs与BMSCs比较,UCMSCs原代培养所需时间较短,在短期内可获得数量较多的细胞,为基础研究提供充足的靶细胞。通过对第3代UCMSCs、BMSCs经DNA周期检测法分析,其结果显示,85%的细胞处于G0/G1期,只有接近15%的细胞处于 S+G2/M期,符合干细胞生长特性[9]。从DNA周期结果可以得出,2种源性的MSCs传代后增殖潜力基本一致,具有典型干细胞增殖特点,将对深入了解细胞的生长发育有重要意义。
目前尚未明确MSCs的特异性抗原标志,不同的实验室分离和扩增MSCs的条件差异很大,通常以细胞形态、流式细胞术检测结果和多向分化潜能作为判断标准[10],对细胞的分子免疫表型、分化潜能及功能的鉴定亦有不同,有一些比较公认的表面分子标志,包括 CD29、CD73、CD90、CD105、CD44 等,同时不表达造血干细胞的表面标志,包括 CD14、CD45、CD11b、CD34 等[11],本研究对第 3 代 UCMSCs及BMSCs经流式细胞术检测高表达间充质细胞标志CD105、CD90和 CD44,而低表达血源性标志物CD45、CD19、巨噬细胞表面分化抗原CD14及B细胞表面抗原CD79a,2种源性细胞无明显差异。
为验证GFP转基因小鼠的UCMSCs及BMSCs的多向分化潜能,在不同培养条件下,本研究采用成脂及成骨诱导试剂盒对第3代细胞进行体外诱导。结果表明:UCMSCs和BMSCs经成脂及成骨诱导培养后,通过油红O染色证实分化为脂肪细胞,经茜红素染色证实分化为成骨细胞。脐带MSCs向脂肪细胞及成骨细胞分化潜能远远高于骨髓MSCs,脐带MSCs将更有利于干细胞的实验研究及临床应用。
综上所述,本研究建立了GFP转基因小鼠的UCMSCs和BMSC原代培养方法,通过对2种源性细胞进行体外传代培养、生长增殖特性、细胞表型鉴定、诱导分化潜能等的生物学特性的对比研究,证实UCMSCs可作为一种方便、高效的示踪干细胞,为研究干细胞龛调控机制打下良好的细胞学基础。
[1] Kanatsu-Shinohara M,Kato M,Takehashi M,et al.Production of transgenic rats via lentiviral transduction and xenogeneic transplantation of spermatogonial stem cells[J].Biol Reprod,2008,79(6):1121-1128.
[2] 李秀梅,尤玉琴,刘光泽,等.慢病毒介导的绿色荧光蛋白转基因小鼠的制备及鉴定[J].解放军医学杂志,2011,36(9):964-966.
[3] Stephens DJ,Allan VJ.Light microscopy techniques for live cell imaging[J].Science,2003,300(5616):82-86.
[4] Kim SS,Lim SH,Hong YS,et al.Tissue engine eering of heart valves in vivo using bone marrow-derived cells[J].Artif Organs,2006,30(7):554-557.
[5] Lippincott-Schwartz J,Patterson GH.Development and use of fluorescent protein markers in living cells[J].Science,2003,300(5616):87-91.
[6] 段晴月,董金山,金超威,等.绿色荧光蛋白转基因小鼠骨髓间充质干细胞的体外培养和鉴定[J].牙体牙髓牙周病学杂志,2010,20(4):196-199.
[7] 辛 毅,李 娜,黄益民,等.人脐带间充质干细胞的原代培养及多向分化潜能的研究[J].细胞与分子免疫学杂志,2013,29(3):1087-1093.
[8] Short B,Brouard N,Occhiodoro-Scott T,et al.Mesenchymal stem cells[J].Arch Med Res,2003,34(6):565-571.
[9] 辛 毅,刘小希,赵 伟,等.差速贴壁法分离兔骨髓源性间充质干细胞和内皮祖细胞及其生物学特性的研究[J].中国实验血液学杂志,2013,21(3):746-753.
[10]肖 盼,陈 剑,王彦平,等.不同消化分离方法分离人羊膜间充质干细胞效果比较[J].中国病理生理杂志,2010,26(5):1033-1037.
[11] Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
