血管生成因子在糖尿病大鼠心肌组织的表达*
2014-11-08陈林林韦晓敏陈力铨朱立光
陈林林, 桂 春, 韦晓敏, 陈力铨, 朱立光
糖尿病心肌病是一种特异性的心肌病变,其特异性的心肌微血管病变在发病过程中起着重要作用。在糖尿病动物模型发现血管生成因子与糖尿病相关微血管病变的发生与进展密切相关[1-3]。血管生成因子分为两类:一类是促血管生成因子,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素1(angiopoietin-1,Ang-1)和血管生成素2(angiopoietin-2,Ang-2);另一类是抑制血管生成因子,包括内皮抑素(endostatin)和血管抑素(angiostatin),这两类血管生成因子相互作用参与生理性和病理性血管形成。已有研究证实血管生成正负调节因子的平衡失调与糖尿病肾病、糖尿病视网膜微血管并发症发生进展有关[2,4]。本研究采用链脲佐菌素(streptozotocin,STZ)诱导糖尿病大鼠心肌病模型,检测 VEGF、Ang-1、Ang-2和 endostatin在心肌组织的表达,从分子水平和组织功能学的角度,探讨上述指标与糖尿病大鼠心肌病之间的关系。
材料和方法
1 动物
选取健康清洁级8周龄雄性SD大鼠25只,体重180~220 g,由广西医科大学实验动物中心提供,每笼2只,饲养于标准环境,自由进食。
2 主要试剂
STZ(Sigma);多克隆山羊抗 VEGF、Ang-2和GAPDH抗体,HRP标记山羊抗兔IgGⅡ抗,HRP标记兔抗山羊IgGⅡ抗(Santa Cruz);多克隆兔抗Ang-1抗体(PTG);多克隆兔抗endostatin(Abcam);鼠抗人单克隆抗体CD31(北京中杉金桥生物技术有限公司);MaxVision试剂盒(福州迈新生物技术开发有限公司);ECL发光试剂盒(Pierce);血糖仪及血糖试纸(罗氏公司);小动物呼吸机及MPA心功能分析系统(上海奥尔科特生物科技有限公司)。
3 主要方法
3.1 动物分组和模型建立 将大鼠按电脑随机数法分为正常对照组(control,n=10)和糖尿病组(diabetes mellitus,DM,n=15)。大鼠禁食 12 h,糖尿病组腹腔内注射STZ溶液55 mg/kg,对照组予等量0.1 mmol/L柠檬酸-柠檬酸钠缓冲液腹腔注射。用血糖仪监测鼠尾静脉血糖,血糖稳定7 d后,以血糖>16.7 mmol/L并出现多饮、多食、多尿现象的大鼠纳入糖尿病组研究,其中成模大鼠13只。实验过程中糖尿病组死亡3只。死因可能是感染、糖尿病酮症酸中毒或糖尿病其它并发症。最终共有20只完成实验。糖尿病组10只,对照组10只。
3.2 心功能检测 分别于造模成功后第12周,给予10%水合氯醛麻醉大鼠,行气管切开插管,接小动物呼吸机,潮气量1~2 mL/100 g,自左侧胸骨旁纵行切开,打开胸腔显露心尖,将含肝素液导管自心尖向心底方向插入左心室腔内,导管另一头连接于压力换能器,导入MPA心功能分析系统记录左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末期压力(left ventricular end-diastolic pressure,LVEDP)、左心室压力上升最大速率(+dp/dtmax)、左心室压力下降最大速率(-dp/dtmax)。
3.3 组织标本获取方法 分别于造模成功后第12周处死大鼠,待检测完心功能后迅速取出心脏,用冷PBS洗净,滤纸吸干,称取并记录心脏质量,分离心脏左右心室,分别称量左右心室质量,计算心脏质量/体质量。将心脏标本编号后,一部分心肌组织用4%多聚甲醛固定,备用于Masson染色和CD31免疫组化染色。一部分心肌组织立即置入液氮中保存用于蛋白印记(Western blotting)检测。
3.4 Masson染色方法 取出经4%多聚甲醛固定的左心室组织,经脱水、透明、浸蜡、包埋后,将石蜡切片至厚5 mm,行Masson染色。在显微镜下,胶原纤维呈蓝紫色,心肌纤维呈红色。每个标本选取5个视野,使用Image-Pro Plus 6.0图像分析系统分析心肌胶原容积分数(collagen volume fraction,CVF;胶原面积/总面积)。
3.5 左心室组织CD31免疫组化染色 采用Max-Vision两步法:取左心室中1/3心室组织.经过固定、脱水、透明、浸蜡、包埋、切片脱蜡和水化后,组织抗原修复,3%过氧化氢阻断内源性过氧化物酶的活性等步骤,加入单克隆抗体CD31在4℃孵育过夜,每张切片加50 μL即用型MaxVision试剂,室温下孵育15 min,每张滴加100 μL新鲜配制的DAB溶液,冲洗后苏木素复染。显微镜下观察:凡呈棕色单个内皮细胞或内皮细胞群者均作为1个血管计数,但有平滑肌层及管腔直径大于20 μm血管排除。计数方法:每张染色切片在低倍镜下选取毛细血管最高区域,然后在400倍镜下选择5个不同的视野,运用Image-Pro Plus 6.0图像分析系统分析计算毛细血管数与心肌细胞数比值(capillary/myocyte,C/M)。
3.6 左心室组织 VEGF、Ang-1、Ang-2和 endostatin在心肌组织表达的测定 采用Western blotting方法测定大鼠左心室组织 VEGF、Ang-1、endostatin和Ang-2在心肌组织的表达。取适量大鼠左心室心肌约50 mg,液氮研磨后加入RIPA蛋白裂解液(罗氏公司)500 μL和苯甲基磺酰氟5 μL(碧云天生物技术有限公司)提取心肌组织总蛋白。用BCA蛋白浓度测定试剂盒(碧云天生物技术研究所)测定样本蛋白含量。蛋白经SDS-聚丙烯酰胺凝胶电泳,电转印至PVDF膜,剪出目的条带,室温封闭1 h,Ⅰ抗孵育过夜,洗膜10 min,共3次,Ⅱ抗室温孵育1 h,洗膜后在暗房用ECL发光试剂盒显影。用Quantity One成像系统进行蛋白条带的灰度值分析。以目的条带与内参照GAPDH条带的灰度值比值来代表目标蛋白的相对表达量,分析结果。
4 统计学处理
采用SPSS 13.0统计软件分析,计量资料以均数±标准差(mean±SD)表示,组间比较采用两样本均数比较t检验,以P<0.05为差异有统计学意义。
结 果
1 2组大鼠同期血糖及体重比较
与对照组比较,糖尿病大鼠随机血糖浓度明显高于对照组(P<0.01);造模后大鼠体重较对照组比较明显下降,第4、8和12周时体重显著低于对照组(P <0.01),见表1。
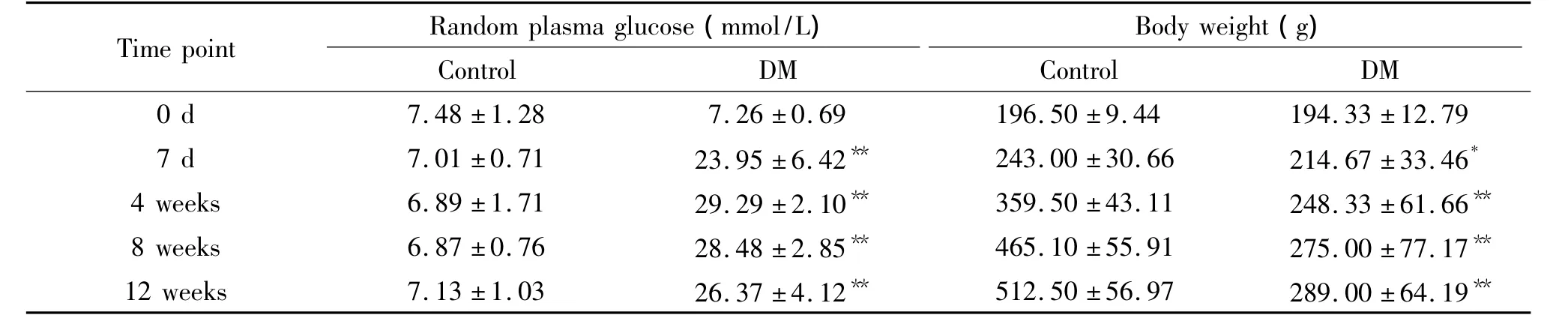
表1 对照组与糖尿病组大鼠随机血糖和体重变化Table 1.Changes of random plasma glucose and body weight in control and diabetic rats(Mean±SD.n=10)
2 2组心脏血流动力学及心功能的比较
与对照组比较,糖尿病组LVEDP明显增高(P<0.01),而 +dp/dtmax和 - dp/dtmax明显下降(P <0.05);左室收缩末压略有所下降,但差别无统计学意义(P>0.05);2组心率比较,差别无统计学意义,见图1、表2。
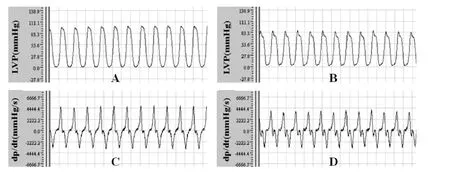
Figure 1.The changes of LVP and ±dp/dtmaxbetween control group and DM group.A:the changes of LVP in control group;B:the changes of LVP in DM group;C:the changes of±dp/dtmaxin control group;D:the changes of±dp/dtmaxin DM group.图1 2组大鼠心脏左心室压力变化及左室内压最大上升和下降速率图

表2 2组大鼠心脏血流动力学指标比较Table 2.The changes of HR,LVSP,LVEDP,+dp/dtmaxand-dp/dtmaxin control and diabetic rats(Mean±SD.n=10)
3 2组大鼠心肌组织Masson染色比较
正常大鼠心肌组织经Masson染色,在光镜下未见间质及微血管纤维化,而糖尿病组光镜下见心肌细胞空泡变,心肌间质和微血管纤维化明显,胶原纤维相互连接成网状结构,排列紊乱,分布不均,呈天蓝色(见图2箭头标志)。计算心肌CVF发现,糖尿病组心肌CVF较正常组比较明显增多,差别有统计学意义(14.59% ±3.36%vs 2.58% ±0.39%,P <0.01),见图2。
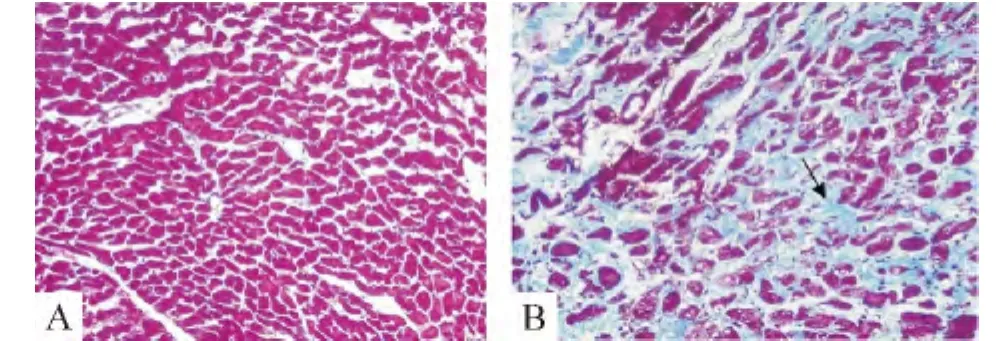
Figure 2.Masson staining of left ventricular myocardial tissues(×100).A:control group;B:DM group.图2 2组大鼠左心室心肌组织的Masson染色图
4 2组左心室组织CD31免疫组化染色结果
与正常大鼠心肌组织比较,DM组大鼠心肌组织毛细血管稀疏,计算心肌C/M值较正常组比较明显降低,差别有统计学意义(0.50±0.12 vs 0.43 ±0.11,P <0.01),见图3。
5 2组左心室组织 VEGF、Ang-1、Ang-2和 endostatin在心肌组织的表达
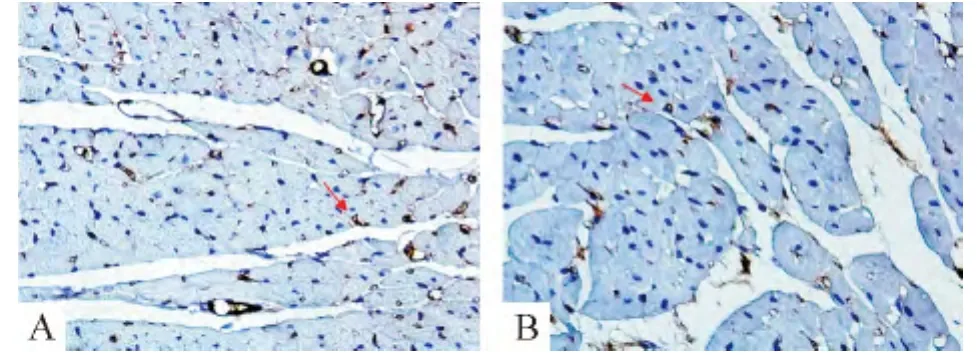
Figure 3.Immunohistochemical staining of CD31 in left ventricular myocardial tissues(MaxVision method,× 400).Red arrows indicate CD31 positive in capillary endothelial cells.A:control group;B:DM group.图3 2组大鼠左心室组织CD31免疫组化染色图
与正常对照组比较,糖尿病组大鼠心肌组织表达 VEGF(0.74 ± 0.10 vs 0.44 ± 0.07)和 Ang-1(0.49±0.06 vs 0.18 ±0.05)明 显 降 低 (均 P <0.05);endostatin较正常对照组表达明显增高(0.49 ±0.10 vs 0.66 ±0.16 ,P <0.05);而 Ang-2 无明显差异(0.54 ±0.12 vs 0.61 ±0.09,P >0.05),见图4。
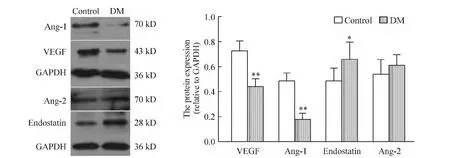
Figure 4.The expression of Ang-1,VEGF,Ang-2 and endostatin in myocardium detected by Western blotting.Mean ± SD.n=10.*P <0.05,**P <0.01 vs control.图4 2组大鼠左心室心肌组织VEGF、Ang-1、Ang-2和endostatin的表达
讨 论
糖尿病性心肌病是一种特异性心肌病,为糖尿病的严重慢性并发症之一,其典型病理改变为心肌细胞肥大,心肌间质增生及纤维化、心肌局灶性坏死、心肌微血管数目减少等。本研究以链脲佐菌素腹腔注射建立动物模型,Masson染色显示胶原含量较正常组明显增加,提示心肌间质组织出现纤维化;CD31免疫组化显示C/M比值明显减低,反映相对心肌毛细血管数减少;心脏血流动力学显示左室收缩、舒张功能均减退,提示本实验已经成功建立了糖尿病心肌病的动物模型。
糖尿病心肌微血管病变在糖尿病心肌病的进展过程起着重要作用,揣测微血管病变与心肌组织局部促血管生成因子和抑制血管生成因子失衡有关。VEGF是最主要的始动促血管生成因子,促进内皮细胞的增殖、迁移、分化启动血管的生成[5]。Sasso等[6]发现在糖尿病合并冠心病患者心肌中VEGF表达减少,其作用机制可能是通过抑制PI3K/Akt通路使心肌微血管形成受限,心肌血管密度减低,侧枝血管形成受限。Ang-1是一个重要的血管稳定因子,通过对血管平滑肌的招募,促进新生血管的成熟,在血管生成后期血管重构、成熟和稳定发挥着重要作用[7]。研究表明Ang-1/Tie-2信号通路下调,显著减弱小鼠对血管平滑肌细胞的招募,新生血管成熟受限,表现为血管功能和结构异常,如通透性增高,血管弯曲变形和不成熟[8]。而上调Ang-1信号通路,可以改善缺血心肌的微血管数目,促进血管生成[9]。Ang-1与VEGF协同参与生理和病理性血管形成,过度VEGF干预诱导不成熟血管的生成,表现为血管通透性增高,组织水肿,而Ang-1能促进新生血管的成熟稳定,能有效逆转单一VEGF所引起的血管渗漏[8,10-11]。Shin 等[12]在体外脐带静脉内皮细胞培养及小鼠下肢缺血模型发现,单独的Ang-1并不能有效的增加毛细血管的密度,联合应用Ang-1和VEGF促进成熟稳定的血管形成,改善缺血组织局部血流灌注。本实验发现与对照组比较,糖尿病大鼠心肌组织Ang-1和VEGF表达明显下调,提示在糖尿病心肌微血管数目下降与VEGF和Ang-1在心肌组织下调有关,与文献报道一致。
Ang-2是血管生成素家族另一成员,是Ang-1的天然拮抗剂,其竞争结合Tie-2,阻碍Ang-1/Tie-2磷酸化信号转导,拮抗Ang-1的血管稳定作用[13];另一方面在VEGF缺乏时,Ang-2促使内皮的凋亡,血管退化,血管数目减少,而在VEGF增加时,协同发挥促血管生成作用[4]。有研究表明早期Ang-2的过表达加上持续的Ang-1表达能促进毛细血管密度增加,有效增加缺血小鼠下肢血流灌注,单一的Ang-1或Ang-2均不能形成成熟稳定的血管,提示这种平衡失调导致新生血管形成受限[14]。本次研究发现Ang-2无明显变化,而VEGF和Ang-1显著减低,推测可能相对Ang-2增高而VEGF不足及Ang-1/Ang-2比例下调,这种比例失调导致血管生成障碍,参与糖尿病心肌病微血管病的进展。
Endostatin是一种具有潜在抗血管生成的因子,由MMP-2、MMP-9和组织蛋白酶L催化降解胶原XⅧ而产生,其具体的抗血管生成机制不明。有研究表明endostatin在糖尿病患者动脉血管中表达明显增高,可能与其上调MMP-2和MMP-9表达有关[15]。Sodha等[16]研究表明血清 endostatin水平与糖尿病冠心病患者侧支循环的建立呈负相关,而与糖尿病患者血糖水平呈正相关。本次研究发现内皮抑素在糖尿病心肌组织表达上调,可能是长期的高血糖,导致胰岛素抵抗,晚期糖基化终产物等刺激血管平滑肌细胞、内皮细胞分泌MMP-2和MMP-9,水解胶原XⅧ增多,从而上调endostatin的表达。
综上所述,糖尿病心肌微血管病变与心肌组织促血管生成因子VEGF和Ang-1表达减少、抗血管生成因子endostatin过度表达有关。VEGF降低使血管生成的启动受限,Ang-1下调导致血管成熟发育功能障碍,而过度表达的内皮抑素进一步抑制了血管生成,使血管结构和功能异常。同时相对Ang-1/Ang-2比例失调影响糖尿病心肌血管生成。总之,这2类正负血管生成因子的平衡失调,导致糖尿病微血管功能障碍,可能是糖尿病心肌病产生的重要机制。
[1] Pfister F,Wang Y,Schreiter K,et al.Retinal overexpression of angiopoietin-2 mimics diabetic retinopathy and enhances vascular damages in hyperglycemia[J].Acta Diabetol,2010,47(1):59-64.
[2] Ichinose K,Maeshima Y,Yamamoto Y,et al.Antiangiogenic endostatin peptide ameliorates renal alterations in the early stage of a type 1 diabetic nephropathy model[J].Diabetes,2005,54(10):2891-2903.
[3] 田河林,韦立顺,许忠新,等.糖尿病小鼠肾小球微血管密度与VEGF表达的研究[J].中国病理生理杂志,2012,28(2):358-361.
[4] Peters S,Cree IA,Alexander R,et al.Angiopoietin modulation of vascular endothelial growth factor:effects on retinal endothelial cell permeability [J].Cytokine,2007,40(2):144-150.
[5] Tomanek RJ,Holifield JS,Reiter RS,et al.Role of VEGF family members and receptors in coronary vessel formation[J].Dev Dyn,2002,225(3):233-240.
[6] Sasso FC,Torella D,Carbonara O,et al.Increased vascular endothelial growth factor expression but impaired vascular endothelial growth factor receptor signaling in the myocardium of type 2 diabetic patients with chronic coronary heart disease [J].J Am Coll Cardiol,2005,46(5):827-834.
[7] Kobayashi H,Debusk LM,Babichev YO,et al.Hepatocyte growth factor mediates angiopoietin-induced smooth muscle cell recruitment[J].Blood,2006,108(4):1260-1266.
[8] Chen JX,Stinnett A.Disruption of Ang-1/Tie-2 signaling contributes to the impaired myocardial vascular maturation and angiogenesis in type II diabetic mice[J].Arterioscler Thromb Vasc Biol,2008,28(9):1606-1613.
[9] Chen JX,Stinnett A.Ang-1 gene therapy inhibits hypoxiainduciblefactor-1α (HIF-1α )-prolyl-4-hydroxylase-2,stabilizes HIF-1α expression,and normalizes immature vasculature in db/db mice [J].Diabetes,2008,57(12):3335-3343.
[10] Kupatt C,Hinkel R,Pfosser A,et al.Cotransfection of vascular endothelial growth factor-A and platelet-derived growth factor-B via recombinant adeno-associated virus resolves chronic ischemic malperfusion:role of vessel maturation[J].J Am Coll Cardiol,2010,56(5):414-422.
[11] Smith AH,Kuliszewski MA,Liao C,et al.Sustained improvement in perfusion and flow reserve after temporally separated delivery of vascular endothelial growth factor and angiopoietin-1 plasmid deoxyribonucleic acid[J].J Am Coll Cardiol,2012,59(14):1320-1328.
[12] Shin SH,Lee J,Ahn DG,et al.Co-delivery of vascular endothelial growth factor and Angiopoietin-1 using injectable microsphere/hydrogel hybrid systems for therapeutic angiogenesis[J].Pharm Res,2013,30(8):2157-2165.
[13]Reiss Y,Droste J,Heil M,et al.Angiopoietin-2 impairs revascularization after limb ischemia [J].Circ Res,2007,101(1):88-96.
[14] Qin D,Trenkwalder T,Lee S,et al.Early vessel destabilization mediated by angiopoietin-2 and subsequent vessel maturation via angiopoietin-1 induce functional neovasculature after ischemia [J].PLoS One,2013,8(4):e61831.
[15]Chung AW,Hsiang YN,Matzke LA,et al.Reduced expression of vascular endothelial growth factor paralleled with the increased angiostatin expression resulting from the upregulated activities of matrix metalloproteinase-2 and-9 in human type 2 diabetic arterial vasculature[J].Circ Res,2006,99(2):140-148.
[16] Sodha NR,Clements RT,Boodhwani M,et al.Endostatin and angiostatin are increased in diabetic patients with coronary artery disease and associated with impaired coronary collateral formation[J].Am J Physiol Heart Circ Physiol,2009,296(2):H428-H434.
