米诺环素调控P2X7受体抑制BV-2细胞活化的研究*
2014-11-08刘淑琼杨炼红蒋龙元叶晋豪
刘淑琼, 杨炼红△, 蒋龙元, 叶晋豪
众多研究表明,炎症反应贯穿着各种急、慢性神经系统疾病的整个病理过程[1]。近有研究显示P2X7受体位于炎症反应的上游通路,并通过多种信号转导途径影响细胞的增殖、凋亡[2]。米诺环素(minocycline,Mino)能抑制小胶质细胞活化,减少炎症介质分泌,从而达到在中枢神经系统的保护作用[3]。但是,Mino抑制小胶质细胞活化的具体机制尚未完全明确,是否与P2X7受体是否相关并未见报道。本文通过建立脂多糖(lipopolysaccharide,LPS)刺激小胶质细胞株BV-2细胞活化模型,探讨P2X7受体在Mino抑制BV-2细胞活化所起的作用。
材料和方法
1 主要试剂和仪器
DMEM/F12培养基和胎牛血清(Gibco);Mino粉剂和LPS(Sigma);RNAiso Plus、RT试剂盒和SYBR®Premix Ex TaqTMII(TaKaRa);小鼠 TNF-α ELISA 试剂盒和小鼠IL-1β ELISA试剂盒(博士德);实时荧光定量 PCR仪(Roche);兔抗鼠 P2X7受体抗体(Alomone);α-tubulinⅠ抗和HRP标记的Ⅱ抗(羊抗兔,羊抗鼠)BCA蛋白定量试剂盒(博彩公司);ECL化学发光试剂盒(Millipore)。
2 方法
2.1 BV-2细胞的培养 以含10%胎牛血清的DMEMF/12为培养液,在5%CO2、37℃条件下25 cm2培养瓶中传代培养。
2.2 MTT法测定不同浓度Mino对细胞活力的影响BV-2细胞按每孔5 000个的密度种于96孔板,待细胞贴壁过夜后,分别加入 0 μmol/L、0.1 μmol/L、1 μmol/L 和10 μmol/L Mino作用24 h,用MTT 法计算细胞存活率。
2.3 RT-PCR检测P2X7受体mRNA表达的变化按每孔20×105个细胞的密度种于6孔板中,待细胞贴壁过夜后,将细胞随机分为5组:(1)空白对照组:除培养基外未进行任何加药处理;(2)LPS对照组:加入1 mg/L LPS培养8 h;(3)LPS+0.1 μmol/L Mino组:在同 (2)组处理前加0.1 μmol/L Mino预处理30 min;(4)LPS+1 μmol/L Mino组:在同(2)组处理前加1 μmol/L Mino预处理30 min;(5)LPS+10 μmol/L Mino组:在同 (2)组处理前加10 μmol/L Mino预处理30 min。按TaKaRa公司试剂盒说明操作,提取总RNA,逆转录并通过real-time PCR检测目标cDNA,以β-actin为内参照。PCR引物,P2X7受体正义链 5′-GTCTTGCACATGATCGTCTTTTC-3′,反义链 5′-CCTCTGCTATGCCTTTGACCTT-3′;β-actin 正义链 5′-CGGCTACCACATCCAAGGAA-3′,反义链 5′-GCTGGAATTACCGCGGCT-3′(均由 TaKa-Ra合成)。反应体系为 20 μL,反应条件:95℃ 3 min预变性,95℃ 10 s,55℃ 30 s,40个循环,并在每个循环延伸末端点收集荧光信号,绘制熔解曲线。所有标本均重复检测3次,应用Relative Quantification Software 1.0软件分析,计算出Ct值,通过相对定量(relative quantity,RQ)法,计算目的基因相对于参照因子的倍数来比较基因的表达差异。最终结果以待测基因/内参照的Ct值表示。
2.4 形态学观察 按每孔5×104个细胞的密度种于24孔板中,待细胞贴壁过夜后,将细胞随机分为5组(分组同2.3,作用时间为24 h)。处理终止时在相差显微镜下拍照。
2.5 ELISA检测细胞培养液上清TNF-α及IL-1β的分泌 处理同2.4,收集各组细胞培养液上清,按ELISA试剂盒说明书检测TNF-α及IL-1β含量。
2.6 Western blotting检测P2X7受体蛋白表达的变化 分组及处理同2.4,提取各组细胞总蛋白,采用BCA法进行蛋白定量。取30 μg蛋白提取液,样品于SDS-PAGE分离后,转移到PVDF膜上。用5%BSA封闭1 h,随后分别加入P2X7受体和α-tubulin抗体,4℃孵育过夜,用TBST洗3次,每次10 min。Ⅱ抗孵育1 h后,用TBST洗3次,每次10 min,最后用ECL法显色。采用Quantity One软件分析。
3 统计学处理
数据以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析。数据采用SPSS 16.0统计软件包分析,以P<0.05为差异有统计学意义。
结 果
1 0.1 ~10 μmol/L Mino 对细胞活力的影响
由表1可见,0.1~10 μmol/L Mino对 BV-2细胞活力无显著影响。
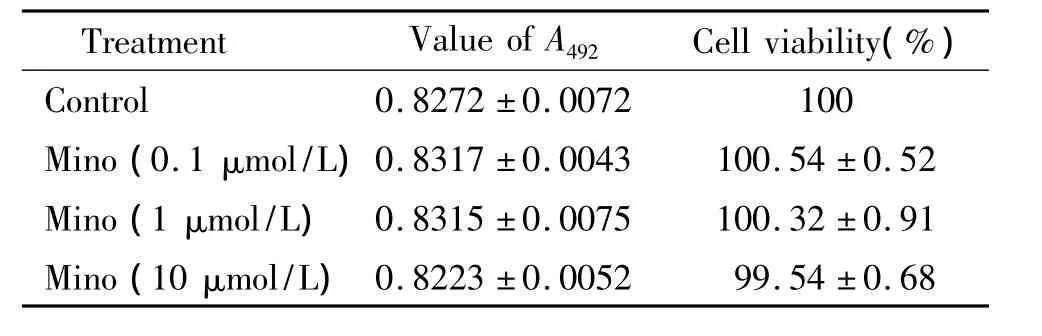
表1 不同浓度Mino处理对BV-2细胞活力的影响Table 1.The effect of different concentrations of Mino on the viability of BV-2 cells(Mean±SD.n=6)
2 各处理组P2X7受体RT-PCR结果
如图1所示,经 LPS处理后,可见 P2X7受体mRNA表达量增高,与空白对照组比,差异有统计学意义(P < 0.05)。经 0.1 μmol/L、1 μmol/L 和 10 μmol/L Mino处理后,P2X7受体mRNA表达量与LPS处理组比较,差异有统计学意义(P<0.01)。可见,0.1~10 μmol/L Mino可抑制该受体的表达。
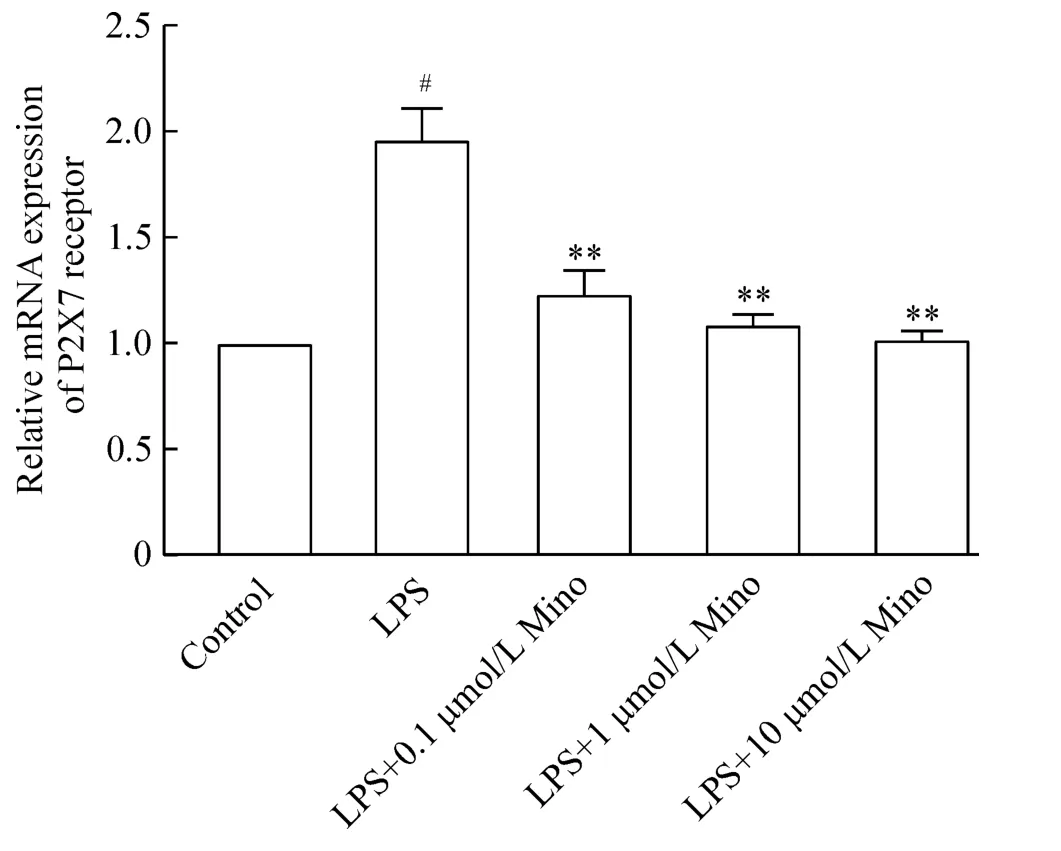
Figure 1. Effects of different concentrations of minocycline(Mino)on the mRNA expression of P2X7 receptor in LPS-induced BV-2 cells.Mean±SD.n=3.#P<0.05 vs control group;**P <0.01 vs LPS group.图1 各处理组P2X7受体的表达量
3 各处理组细胞形态学观察
如图2所示,正常情况下,BV-2细胞保持静息状态,即胞体较小,有细长的突起,呈梭形或者分枝状;经1 mg/L LPS激活后,BV-2细胞呈圆形,突起回缩,易聚团,或见细小的伪足,贴壁性较差,即为“阿米巴状”。而LPS加不同浓度Mino环素处理组,细胞的激活状态受到抑制。
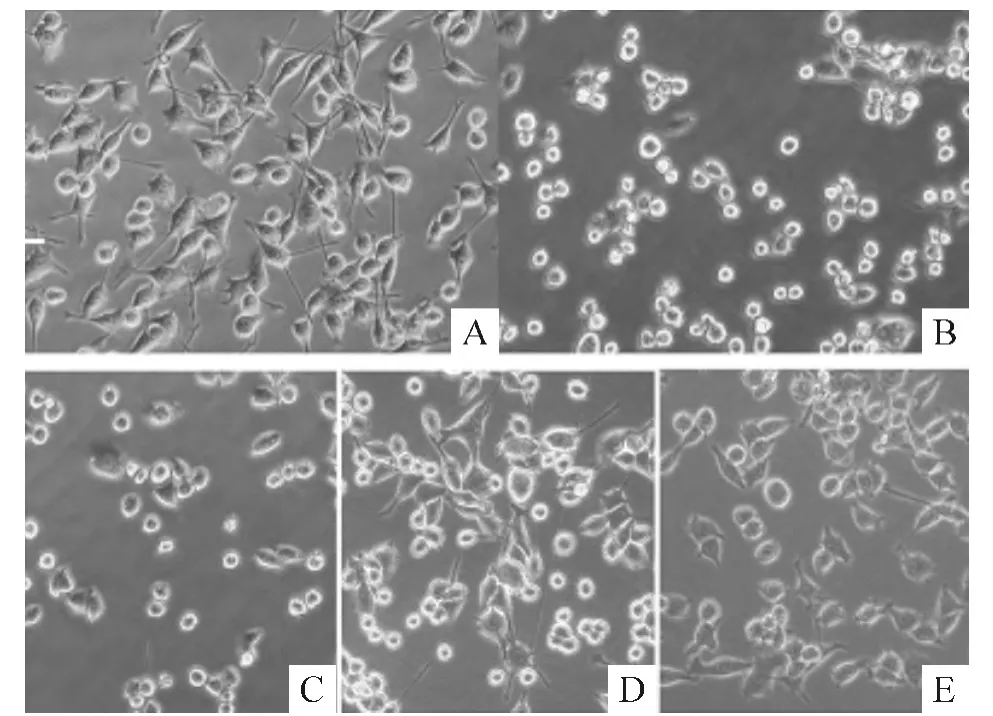
Figure 2.Morphological changes of the BV-2 cells(×200).A:control group;B:LPS group;C:LPS+0.1 μmol/L group;D:LPS+1 μmol/L group;E:LPS+10 μmol/L group.图2 各处理组细胞形态学观察
4 各处理组细胞TNF-α及IL-1β的分泌
如图3、4所示,LPS处理24 h后,细胞培养液上清TNF-α和IL-1β分泌增高,与空白对照组相比有显著差异(P<0.01)。Mino可呈量效相关地减少炎症因子的分泌,在0.1~10 μmol/L范围内,Mino的剂量越大,细胞TNF-α及IL-1β分泌越受抑制,与LPS对照组相比均有显著差异(P<0.01)。
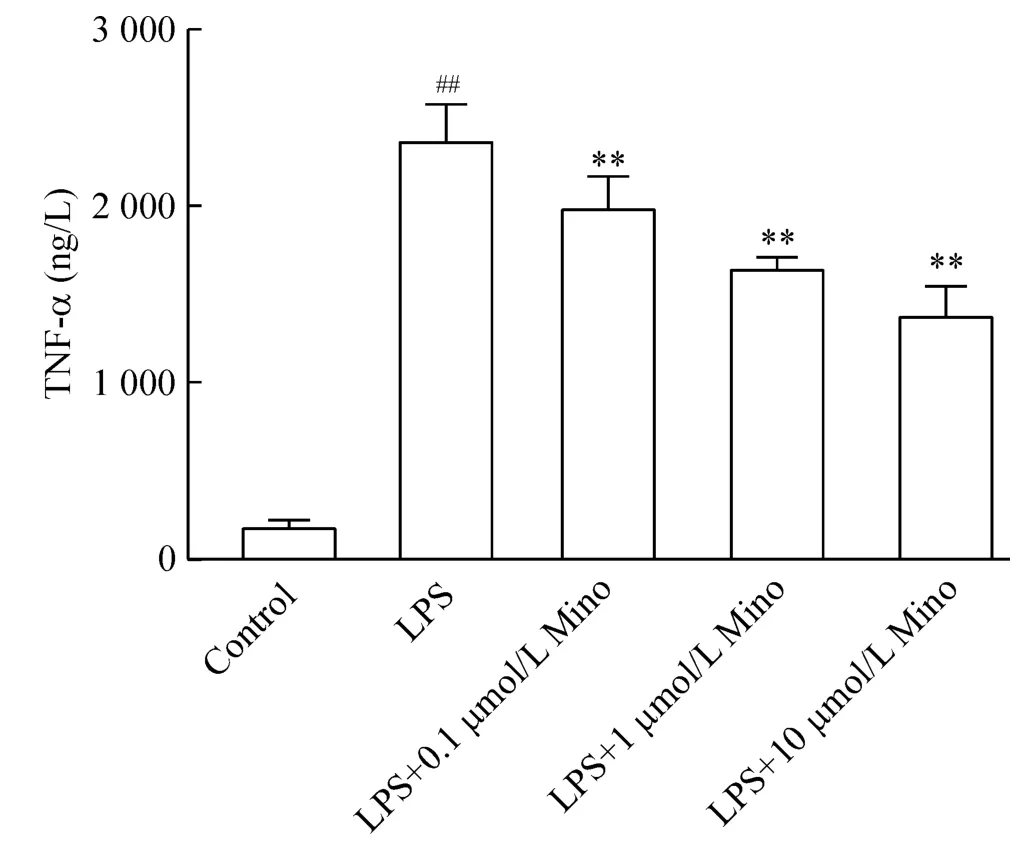
Figure 3.TNF-α concentration in the BV-2 cells with different treatments.Mean±SD.n=5.##P<0.01 vs control group;**P <0.01 vs LPS group.图3 各处理组细胞TNF-α的分泌
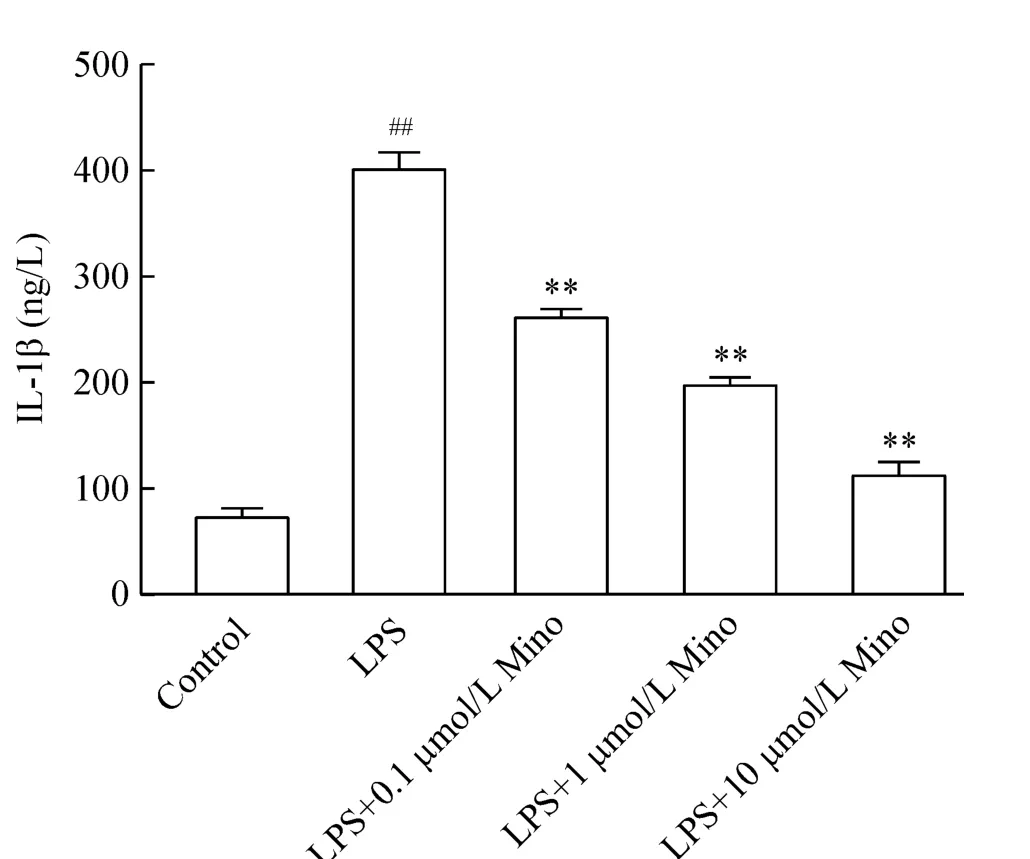
Figure 4.IL-1β concentration in the BV-2 cells with different treatments.Mean±SD.n=5.##P<0.01 vs control group;**P <0.01 vs LPS group.图4 各处理组细胞IL-1β的分泌
5 Western blotting检测P2X7受体蛋白表达的变化
LPS组的曝光带较空白对照组强,而加了Mino的各处理组曝光带均较LPS组弱。同时,各组间tubulin强度一致,见图5。

Figure 5.Effects of different concentrations of Mino on the protein expression of P2X7 receptor in LPS-induced BV-2 cells.A:control group;B:LPS group;C:LPS+0.1 μmol/L group;D:LPS+1 μmol/L group;E:LPS+10 μmol/L group.图5 Western blotting检测P2X7受体蛋白表达的变化
讨 论
P2X7受体是嘌呤核苷酸受体家族中的一员,广泛表达于神经元、星形细胞、小胶质细胞、血管内皮细胞、少突胶质祖细胞、Schwann细胞和 Müller细胞[4]。中枢神经受损时,受损神经元囊泡中的 ATP释放,激活小胶质细胞膜上的P2X7受体,进而释放大量的TNF-α和 IL-β等炎症因子。炎症反应是神经系统疾病重要的病理过程,而小胶质细胞是炎症介质的主要来源。P2X7受体因其在小胶质细胞主导的炎症介质合成、分泌中的核心地位,在神经系统疾病的病理演变中扮演着重要的角色。在阿尔茨海默病[5]、帕金森病[6]、缺血缺氧性脑病[7]、癫痫[8]等疾病中均可见小胶质细胞上P2X7受体表达增多,同时伴有 IL-1β、IL-6、TNF-α 及 COX-2的分泌增多。阻断P2X7受体表达的上调或激活无疑是炎症相关神经系统疾病治疗的靶点之一。
作为第2代半合成的四环类广谱抗生素,Mino在神经系统疾病模型中有着广泛的探索性的应用。其中机制之一即为其对小胶质细胞的抑制作用。有文献报道[9],P2X7受体特异性激动剂BZ-ATP能引起BV-2及原代培养的小胶质细胞ERK1/2、JNK1/2等通路的活化,而Mino可抑制这一变化。基于以上文献,我们探讨了P2X7受体是否与Mino抑制小胶质细胞活化的过程相关。
在本模型中,在1 mg/L LPS的刺激下,BV2细胞P2X7受体基因及蛋白水平上的表达均可见升高。该结论在不同的细胞模型中也可看到。Zhang等[10]发现,经LPS刺激人外周血单核细胞4 h后,P2X7 mRNA的表达升高,12 h后逐渐下降。而在培养的人小胶质细胞中[11],未接受LPS刺激的细胞表达少量P2X7受体,而LPS刺激1 h,该受体的表达开始升高,8 h后表达达到高峰期。有文献[12]表明,P2X7受体表达水平与小胶质细胞活性相关联。Monif等[13]的研究表明,P2X7受体过表达时,小胶质细胞从静止时长突触分支、小胞体的形态变为胞体肥大、突触回缩的阿米巴态;细胞因子也伴随增多。这与我们形态学观察及ELISA检测细胞上清液TNF-α及IL-1β结果也相符。类似结论在原代小胶质细胞模型上也可以看到[14]。
本实验结果表明,不同浓度的Mino可抑制该受体的表达,同时细胞上清液TNF-α及IL-1β分泌受抑制。我们推测,这可能与Mino抑制P2X7受体相关。有文献表明[15],P2X7受体的活性调节参与了TNF-α及IL-1β的合成及分泌过程。由此可推测,Mino通过抑制P2X7的表达及改变P2X7的活性,从而抑制BV-2细胞的活化。这将为以小胶质细胞活化为主要病理特征的神经退行性病变、癫痫、缺血性卒中等疾病的治疗提供新的思路。
[1] Cunningham C.Microglia and neurodegeneration:the role of systemic inflammation[J].Glia,2013,61(1):71-90.
[2] Takenouchi T,Nakai M,Iwamaru Y,et al.The activation of P2X7 receptor impairs lysosomal functions and stimulates the release of autophagolysosomes in microglial cells[J].Immunol,2009,182(4):2051-2062.
[3] Vezzani A,Friedman A.Brain inflammation as a biomark in epilepsy[J].Biomark Med,2011,5(5):607-614.
[4] Yu Y,Ugawa S,Ueda T,et al.Cellular localization of P2X7 receptor mRNA in the rat brain[J].Brain Res,2008,1194(15):45-55.
[5] McLarnon JG,Ryu JK,Walker DG,et al.Upregulated expression of purinergic P2X7 receptor in Alzheimer disease and amyloid-beta peptide-treated microglia and in peptide-injected rat hippocampus[J].J Neuropathol Exp Neurol,2006,65(11):1090-1097.
[6] Hracskó Z,Baranyi M,Csölle C,et al.Lack of neuroprotection in the absence of P2X7 receptors in toxin-induced animal models of Parkinson’s disease[J].Mol Neurodegener,2011,6:28.
[7] Melani A,Amadio S,Gianfriddo M.P2X7 receptor modulation on microglial cells and reduction of brain infarct caused by middle cerebral artery occlusion in rat[J].J Cerebral Blood Flow Metab,2006,26(7):974-982.
[8] Rappold PM,Lynd-Balta E,Joseph SA.P2X7 receptor immunoreactive profile confined to resting and activated microglia in the epileptic brain[J].Brain Res,2006,1089(1):171-178.
[9] Nikodemova M,Duncan ID,Watters JJ.Minocycline exerts inhibitory effects on multiple mitogen-activated protein kinases and IκBα degradation in a stimulus-specific manner in microglia[J].J Neurochem,2006,96(2):314-323.
[10] Zhang XJ,Zheng GG,Ma XT,et al.Efects of various inducers on the expression of P2X7 receptor in human peripheral blood mononuclear cells[J].Sheng Li Xue Bao,2005,57(2):193-198.
[11]Monif M,Burnstockb G,William DA.Microglia:proliferation and activation driven by the P2X7 receptor[J].Int J Biochem Cell Biol,2010,42(11):1753-1756.
[12]Choi HB,Ryu JK,Kim SU,et al.Modulation of the purinergic P2X7 receptor attenuates lipopolysaccharide mediated microglial activation and neuronal damage in inflamed brain[J].J Neurosci,2007,27(18):4957-4968.
[13] Monif M,Reid CA,Powell KL,et al.The P2X7 receptor drives microglial activation and proliferation:a trophic role for P2X7R pore[J].J Neurosci,2009,29(12):3781-3791.
[14]杨炼红,刘淑琼,徐菁特,等.米诺环素对癫痫海马小胶质细胞P2X7表达的影响[J].岭南急诊医学杂志,2012,17(6):401-403.
[15] Kim JE,Ryu HJ,Kang TC.P2X7 receptor activation ameliorates CA3 neuronal damage via a tumor necrosis factor-α-mediated pathway in the rat hippocampus following status epilepticus[J].J Neuroinflamm,2011,8:62.
