曲古抑菌素A促进小鼠骨髓间充质干细胞分化为胰岛素分泌细胞
2014-11-08李佳萦
李佳萦, 冯 烈
传统的降糖药物无法阻止胰岛β细胞的进行性衰竭。干细胞技术的发展有望解决这一难题。体外骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)分化为胰岛素分泌细胞是目前的研究热点。大量动物实验利用不同的培养方法充分证明了此种定向分化的可行性。然而,这些方法一般所需的周期较长,有的甚至达数月之久。本研究旨在尝试一种新的培养方法,有望在10 d内成功诱导BMSCs定向分化,并且探讨这种新型诱导剂——曲古抑菌素A(trichostatin A,TSA)的适宜浓度,希望为此领域的研究提供一个方便快捷、值得推广的方法。
材料和方法
1 细胞和试剂
C57BL/6小鼠骨髓间充质干细胞系购自广州赛业生物科技有限公司,干细胞完全培养基购自Gibco,曲古抑菌素A和双硫腙购自Sigma,胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)购自杭州中肽生化有限公司,细胞级二甲基亚砜(dimethyl sulfoxide,DMSO)购自 Sigma,DMEM/F12 培养基购自M&C,兔抗人胰岛素抗体购自Santa Cruz,山羊抗兔Ⅱ抗购自Invitrogene,胰岛素ELISA试剂盒购自广州外显子生物科技有限公司。
2 实验分组
实验分为5组:对照组(DMSO,A组)和干预组(25 nmol/L,B组;50 nmol/L,C组;100 nmol/L,D组;200 nmol/L,E 组)。
3 方法
3.1 细胞培养 C57BL/6小鼠骨髓间充质干细胞系培养于C57BL/6小鼠骨髓间充质干细胞完全培养基中(低糖DMEM,含10%胎牛血清、10 mmol/L HEPES、1×105U/L青霉素和100 mg/L的链霉素),在37℃、5%CO2的培养箱中培养。选择生长良好的细胞铺进25 cm2细胞培养瓶,80% ~90%时进行传代,分别用无酚红、无血清的DMEM培养基预处理,即37℃、5%CO2中培养6 h,使其处于同步化状态,根据实验要求稀释3×105细胞悬液加入铺有玻片的6孔板中培养,每24 h换液1次,共3 d。然后进行实验分组,加入TSA进行诱导处理,3 d后洗脱TSA,加入含GLP-1的高糖培养基7 d后检测各项指标。
3.2 双硫腙染色鉴定胰岛素分泌细胞 加入含GLP-1的高糖培养基7 d后进行双硫腙染色,50 mg双硫腙溶解在5 mL DMSO中,磁场搅拌30 min,0.2 μm过滤器过滤分装,-20℃避光保存。使用时将10 μL双硫腙冷溶液加入1 mL GLP-1培养液中,37℃细胞培养30 min,PBS洗3遍,倒置相差显微镜下观察胰岛样细胞。每张片选取5个视野,使用上海捷达图像分析系统,根据免疫组化的结果计算胰岛素染色阳性面积、阳性率(胰岛素染色阳性面积/细胞总面积),代表胰岛素分泌细胞的量,计算胰岛素染色积分吸光度(平均吸光度×胰岛素染色阳性面积)代表胰岛素表达总量。
3.3 免疫荧光染色鉴定胰岛素分泌表达 待检细胞首先用未标记的兔抗人胰岛素抗体(Ⅰ抗)处理,使之与特异的抗原(胰岛素)形成复合物,然后再用荧光藻红蛋白(phycoerythrin,PE)标记的山羊抗兔抗体(Ⅱ抗)着色,即可检测出胰岛素在细胞中的存在部位,以 4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole dihydrochloride,DAPI)作为对比剂。荧光显微镜下观察。以488 nm波长的激发光激发,对各样本进行扫描。采用Image-Pro Plus 6.0软件对获得的图像进行荧光强度分析,取其平均荧光值作为定量参数。
3.4 ELISA测定胰岛素含量 采用生物素双抗体夹心酶联免疫吸附法(ELISA)测定样品中小鼠胰岛素的水平。向预先包被了小鼠胰岛素单克隆抗体的酶标孔中加入胰岛素,温育;温育后加入生物素标记的抗胰岛素抗体,再与链霉亲和素-HRP结合,形成免疫复合物,再经过温育和洗涤,去除未结合的酶,然后加入底物A、B,产生蓝色,并在酸的作用下转化成最终的黄色,颜色的深浅与样品中小鼠胰岛素的浓度成正比。以空白调零,450 nm波长依序测量各孔的吸光度(A)。根据标准品的浓度及对应的A值计算出标准曲线的直线回归方程,再根据样品的A值在回归方程上计算出对应样品的胰岛素含量。
4 统计学处理
应用SPSS 13.0统计软件分析,数据用均数±标准差(mean±SD)表示,不符合正态分布者经自然对数校正后进行分析,计量资料的多组比较采用方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 细胞形态观察
生长良好的C57BL/6小鼠骨髓间充质干细胞应用倒置相差显微镜观察其形态,各个实验组间细胞形态上无明显差异,呈典型的长梭形样外观,极性排列,细胞轮廓清楚,见图1。经过TSA干预3 d后,光镜下可见,各个实验组间细胞数目及形态上有明显差异。干预组中,随着TSA浓度的增加,细胞的极性生长越来越明显,死亡细胞的数目越来越多,而对照组中细胞形态及数目无明显变化,见图2。

Figure 1.Morphology of C57BL/6 mouse mesenchymal stem cells under optical microscope.图1 C57BL/6小鼠骨髓间充质干细胞在光学显微镜下的形态

Figure 2.Morphology of the cells treated with TSA for 3 d(×100).图2 TSA干预3 d后各组细胞形态
2 双硫腙染色鉴定胰岛素分泌细胞
加入含GLP-1的高糖培养基7 d后进行双硫腙染色。光镜下可见各干预组形成胰岛样细胞,胞浆可见棕黄色囊泡样结构,且随着TSA浓度的增加,胞浆内棕黄色囊泡样着色逐渐减弱,呈负相关;对照组未见胞浆棕黄色囊泡样结构,见图3。免疫组化半定量分析显示,B组胰岛素染色阳性面积、阳性率以及胰岛素染色积分吸光度显著高于其它干预组,差异有统计学意义(P<0.05),见表1。
3 免疫荧光染色鉴定胰岛素分泌
荧光显微镜观察显示,细胞呈长梭形极性排列,细胞核呈蓝色。各干预组均见红色颗粒状物质散在均匀分布于胞浆中以及细胞外,且随着TSA浓度的增加,红色荧光逐渐减弱,呈负相关;对照组未见红色颗粒状物质,见图4。免疫荧光图像分析显示,B组平均荧光强度显著高于其它干预组,差异有统计学意义(P<0.05),见表1。
4 ELISA测定胰岛素含量
各组细胞在相应的培养基中培养10 d后,1 500 r/min离心10 min,收集上清,ELISA测定各组胰岛素的含量,结果发现随着TSA干预浓度的增加,胰岛素的含量逐渐减少。B组胰岛素含量显著高于其它组,差异有统计学意义(P<0.05),见表2。
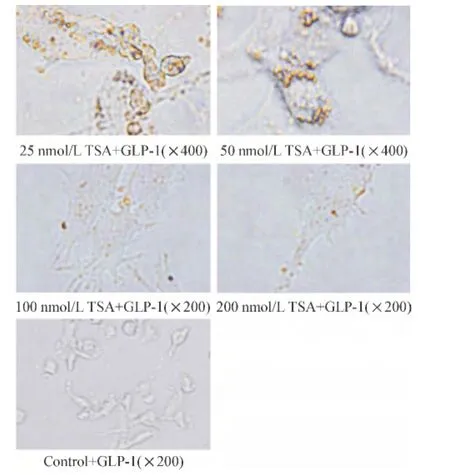
Figure 3.The insulin-secreting cells in each group identified by dithizone staining.图3 双硫腙染色鉴定胰岛素分泌细胞
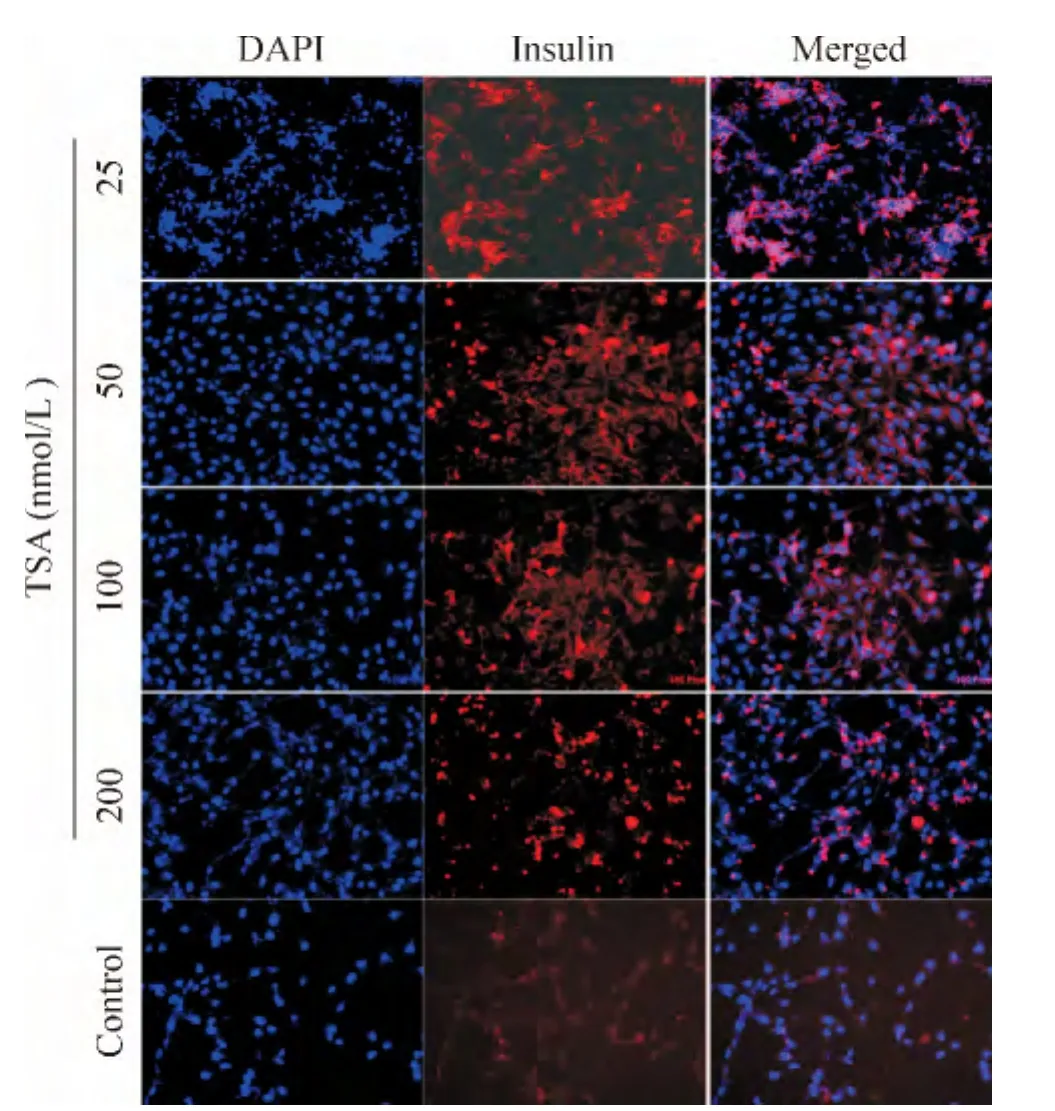
Figure 4.Insulin secretion of insulin-producing cells detected by immunofluorescent staining(×200).图4 免疫荧光染色鉴定胰岛素分泌细胞的胰岛素分泌

表1 各组免疫组化及免疫荧光半定量分析Table 1.Immunohistochemical and immunofluorescence semi-quantitative analysis in different groups(Mean±SD.n=5)
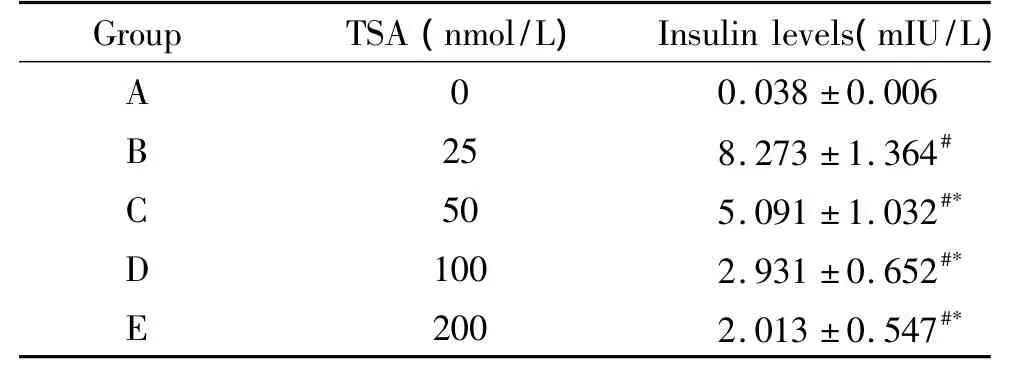
表2 各组胰岛素含量的比较Table 2.Comparison of insulin contents in each group(Mean±SD.n=5)
讨 论
糖尿病已经成为一个新的流行性疾病。据最新的调查研究显示,目前我国成人糖尿病患者约有1.14亿[1]。传统的药物治疗都不能阻止胰岛β细胞的进行性衰竭。干细胞诱导分化为胰岛素分泌细胞的研究可能为临床胰岛细胞移植提供充足的供体细胞,揭开了糖尿病治疗全新的一页。与胚胎干细胞相比,成体干细胞特别是BMSCs,具有取材方便、无免疫干扰以及避免法律和伦理学的限制等优点,许多针对动物模型的研究表明,将BMSCs诱导分化成为胰岛素分泌细胞,可以用来治疗糖尿病[2-5]。体外BMSCs诱导分化为胰岛素分泌细胞的方法有很多,然而这些方法一般所需的周期较长,有的甚至达数月之久。因此,本领域需要一种简单、快速的方法,能够方便有效地将BMSCs诱导分化为胰岛素分泌细胞。
组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白脱乙酰酶(histone deacetylase,HDAC)决定组蛋白乙酰化状态,调节基因转录。HAT和HDAC的异常与肿瘤的发生有着密切的关系。近年来大量研究表明,组蛋白脱乙酰酶抑制剂(histone deacetylase inhibitor,HDACI)可抑制肿瘤细胞增殖,诱导肿瘤细胞分化和凋亡,并可发挥免疫调节作用,是新一代具有广泛应用前景的抗肿瘤药[6-7]。TSA源自链霉菌代谢产物,最先作为抗真菌药物使用[8]。近来研究表明其具有明显的组蛋白去乙酰化酶抑制剂活性,对肝癌、胃癌、口腔癌及人神经母细胞瘤等肿瘤细胞具有明显的细胞毒作用[9]。而且,随着对胰腺的进一步研究发现,TSA能够阻止细胞因子诱导的β细胞凋亡以及核因子κB(nuclear factor kappa B,NF-κB)下调后 β细胞功能的受损[10]。而且能够剂量依赖性地显著增强C2C12骨骼肌细胞胰岛素刺激的血糖摄取和糖原合成,以及丝氨酸-苏氨酸蛋白激酶(serine/threonine protein kinase,AKT)和糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)通路的信号转导,在HDAC2下调后,这种效应仍然存在,表明HDAC2可能是调节胰岛素敏感性的潜在靶点[11]。也有学者发现,胰岛素受体底物1的乙酰化能够增强酪氨酸磷酸化以及促进胰岛素刺激的信号转导[12]。Tayaramma 等[13]研究发现,55 nmol/L TSA能够促进小鼠BMSCs分化为胰岛样细胞。目前已经证实胰腺间充质干细胞是骨髓来源[14],表明骨髓来源的间充质干细胞与胰腺的发生发育之间存在紧密联系。因此,本实验选取BMSCs作为研究对象,并在Tayaramma等研究基础上,选取 25 nmol/L、50 nmol/L、100 nmol/L 和 200 nmol/L 4个梯度浓度作为实验浓度,验证Tayaramma等研究结果,探讨TSA这种HDACI在诱导干细胞分化方面的作用,并且尝试寻找此种新型诱导剂应用于该领域的适宜浓度。由于TSA原始包装是溶于DMSO中,因此本实验选取单纯DMSO与细胞共培养作为对照组。实验结果显示,25 nmol/L TSA即可诱导C57BL/6小鼠BMSCs分化成为胰岛素分泌细胞,并且分泌胰岛素;随着各干预组TSA浓度的升高,胰岛素的分泌量减少。大量研究表明,TSA具有明显的细胞毒作用,能够激活肿瘤细胞的凋亡通路[15]以及增强机体对肿瘤的免疫应答[16]。Nakajima等[17]研究发现,500 nmol/L时 TSA能够自身诱导低水平的肿瘤细胞凋亡。因此,与 Tayaramma等[13]报道结果相比较,我们认为25 nmol/L TSA可有效诱导C57BL/6小鼠BMSCs分化成为胰岛素分泌细胞,且细胞毒性小,是采用TSA进行干预的适宜浓度。
综上所述,针对目前存在众多诱导骨髓间充质干细胞分化为胰岛素分泌细胞的方法,且这些方法一般所需的周期较长,本研究在国内首次利用一种新型的诱导剂TSA,能够成功在10 d内将小鼠BMSCs诱导分化为胰岛素分泌细胞,并且进一步探讨TSA的适宜浓度为25 nmol/L。
[1] Xu Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310(9):948-959.
[2] Ye X,Yan T,Chopp M,et al.Combination BMSC and Niaspan treatment of stroke enhances white matter remodeling and synaptic protein expression in diabetic rats[J].Int J Mol Sci,2013,14(11):22221-22232.
[3] Ansari MM,Sreekumar TR,Chandra V,et al.Therapeutic potential of canine bone marrow derived mesenchymal stem cells and its conditioned media in diabetic rat wound healing[J].J Stem Cell Res Ther,2013,3:141.
[4] Zhao YF,Zeng DL,Xia LG,et al.Osteogenic potential of bone marrow stromal cells derived from streptozotocininduced diabetic rats[J].Int J Mol Med,2013,31(3):614-620.
[5] Beck Jr GR,Khazai NB,Bouloux GF,et al.The effects of thiazolidinediones on human bone marrow stromal cell differentiation in vitro and in thiazolidinedione-treated patients with type 2 diabetes[J].Transl Res,2013,161(3):145-155.
[6] Paterson S,Sin KL,Tiang JM,et al.Histone deacetylase inhibitors increase human arylamine N-acetyltransferase-1 expression in human tumor cells[J].Drug Metab Dispos,2011,39(1):77-82.
[7] Konsoula Z,Velena A,Lee R,et al.Histone deacetylase inhibitor:antineoplastic agent and radiation modulator[J].Adv Exp Med Biol,2012,720:171-179.
[8] 马 爽,翟志勇,郭 阳.曲古霉素A促进胶质瘤细胞系凋亡[J].解剖科学进展,2013,19(3):282-285,289.
[9] Gothalwal R,Gupta P.Pharma-active compounds of microbial origin and their diversity[M]∥ Maheshwari DK,Dubey RC,Saravanamurthu R.Industrial exploitation of microorganisms.1st ed.New Delhi:I.K.International Publshing House,2010:375.
[10]Sato T,Kotake D,Hiratsuka M,et al.Enhancement of inflammatory protein expression and nuclear factor κB(NF-κB)activity by trichostatin A(TSA)in OP9 preadipocytes[J].PLoS One,2013,8(3):e59702.
[11]Pirola L,Zerzaihi O,Vidal H,et al.Protein acetylation mechanisms in the regulation of insulin and insulin-like growth factor 1 signalling[J].Mol Cell Endocrinol,2012,362(1-2):1-10.
[12] Sun C,Zhou J.Trichostatin A improves insulin stimulated glucose utilization and insulin signaling transduction through the repression of HDAC2[J].Biochem Pharmacol,2008,76(1):120-127.
[13] Tayaramma T,Bin M,Manfred R,et al.Chromatin-remodeling factors allow differentiation of bone marrow cells into insulin-producing cells[J].Stem Cells,2006,24(12):2858-2867.
[14]Sordi V,Melzi R,Mercalli A,et al.Mesenchymal cells appearing in pancreatic tissue culture are bone marrow-derived stem cells with the capacity to improve transplanted islet function[J].Stem Cells,2010,28(1):140-151.
[15]Hong Z,Han Z,Xiao M,et al.Microarray study of mechanism of trichostatin a inducing apoptosis of Molt-4 cells[J].J Huazhong Univ Sci Technolog Med Sci,2009,29(4):445-450.
[16] DuPage M,Jacks T.Genetically engineered mouse models of cancer reveal new insights about the antitumor immune response[J].Curr Opin Immunol,2013,25(2):192-199.
[17] Nakajima S,Niizeki H,Tada M,et al.Trichostatin A with adenovirus-mediated p53 gene transfer synergistically induces apoptosis in breast cancer cell line MDA-MB-231[J].Oncol Rep,2009,22(1):143-148.
